脂肪间充质干细胞对CCl4 致犬急性肝损伤的临床疗效
2022-10-25陈佳雯钟培生冯士彬吴金节王希春
汪 洋,陈佳雯,王 正,金 鑫,马 立,钟培生,冯士彬,李 玉,吴金节,王希春
(安徽农业大学动物科技学院,合肥 230036)
犬在人类生活中扮演着重要的角色,其健康问题也越来越受重视,其中犬急性肝损伤是犬常见的肝脏疾病,也是一类不易治疗的疾病。犬的急性肝损伤可能由多种原因导致,病毒、药物等都能破坏肝细胞导致肝损伤[1]。急性肝损伤病理变化也比较复杂,主要表现为肝细胞变性、肝细胞凋亡或坏死、肝细胞脂肪变性、炎性反应、胆汁淤积性等异常。化学性肝损伤是常见的急性肝损伤类型,病变速度快,且临床上暂无特效药治疗。研究出能高效治疗犬急性肝损伤的药物是一个新的研究方向,对于急性肝损伤的治疗研究中首先要建立急性肝损伤模型,其中用四氯化碳(CCl4)建模的方法,重复性好,准确性高,是公认的化学性肝损伤经典模型之一[2,3]。张春雷[4]在研究复方甘草酸苷片对犬急性肝损伤的有效性和安全性时,发现使用50% CCl4油溶液1.0 mL·kg-1腹腔给药可建立稳定的犬急性肝损伤模型。
对于人类急性肝损伤的治疗,临床上会使用肝脏移植或者肝细胞移植等方法,但是不仅费用高昂、来源短缺、操作复杂,还会出现免疫排斥反应,所以并不适合用于犬类的治疗[5]。近年来,干细胞治疗法成为肝损伤治疗的新的研究热点,大量的动物实验和临床试验已经证实了该方法的安全性及有效性。其中脂肪间充斥干细胞(adipose mesenchymal stem cells, ADMSCs)分离自脂肪组织的基质血管部分,具有体外扩增和多向分化的潜能,并且材源丰富,获取便捷,被广泛研究[6]。ADMSCs 在体外特定环境诱导后,可分化为肝脏样细胞(hepatocytelike cells, HLCs),也能表达肝细胞表面特标记物[7]。由ADMSCs 分化而来的肝细胞和正常的肝细胞在基因表达方面比较相似[8]。研究表明,分离获得的ADMSCs,经过成纤维细胞生长因子和肝细胞生长因子培养后表达出高度的肝细胞分化能力,且表达肝细胞的特异性标记物[9]。ADMSCs 和其他间充质干细胞一样,主要组织相容性复合体(major histocompatibility complex,MHC)分子表达低,即免疫原性弱,移植排斥反应发生率低[10]。邓丽斯[11]将从小鼠脂肪中分离培养的ADMSCs,经尾静脉移植到CCl4致急性肝损伤的小鼠体内,发现小鼠肝脏指标明显改善,存活率提高。
目前,还鲜见ADMSCs 对犬急性肝损伤治疗效果的报道,犬急性肝损伤临床尚无特效药,绝大多数都是通过积极的支持治疗和综合治疗等方案,效果不理想。鉴于此,本试验选用0、0.5、1.0 和1.5 mL·kg-1的50 % CCl4花生油溶液进行犬急性肝损伤造模,研究ADMSCs 的治疗效果,以期为临床犬肝损伤病例的治疗探索新的药物。
1 材料与方法
1.1 材料
1.1.1 试验动物 35 只2 岁龄健康雄性比格犬,由南京亚东实验动物研究开发中心提供,体质量(10.75±0.25)kg。饲喂环境完全相同,10 d 内临床检查和生化指标检测一切正常,处于健康状态。
1.1.2 主要试剂和仪器 试剂均购于国药集团化学试剂有限公司;ADMSCs 悬液,购于威盛医疗技术(深圳)有限公司;谷丙转氨酶(ALT)和谷草转氨酶(AST)试剂盒,购于南京建成生物有限公司;血常规分析仪,购于深圳迈瑞生物医疗电子股份有限公司BC-2800 Vet;生化分析仪,购于美国爱德士生物科技有限公司VetTest8008;生物显微镜,购于日本奥林巴斯株式会社CX31 兽用。
1.2 方法
1.2.1 CCl4造模最佳剂量的筛选 根据文献报道及预实验,选择临床检查健康的20 只犬随机分成4 组,每组5 只,标号为A、B、C、D 组,A 组为对照组,不进行特殊处理,B、C、D 为试验组。将所有犬只腹部剃毛,表皮消毒后,分别以0.5、1.0 和1.5 mL·kg-1的剂量向腹腔注射50 % CCl4花生油溶液。
连续7 d,在早晨未进食前进行血液采集(颈静脉采集),每只犬采集血液4 mL,并观察临床症状,检测血清ALT、AST。在造模的第3 天和第7 天,分别从各组随机挑选出2 只犬,麻醉后打开腹腔采取肝脏样本,取出后立马放入10%的甲醛溶液保存,送至武汉赛维尔生物科技有限公司进行病理学检查。
1.2.2 ADMSCs 治疗CCl4致犬急性肝损伤效果对比 选择15 只体重约10 kg 的健康雄性犬,经腹腔注射1.0 mL·kg-150 % CCl4花生油溶液诱导急性肝损伤,观察3 d,模型稳定后随机分成3 组每组5只,标为E、F、D 组,其中E 组为不进行任何治疗的对照组,F 组进行犬ADMSCs 细胞治疗,D 组则进行普通临床治疗。
治疗周期为10 d,每只犬每天空腹采血进行生化水平检测。同时在第5 天和第10 天从各组试验犬中随机挑选2 只麻醉后进行肝脏取样,将样品放入10 %的甲醛溶液保存,送至武汉赛维尔生物科技有限公司进行病理学切片检查。
2 结果与分析
2.1 CCl4 造模最佳剂量筛选结果与分析
2.1.1 血清ALT、AST 活性分析 ALT 活性变化(表1)显示: A 组7 d 间未出现显著升高;B 组在造模后的第4 天开始显著升高;C 组在第3 天开始出现显著升高,在第6 天和第7 天之间数值相比没有明显差异(P>0.05);D 组在第3 天出现显著升高,并且在第6 天和第7 天之间数值相比依旧存在显著差异(P<0.05)。

表1 给药后血清ALT 活性变化Table 1 Changes in serum ALT activity after administration (U·L-1)
AST 活性变化(表2)显示:A 组7 d 间未出现显著升高;B 组自造模第4 天开始显著升高;C 组在造模第2 天开始出现显著升高,且在第5、第6 和第7 天之间的数值比较未见显著差异(P>0.05);D 组在第2 天开始出现显著升高,但在第5、第6 和第7天之间的数值比较仍存在显著差异(P<0.05)。
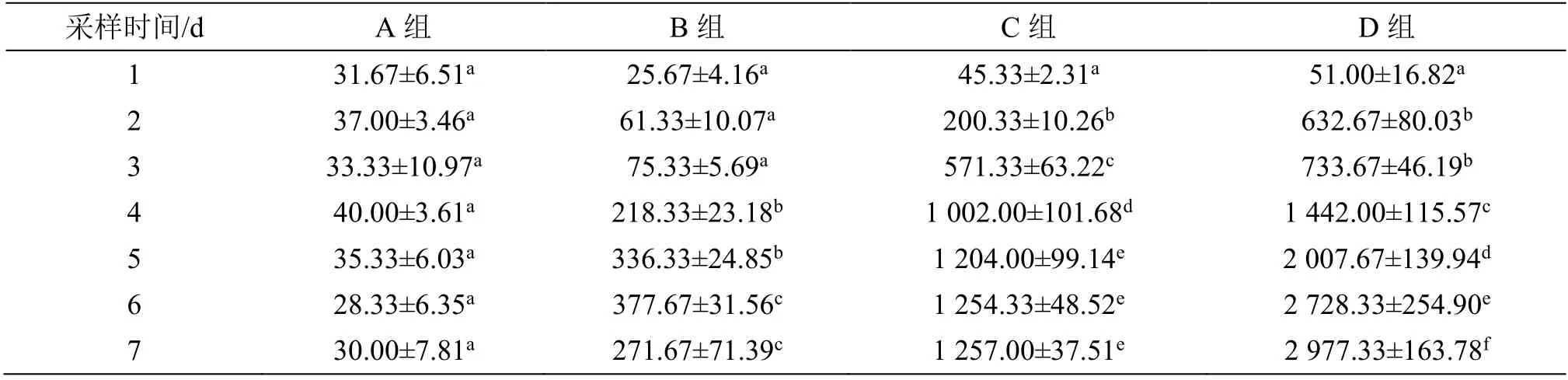
表2 给药后血清AST 活性变化Table 2 Changes in serum AST activity after administration (U·L-1)
2.1.2 临床症状分析 由图1 可见,在造模第3 天,A 组未出现任何症状,B、C、D 均出现明显症状,严重程度B<C<D,且均未发生死亡。
2.1.3 病理切片分析 由图3 可见,从第3 天到第7 天,A 组犬肝组织切片未发现明显变化。B 组犬肝组织切片第3 天出现肝细胞数量减少,肝索结构不清,第7 天可见细胞坏死,胞核固缩深染,并伴有出血。C 组犬肝组织切片第3 天肝细胞可见脂肪变性,细胞肿胀,胞质内充满脂肪空泡,第7 天伴有严重出血,淋巴等炎性细胞浸润、血管周围可见少量中心粒细胞,并可见大量肝细胞坏死。D 组犬肝组织切片第3 天可见局部静脉壁损伤,管壁结构模糊,周围肝窦严重淤血。第7 天可见大量肝细胞坏死,平滑肌纤维排列疏松,管壁层次不清,组织炎症反应极度明显。
通过以上各项指标检测及病理切片观察发现,B 组在腹腔注射0.5 mL·kg-150 % CCl4花生油溶液后,试验犬的临床症状,肝脏生化指标,肝脏组织病理学改变后又逐渐恢复正常;C 组在腹腔注射1 mL·kg-150 % CCl4花生油溶液后,试验犬临床症状发生改变,肝脏生化指标表现异常,肝脏组织病理学也发生改变,同时无犬只发生死亡,说明剂量合适;D 组腹腔注射1 mL·kg-1的50 % CCl4花生油溶液后,试验犬造的临床症状、肝脏生化指标和肝脏组织病理学均发生异常,同时还出现试验犬死亡,可能造模剂量太大。结果表明按照1 mL·kg-1的剂量腹腔注射50 % CCl4花生油溶液可以建立稳定可靠的犬急性肝损伤模型。
2.2 ADMSCs 治疗CCl4 致犬急性肝损伤效果对比试验结果与分析
2.2.1 血清ALT、AST 活性分析 ALT 活性变化(表3)显示:E 组从第2 天起显著升高,但是第7 天至第10 天之间的数值对比没有明显变化(P>0.05)。F 组从第2 天开始出现显著降低,但在第6 至第10天之间的数值对比没有明显变化(P>0.05)。G 组从第2 天开始出现显著的降低,第6 天至第10 天之间的数值对比仍有显著差异(P<0.05)。
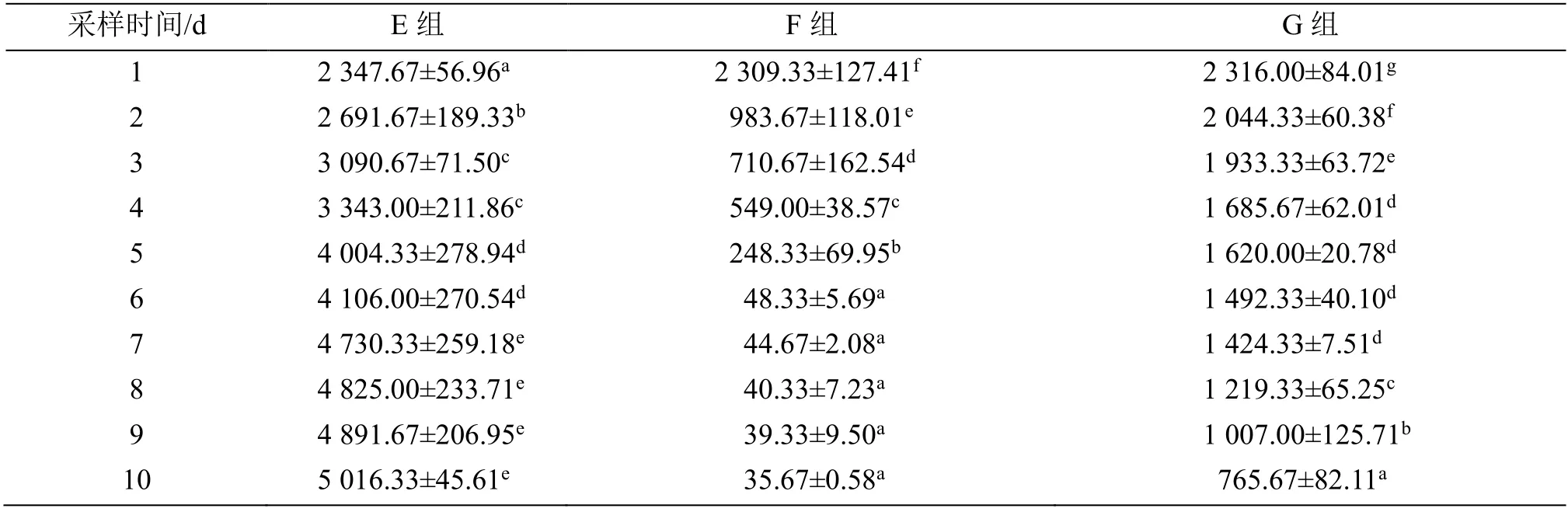
表3 给药后血清ALT 活性变化Table 3 Changes in serum ALT activity after administration (U·L-1)
AST 活性变化(表4)显示:E 组出现显著升高,在第5 天至第10 天之间比较没有显著差异(P>0.05);F 组自第2 天开始出现显著降低,但在第4 天至第10 天之间比较未见显著性差异(P>0.05);G 组第3 天开始出现显著降低,且第4 天至第10天之间比较仍具有显著差异(P<0.05)。
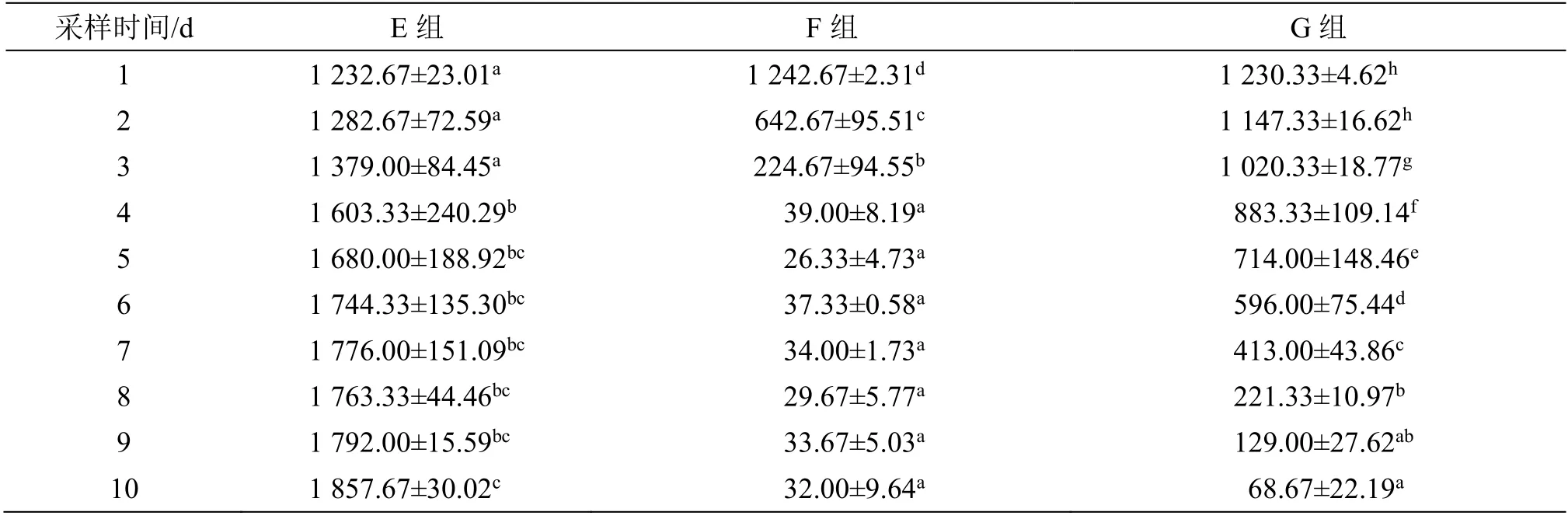
表4 给药后血清AST 活性变化Table 4 Changes in serum AST activity after administration (U·L-1)
2.2.2 临床症状分析 由图4 可见,治疗第5 天,E 组症状明显并出现2 只死亡,F 组和G 组症状明显但未出现死亡。
由图5 可见,治疗第10 天,E 组症状加重,死亡4 只,F 组未出现不良症状,G 组症状有所缓解,且无死亡病例。
2.2.3 病理切片分析 由图6 可见,E 组第5 天肝细胞坏死,胞核溶解,细胞萎缩,伴有出血,第10天肝细胞大量坏死,可见大量红细胞,静脉壁损伤严重,组织炎症反应剧烈;F 组第5 天有细胞肿胀,肝窦轻度淤血,管壁层次清晰,平滑肌纤维排列稍微疏,第10 天可见肝细胞数量增多,排列散乱,细胞核清晰,血管周围轻度炎性细胞浸润。G 组第5天可见细胞大量肿胀,胞质内充满脂肪空泡,局部静脉壁损伤,第10 天可见肝细胞数量稀少,排列散乱无规则,管壁层次不清,血管周围可见少量中心粒细胞、淋巴细胞等炎性细胞浸润。
3 讨论与结论
CCl4是一种亲肝性物质,主要是自由基的形成及引发的链式过氧化反应,从而造成肝脏损伤[12]。急性肝损伤引起的肝脏病变,可以从临床症状和各种生化指标来判定肝损伤情况,临床症状一般表现为呕吐、腹泻、厌食及精神萎靡不振等[13-14]。黄建伟等[15]用1 mL·kg-1剂量腹腔注射CCl4,发现CCl4可以诱导急性犬肝功能衰竭。本试验使用不同的剂量的50 % CCl4花生油溶液,进行犬腹腔注射给药,连续7 d 监测临床症状,从临床症状来看,C 组造模效果稳定,与黄建伟等[15]研究结果一致。B 组病发数量少且症状轻微,可能是50 % CCl4油溶液浓度太低,对肝脏造成的损伤程度低于肝脏自我修复能力;D 组症状越来越严重,后续出现犬只死亡,可能是50 % CCl4油溶液浓度过高。
由于肝脏是负责机体解毒的重要器官,还能合成糖原和多种酶,其中包括ALT 和AST 的合成,这两种酶能直接反应肝细胞损伤情况[16]。有研究表明肝细胞受到损伤后会使细胞膜结构改变,影响膜的通透性,引起胞内ALT、AST 溢出到肝血窦,流入周围血液,导致血清中的ALT、AST 活性增加[17]。本研究检测ALT、AST 活性结果显示,A 组无明显变化,B、C、D 组均有明显变化,结合前人研究结果可以看出本试验组肝脏已经不同程度受损。C 组ALT 和AST 活性出现变化早于B 组,且后面几天变化相对D 组更加平稳,根据血液中ALT、AST活性可以反映出肝脏的健康状况,说明B 组致病速度太慢,D 组致病强度过大,C 组适中,此结果与张东梅等[18]研究结果一致。
肝脏是具有自我修复能力的器官,当发生坏死的肝细胞数超过再生能力时,就会出现肝损伤,造成肝细胞膜结构与功能破坏[19]。组织病理切片结果显示A 组没有明显变化,B、C、D 组的严重程度对比为:B<C<D,符合陈雪龙等[20]研究显示的动物造模后肝脏组织学发现肝细胞坏死。
干细胞可以在不同阶段发育成胚胎干细胞和成体肝细胞[21]。间质干细胞是成体干细胞重要成员,分布广泛。近年来关于干细胞治疗疾病已成为热点,将ADMSCs、骨髓间充质干细胞及脐带间充质干细胞进行比较,ADMSCs 的扩增能力更强。Wan 等[22]研究的ADMSCs 可以显著地抑制T 淋巴细胞增殖及减轻大鼠的急性排斥反应。有研究表明,MSCs经尾静脉移植入被CCl4损伤的小鼠体内,对肝脏治疗更有针对性[23-24]。本试验将用1 mL·kg-150 %CCl4花生油溶液成功造模后的15 只犬分成3 组治疗,连续10 d 监测临床症状和生化指标及第5 天和第10 天的肝脏组织病理学。结果显示,E 组损伤情况未改善,F 组各项指标有明显改善,G 组各项指标改善程度相对F 组较弱。参考张德国等[25]和张东亚等[26]研究,也证明ADMSCs 能够抑制D-氨基半乳糖所致肝衰竭大鼠炎性反应,减轻肝组织炎性损伤,促进肝功能的恢复。
综上所述,1 mL·kg-150 % CCl4花生油可建立安全稳定的犬急性肝损伤模型,静脉途径移植的犬ADMSCs 对CCl4所致犬急性肝损伤的治疗效果比普通对症治疗效果更佳。
