烟草黑胫病菌RPA 检测方法的建立
2022-10-25杨懿德范志朋许大凤李林秋羊国根周本国潘月敏
杨懿德,范志朋,周 婷,许大凤 ,李林秋,鄢 敏,杨 洋,羊国根,周本国*,潘月敏*
(1. 四川省烟草公司宜宾市公司,宜宾 644600;2. 安徽农业大学植物保护学院,植物病虫害生物学与绿色防控安徽普通高校重点实验室,合肥 230036;3. 安徽省农业科学院烟草研究所,合肥 230031)
烟草黑胫病是烟草生产上最具毁灭性的土传病害之一,该病主要危害烟草的根和茎基部,也可危害叶片。目前,该病广泛分布于世界各地,我国各烟区除黑龙江以外均有发生,发生较重的有云南、贵州、四川等省份,给我国烟草产业造成重大经济损失,年均损失超过1.23 亿元[1]。烟草黑胫病是由卵菌门疫霉属烟草疫霉(Phytophthora nicotianae)所引起的,目前已鉴定到烟草黑胫病菌生理小种4个,分别是0 号、1 号、2 号和3 号[2]。我国烟草黑胫病菌主要是0 号和1 号生理小种,其中0 号小种为优势小种,危害最为严重[3-5]。近些年来,烟叶种植面积不断减少,并且集中在西南山区省份,导致烟叶连作频繁和种植品种集中,烟草黑胫病发病率呈现上升趋势[6]。化学防治是控制烟草黑胫病的主要手段,长期施用化学药剂易诱导病菌产生抗药性,引起农药残留量超标;绿色防控技术的推广应用,有利于烟叶安全生产,保障生态安全[7-8]。
烟草黑胫病的早期快速诊断,可为烟草黑胫病防控精准施药提供重要依据,是绿色防控技术推广应用的重要基础。烟草黑胫病菌的传统检测方法主要依据病原菌形态及生理生化特征,随着分子生物学技术的发展,基于核酸检测的聚合酶链式反应(PCR)被广泛采纳[9]。传统检测方法和常规PCR检测手段,均对操作人员的专业素养要求较高且需要专业仪器,无法在田间完成烟草黑胫病菌的快速检测。因此,为满足在不同环境条件下的扩增要求,自1990 年代初以来,已开发出一系列核酸等温扩增方法,如滚环扩增技术(rolling circle amplification,RCA)、环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)、依赖核酸序列的扩增(nucleic acid sequence-based amplification,NASBA)、链置换扩增技术(strand displacement amplification,SDA)、依赖解旋酶扩增技术(helicase-dependent amplification,HDA)和重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)等[10]。重组酶聚合酶扩增技术因其具有简单、高灵敏度、高特异性、成本低及不受检测场地限制等优点,已广泛应用于各类植物病原物的快速检测[11-12]。在ATP 参与下,重组酶与引物结合成复合体,在DNA 双链中寻找同源序列,引发单链置换反应,启动DNA 合成,对模板上的目标区域进行指数式扩增。防止置换的单链被进一步替换,解开的DNA 链会与单链DNA 结合蛋白(SSB)结合[11-12]。RPA 不需要热变性即可完成扩增反应,反应温度23~45 ℃均可,反应时间仅需10 ~ 20 min,便能检出扩增产物[13-14]。
目前,RPA 检测技术已应用于如辣椒疫霉、马铃薯晚疫病菌、青枯病菌、水稻黑条矮缩病毒和小麦全蚀病菌等植物病原物的快速检测[15-18],而关于烟草黑胫病菌的RPA 检测方法还鲜见报道。本研究以烟草黑胫病菌YPT1序列为靶标基因设计RPA 扩增 引 物YPT1F 和YPT1R , 以 及 探 针 引 物YPT1-LFD-probe,结合侧流层析试纸条检测技术,建立烟草黑胫病菌RPA 快速检测方法。
1 材料与方法
1.1 供试菌株
供试菌株:烟草黑胫病菌(Phytophthora nicotianae)、烟草赤星病菌(Alternaria alternate)、烟草青枯病菌(Ralstonia solanacearum)、烟草根黑腐病菌(Thielaviopsis basicola)、玉米纹枯病菌(Rhizoctonia solani)、假禾谷镰孢菌(Fusarium pseudograminearum)层出镰孢菌(Fusarium proliferatum)和大豆疫霉(Phytophthora sojae)等均由安徽农业大学真菌学及植物真菌病害实验室分离和保存。
试剂:RPA 检测试剂盒TwistAmp nfo,英国TwistDx 公司;侧向流动试纸条HybriDetect,德国Milenia Biotec 公司;2× SanTaqPCR Mix,生工生物工程(上海)股份有限公司;DL2000 DNA Marker,宝生物工程(大连)有限公司;其他试剂均为国产分析纯。
1.2 基因组DNA 提取
采用CTAB 法,提取供试病原菌物的基因组DNA[19];按照生工生物工程(上海)股份有限公司细菌基因组DNA 快速抽提试剂盒操作指南,提取烟草青枯病菌基因组DNA。利用超微量分光光度计NanoDrop 1000(Thermo Scientific)测定DNA 浓度,分别将DNA稀释至100 ng·μL-1,于-20°C保存备用。
1.3 烟草黑胫病菌RPA 引物和探针的设计
根据烟草黑胫病病菌的YPT1(accession number:KJ567642.1)基因序列,利用Primer Premier 5.0 软件设计引物YPT1F 和YPT1R,其中下游引物YPT1R的5'端用生物素(Biotin)标记。以扩增片段内与YPT1R 同源性最低区域为模板,设计长度为50 nt的探针YPT1-LFD-probe,5'端用FAM 标记,3'端用C3-Spacer 修饰,探针32 nt 处的“T”替换为四氢呋喃(THF)(表1)。
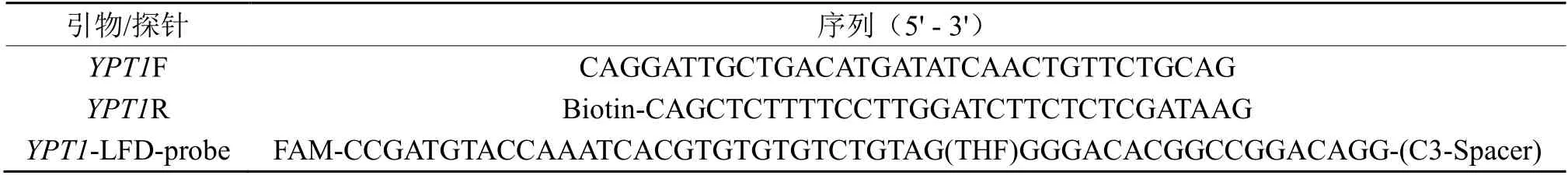
表1 RPA 扩增引物和探针Table 1 The primers and probe used for RPA
1.4 RPA 反应条件及扩增产物可视化检测
按照RPA 检测试剂盒TwistAmp nfo 操作指南,RPA 反应体系如下:Primer Free Rehydration buffer 29.5 μL、上下游引物(10 μmol·L-1)各2.1 μL、探针引物(10 μmol·L-1)0.6 μL 和模板DNA(100 ng·μL-1)2 μL,补水至47.5 μL,充分振荡混匀。然后加入2.5 μL 醋酸镁(280 mmol·L-1),充分混匀后于38 ℃水浴锅中反应20 min。
RPA 扩增产物采用侧向流动试纸条(lateral flow dipstick,LFD)检测。RPA 扩增产物用含0.05%(V/V)Tween 20 的PBS(PBST)缓冲液稀释50倍后,用微量移液器取10 μL 稀释液滴加到侧向流动试纸条上样区,然后将侧向流动试纸条于PBST缓冲液中静置3 ~ 5 min,观察试纸条检测带显色情况。
1.5 常规PCR 扩增
PCR 扩增体系:2× SanTaqPCR Mix 25 μL、上下游引物(10 μmol·L-1)各2 μL、模板(100 ng·μL-1)2 μL,加ddH2O 至50 μL。PCR 扩增程序:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,34 个循环;72℃再延伸5 min。PCR 扩增产物用1.5%琼脂糖凝胶电泳检测,以DL2000 DNA Marker 为参照。
1.6 烟草黑胫病菌RPA 检测的特异性测定
以烟草黑胫病菌、烟草赤星病菌、烟草青枯病菌、烟草根黑腐病菌、玉米纹枯病菌、假禾谷镰孢菌层出镰孢菌、大豆疫霉等供试病原菌的基因组DNA 为模板,利用烟草黑胫病菌YPT1的RPA 引物和探针进行RPA 检测。同时,利用常规PCR 扩增验证引物YPT1F 和YPT1R 的特异性。以ddH2O 为阴性对照,试验重复3 次以上。
1.7 烟草黑胫病菌RPA 检测的灵敏度测定
以不同浓度的烟草黑胫病菌基因组DNA 溶液(10 ng·μL-1、1 ng·μL-1、100 pg·μL-1、10 pg·μL-1L、1 pg·μL-1、100 fg·μL-1和10 fg·μL-1)为模板,分别进行RPA 检测和常规PCR 扩增,测定RPA 检测与常规PCR 扩增的灵敏度。以ddH2O 为阴性对照,试验重复3 次以上。
2 结果与分析
2.1 烟草黑胫病RPA 可视化检测
以烟草黑胫病菌DNA(100 ng·μL-1)为模板进行RPA 扩增,其侧向流动试纸条的质控线和检测线均出现条带(阳性反应),而阴性对照ddH2O 仅质控线显现条带(阴性反应)(图1),表明所设计的引物和探针可用于烟草黑胫病菌的RPA 检测。
2.2 烟草黑胫病菌RPA 引物和探针特异性检测
以烟草黑胫病菌DNA 进行RPA 扩增,侧向流动试纸条质控线和检测线均有条带,而以其他病原菌DNA 为模板的RPA 扩增只有质控带(图2)。常规PCR 扩增与RPA 检测结果一致,仅以烟草黑胫病菌的DNA 为模板PCR 扩增出大小为347 bp 目的条带(图3),表明所设计的引物YPT1F 和YPT1R可用于RPA 和PCR 特异性检测烟草黑胫病菌。
2.3 烟草黑胫病菌RPA 和PCR 检测的灵敏性
以不同浓度的烟草黑胫病菌DNA 进行RPA 扩增,随着模板DNA 浓度的降低,RPA 检测带的浓度逐渐下降。当DNA 浓度为100 ng·μL-1、10 ng·μL-1、1 ng·μL-1、100 pg·μL-1和10 pg·μL-1时,侧向流动试纸条均出现质控带和检测带;DNA 浓度低于10 pg·μL-1时,侧向流动试纸条仅出现质控带(图4)。同样,常规PCR 扩增产物琼脂糖凝胶电泳显示,DNA 浓度为100 ng·μL-1、10 ng·μL-1、1 ng·μL-1、100 pg·μL-1和10 pg·μL-1均能扩增出大小为347 bp 目的条带,而DNA 浓度低于10 pg·μL-1均无产物扩增(图5),表明RPA 检测的灵敏度与常规PCR 扩增相当,其检测下限均为10 pg·μL-1。
3 讨论
植物病原菌的监测与预警,是有效控制植物病害、保障农业生产安全的基础。常规PCR 技术已广泛应用于病原菌的监测,由于实验条件的限制,无法在田间实现现场检测。随着等温扩增技术的发展,在一定条件下实现核酸扩增,已经成为田间检测的重要手段[20]。
目前,LAMP 作为最常见的等温扩增技术,已广泛应用于植物病原菌的检测。LAMP 技术具有廉价、操作简单等优点,但也存在特异性和敏感性易受温度波动影响、引物存在难以设计和易形成引物二聚体导致假阳性等方面的不足[21]。RPA 作为最近几年兴起的等温扩增技术,可以不受温度波动影响,扩增耗时少,在植物病原菌检测应用日益增多。LAMP 需要6 条引物才能完成扩增,RPA 只需2 条引物,其对靶标序列和引物要求也相对较低,需要60 ~ 65 °C 甚至更高的反应温度,才能完成DNA 扩增[22]。RPA 扩增产物长度应控制在500 bp 以内,尤其是扩增长度在100 ~ 250 bp之间,可显著提高RPA的扩增效率和灵敏度[23]。本研究设计的引物YPT1F和YPT1R,其扩增产物大小为347 bp,同样具有较高的特异性和灵敏度。
本研究建立的RPA 检测体系,与常规PCR 扩增结果一致,均能特异性检测烟草黑胫病菌。并明确了烟草黑胫病菌RPA 检测的灵敏度,其检测下限为10 pg·μL-1,显著高于其他疫霉属植物病原卵菌的RPA 检测技术[24]。另一方面,PCR 和LAMP 检测技术平均耗时2 h 和1 h,RPA 检测仅需30 min(其中RPA 扩增反应20 min,侧向流动试纸条显色3 ~ 5 min),检测时间大为缩短,其检测效率明显优于PCR 和LAMP 检测技术[18]。
综上所述,本研究建立的RPA 检测技术具有良好的特异性和灵敏度,且扩增条件要求不高,因此在烟草黑胫病菌的田间监测方面有较好的应用前景。
