抗乙型脑炎病毒NS1蛋白抗体的制备及其抗原定量ELISA检测方法的建立及验证
2022-10-25罗娜乔建郑嘉唯邹文琪姜志军张仲锴吴杰徐葛林
罗娜,乔建,郑嘉唯,邹文琪,姜志军,张仲锴,吴杰,徐葛林
武汉生物制品研究所有限责任公司轮状病毒疫苗室,湖北 武汉 430207
乙型脑炎病毒(Japanese encephalitis virus,JEV)属于黄病毒科黄病毒属,与之同属的还有森林脑炎病毒(tick-borne encephalitis virus,TBEV)、黄热病毒(yellow fever virus,YFV)、登革热病毒(Dengue virus,DENV)、寨卡病毒(Zika virus,ZIKV)等[1-2]。该病毒基因组全长约11 000 bp,有1个开放阅读框,自5'至3'端依次编码3个结构蛋白和7个非结构蛋白[3-4]。研究表明,黄病毒属结构蛋白的抗体会导致放大感染,进而产生抗体依赖性增强(antibodydependent enhancement,ADE)作用[5-7],而NS1作为非结构蛋白,因其高度保守,可避免ADE风险[8-9],在黄病毒属疫苗开发中受到普遍关注。另外,相较于在感染早期无法被检测到的黄病毒的E蛋白,NS1蛋白在感染早期阶段出现,比病毒其他蛋白出现的时间更早,因此,可作为早期感染诊断及抗原检测的标志物[10-11]。
在疫苗研发和生产中,抗原检测对于质量控制必不可少。目前,乙型脑炎疫苗的质控检定项目包括鉴别试验、病毒滴定、稳定性试验、无菌检查等。其中,利用中和试验进行的病毒鉴定、利用蚀斑法进行的病毒滴定及稳定性检测[12-14],实验周期长且步骤繁琐、对操作人员和环境要求高。因此,有必要探索和建立更加便捷、快速的病毒检测方法。
ELISA作为常用的免疫学方法,可检测抗原与抗体,操作省时便捷、灵敏度高、成本低,在抗原或抗体检测中应用广泛[15-18]。基于此,本研究利用原核表达体系制备JEV的NS1蛋白及其兔多克隆抗体和鼠单克隆抗体,建立JEV-NS1抗原定量双抗体夹心ELISA检测方法,并按照《中国药典》四部(2020版)通则9101药品质量标准分析方法验证指导原则要求[12],对该方法进行验证。
1 材料与方法
1.1 疫苗原液、病毒、细胞及载体 乙脑减毒活疫苗原液由武汉生物制品研究所有限责任公司(简称武生所)乙脑病毒疫苗室提供,柯萨奇病毒CV-A16、CV-A17和埃可病毒11型(Echo-11)由武生所病毒性疫苗研究一室保存,地鼠肾传代细胞(BHK-21)由武生所质量控制室提供;TBEV由长春生物制品研究所有限责任公司提供;YFV由北京生物制品研究所有限责任公司提供;骨髓瘤细胞SP2/0购自武汉赛奥斯生物科技有限公司;pET30a载体购自武汉友民生物有限公司;大肠埃希菌DH5α、Rosetta(DE3)感受态细胞购自生工生物工程(上海)股份有限公司。
1.2 实验动物 普通级日本大耳白兔(雄性,6周龄,体质量1.5~2.0 kg,动物使用许可证号为SCXK鄂2018-0099,质量合格证号为42000400011807)和SPF级BALB/c小鼠(雌性,3周龄,体质量18~20 g,动物使用许可证号为SCXK鄂2017-0013,质量合格证号为42000400011271)均由武生所实验动物中心提供。动物实验均以科研为目的对日本大耳白兔和BALB/c小鼠进行养殖和使用,且按照日本大耳白兔、BALB/c小鼠动物伦理相关规定进行[文件编号为E(SOP-08-07-0004)01]。
1.3 主要试剂及仪器 逆转录试剂盒HiScriptⅡ1st Strand cDNA Synthesis Kit、DNA连接酶、限制性核酸内切酶NdeⅠ与HindⅢ、DAB显色试剂盒均购自宝生物工程(大连)有限公司;IPTG、Protein A、Protein G亲和层析树脂和硝酸纤维素膜(NC膜)均购自南京金斯瑞生物科技有限公司;HAT、PEG/DMSO(Mw,1450)、羊抗兔HRP-IgG和羊抗小鼠HRP-IgG购自武汉博士德生物工程有限公司;兔抗6×His多克隆抗体购自生工生物工程(上海)股份有限公司;氏完全佐剂、福氏不完全佐剂和蔗糖均购自美国Sigma公司;RPMI1640培养基和Pierce BCA定量分析试剂盒购自美国Thermo公司;细胞培养液、蛋白洗脱液及ELISA相关试剂[碳酸盐缓冲液(CBS)、磷酸盐缓冲液(PBS)、封闭缓冲液(BSA)、磷酸盐吐温缓冲液(PBST)等]均由武生所轮状病毒疫苗室自行配制。
1.4 引物设计及合成 参考GenBank中登录的JEV SA14-14-2株(MH258849)NS1基因序列设计引物,上游引物F序列:5'-TATCATATGATGGACACTGGATGTGCC-3'(下划线部分为NdeⅠ酶切位点),下游引物R序列:5'-TATAAGCTTTCTCTTCTTGTTTGG-3'(下划线部分为HindⅢ酶切位点),扩增片段大小为1 173 bp。引物由生工生物工程(上海)股份有限公司合成。
1.5 重组原核表达质粒的构建 取乙脑减毒活疫苗原液(7.1 LgPFU/mL),按照0.001 MOI接种至已长满BHK-21细胞的T75细胞培养瓶中,37℃,5%CO2条件下培养48~72 h,当细胞病变程度至90%时收获病毒液。使用逆转录试剂盒提取病毒收获液的RNA,逆转录为cDNA,以其为模板,用NS1基因特异性引物进行PCR扩增,反应程序:98℃预变性5 min;98℃变性10 s,60℃退火15 s,68℃延伸60 s,共30个循环;68℃延伸10 min。回收PCR产物,用NdeⅠ和HindⅢ双酶切后,与经同样酶双酶切的pET30a载体在DNA连接酶的作用下连接,构建重组原核表达质粒pET30a-JEV-NS1。将重组质粒转化至大肠埃希菌感受态细胞DH5α,涂布含0.1%卡那霉素的LB固体培养基上,过夜培养。挑取单菌落并培养,提取质粒,进行双酶切(NdeⅠ/HindⅢ)鉴定,阳性质粒送生工生物工程(上海)股份有限公司测序。
1.6 JEV-NS1重组蛋白的诱导表达及表达条件的优化 将测序正确的重组原核表达质粒pET30a-JEVNS1转化至大肠埃希菌感受态细胞Rosetta(DE3)中,菌液涂布于含0.1%卡那霉素的LB固体培养基培养过夜,挑取单菌落摇菌培养过夜,于-20℃保存菌种。将菌液按照1∶1 000接种2管含5 mL液体LB培养基(含0.1%卡那霉素)的摇菌管中,于37℃,160 r/min的恒温摇床上振荡培养至所有菌液A450值达0.6~0.8(约3 h),从2管中各取1 mL作为诱导前对照,向每管中其余4 mL菌液中加入IPTG至其终浓度为0.5 mmol/L,分别将2管置于37℃培养4 h和15℃培养16 h。收集诱导前后菌体,分离上清与沉淀,12% SDS-PAGE(考马斯亮蓝染色)及Western blot分析重组蛋白表达情况,确定最佳诱导条件。
1.7 JEV-NS1重组蛋白的制备及纯化 在最佳诱导条件下大量诱导阳性菌体,共500 mL。诱导结束后4℃,10 000×g离心2 min,收集菌体沉淀,PBS重悬后,用超声波细胞破碎仪进行超声裂解和洗涤。除去细胞碎片,将裂解液经4℃,12 000×g离心15 min分离上清和沉淀。选用制备型蛋白电泳装置来制备与分离目的蛋白,并以电洗脱、透析方式进行回收纯化。具体步骤为:配制200 mL分离胶(12%)和100 mL浓缩胶(5%),并对蛋白电泳装置作灌胶处理,在二者之间用异丙醇固定;待装置灌满胶后插入样品梳,至胶凝固后拔出;估算菌体沉淀的体积,按照1∶15加入PBS,重悬至无菌块;单次取7.5 mL重悬液,混以2.5 mL 4×SDS Loading Buffer,在100℃下煮样10 min,冷却后将其加入凝胶孔内,140 mA电泳5 h;电泳结束后用考马斯亮蓝对含有目的条带的凝胶进行染色,经脱色、切割,再将特定位置处(44 KD)含目的条带的凝胶用5 mL注射器碾碎;用电洗脱仪对凝胶进行电洗脱,设置电流为恒流90 mA,洗脱3 h,使目的蛋白从凝胶转移至蛋白洗脱液中;收集洗脱液,用PBS透析48 h,每6 h换液1次。对透析后的蛋白洗脱液用BCA(二辛可宁酸法)蛋白定量分析试剂盒测定浓度,Quantity One软件分析纯度,并进行Western blot鉴定。
1.8 JEV-NS1重组蛋白的Western blot鉴定 蛋白经SDS-PAGE分离后,电转移至NC膜上,以1%BSA室温封闭1 h;弃去封闭液,加入兔抗6×His抗体(用1% BSA 1∶5 000稀释),室温孵育2 h;PBST洗涤5次,每次5 min,加入用1% BSA配制成工作浓度的羊抗兔HRP-IgG,室温孵育1 h;PBST洗涤6次,每次5 min,加入DAB显色液显色,结束后将NC膜放入注射用水中终止反应,拍照保存。
1.9 兔多抗的制备 将纯化后的重组JEV-NS1蛋白与等体积福氏佐剂(初次免疫用福氏完全佐剂,余下免疫用福氏不完全佐剂)混合乳化,制备免疫原。经背部皮下多点免疫家兔,200 μg/(次·只),免疫时间为第0、14、28、42、56天。于末次免疫10 d后经颈动脉采血,分离血清。
1.10 鼠单抗的制备 用纯化后的重组JEV-NS1蛋白免疫BALB/c小鼠,经腹腔加背部多点免疫,60 μg/剂。第1剂辅以等体积福氏完全佐剂,余下针次辅以等体积福氏不完全佐剂,共免疫6剂,每剂间隔14 d。免疫完成后选择血清效价达1∶106的小鼠进行冲击免疫,3 d后取小鼠脾细胞与SP2/0细胞进行融合,采用HAT培养基进行筛选。ELISA法进一步筛选能够稳定分泌单抗的杂交瘤细胞,以1∶1 000小鼠免前血清作为阴性对照。将融合成功的杂交瘤细胞以诱生腹水法接种小鼠,制取单抗腹水。
1.11 抗体纯化及鉴定 用Protein G琼脂糖纯化树脂纯化兔血清IgG,Protein A琼脂糖纯化树脂纯化小鼠腹水,分别得到兔多抗和鼠单抗,ELISA法检测抗体效价,Western blot法鉴定抗体的特异性(分别以1∶2 500稀释的兔多抗、1∶5 000稀释的鼠单抗作为一抗)。ELISA法步骤:用CBS稀释JEV-NS1蛋白至1 μg/mL,包被96孔酶标板,100 μL/孔,4℃过夜;PBST洗板3次,加入1%BSA封闭缓冲液,200 μL/孔,37℃孵育1 h;加入10%蔗糖溶液保护,200 μL/孔,37℃孵育20 min;用1% BSA 10倍系列稀释待测血清,加入96孔板,100 μL/孔,37℃孵育1 h;PBST洗板5次,加入用1%BSA稀释至1∶5 000的羊抗小鼠HRP-IgG(检测兔血清效价时用羊抗兔HRP-IgG),100 μL/孔,37℃孵育1 h;PBST洗板5次,先后加入底物A液与B液,各50 μL/孔,37℃避光显色20 min;加入2 mol/L浓硫酸终止反应,酶标仪读取波长450/630 nm处吸光度值。以1∶1 000鼠免前血清、1∶10 000兔免前血清分别为小鼠与家兔血清的阴性对照。
1.12 JEV抗体的标记及内部参考品的制备 采用过碘酸钠法对纯化后的两种抗体进行HRP标记,得到酶标兔多抗和酶标鼠单抗HRP-JEns1C1(将制备的鼠单抗命名为JEns1C1);以1.7项方法制备的重组蛋白JEV-NS1作为内部参考品,用PBS稀释至20 μg/mL,分装保存于-20℃。
1.13 JEV抗原定量检测方法的建立 分别以1、2、4 μg/mL(用1% BSA稀释)兔多抗作为捕获抗体,不同浓度的HRP-JEns1C1鼠单抗(用1% BSA分别稀释至1∶1 000、1∶2 000、1∶4 000)作为检测抗体;另用鼠单抗JEns1C1(1、2、4 μg/mL)作为捕获抗体,酶标兔多抗(1∶1 000、1∶2 000、1∶4 000)作为检测抗体,分别用ELISA法检测浓度相同的内部参考品。比较两种ELISA方法检测乙脑抗原的灵敏度,再通过方阵滴定法确定最佳包被抗体和酶标抗体的浓度,建立JEV抗原定量检测方法。
1.14 方法的验证
1.1 4.1 线性范围及灵敏度 将JEV内部参考品用1% BSA梯度稀释至如下浓度:16 000.0、8 000.0、4 000.0、2 000.0、1 000.0、500.0、250.0、125.0、62.5 ng/mL,用建立的方法进行检测,根据结果计算R2,绘制标准曲线,确定线性范围。重复检测5次。
1.1 4.2 准确度 取稀释浓度为高(2 000.0 ng/mL)、中(1 000.0 ng/mL)、低(500.0 ng/mL)的JEV内部参考品,用建立方法进行检测,各浓度参考品重复检测3次,每次设2个平行孔。根据乙型脑炎疫苗生产要求,各浓度样品回收率应在80%~120%。
1.1 4.3 精密度
1.1 4.3.1重复性 由同一操作员用所建立的方法对1.14.2项中高、中、低3种浓度的内部参考品进行3次检测,每次设2个复孔。根据乙脑疫苗生产要求,试验结果的变异系数(CV)应不高于15%。
1.1 4.3.2中间精密度 由不同操作员对1.14.2项中高、中、低3种浓度的内部参考品进行检测,各浓度样品重复检测8次。根据乙型脑炎疫苗生产要求,同一浓度样品检测结果的CV应不高于15%。
1.1 4.4 专属性 用建立的方法检测JEV-NS1参考品、TBEV、YFV、CV-A16、CV-A17、Echo11病毒液,各样品均用1% BSA稀释至1∶100(各病毒液浓度在0.3~1.5 μg/mL之间)。以阴性对照组的A450-A630差值的2倍作为临界(Cut-off)值。
1.1 4.5 耐用性 用密封于37℃,分别放置0、3、6 d的酶标板检测1.14.2项中高、中、低3种浓度的内部参考品,比较不同孵育天数检测结果的差异。根据乙型脑炎疫苗生产要求,同一浓度样品检测结果的CV应不高于15%。
2 结果
2.1 重组原核表达质粒的鉴定 重组原核表达质粒pET30a-JEV-NS1的双酶切(NdeⅠ/HindⅢ)产物经10%琼脂糖凝胶电泳分析,可见5 422和1 173 bp两条带,分别与载体pET30a和目的基因NS1大小一致,见图1。测序结果显示,该重组质粒JEV-NS1基因序列与SA14-14-2病毒株NS1基因序列一致,表明该重组原核表达质粒构建正确。
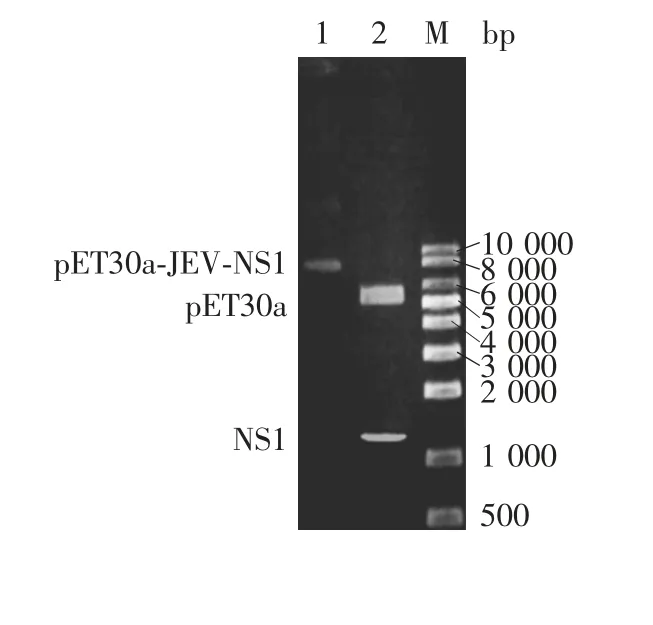
图1 PCR扩增目的片段及重组质粒的双酶切鉴定Fig.1 Electrophoretic profile of PCR products and restriction map of recombinant plasmid
2.2 表达产物的鉴定
2.2.1 SDS-PAGE分析 当诱导条件为37℃诱导4 h时,在沉淀中表达的重组蛋白量高于上清,同时也高于在15℃下诱导16 h的菌液上清及沉淀,表明该重组蛋白主要以包涵体形式表达,见图2。
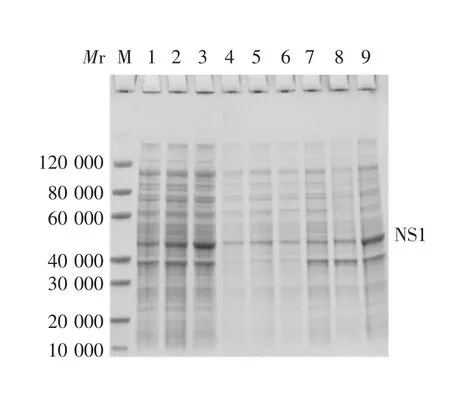
图2 表达产物的SDS-PAGE分析Fig.2 SDS-PAGE profile of expressed products
2.2.2 Western blot分析 除37℃诱导4 h的菌液上清外,在预期位置相对分子质量44 000处均出现特异性条带,见图3。
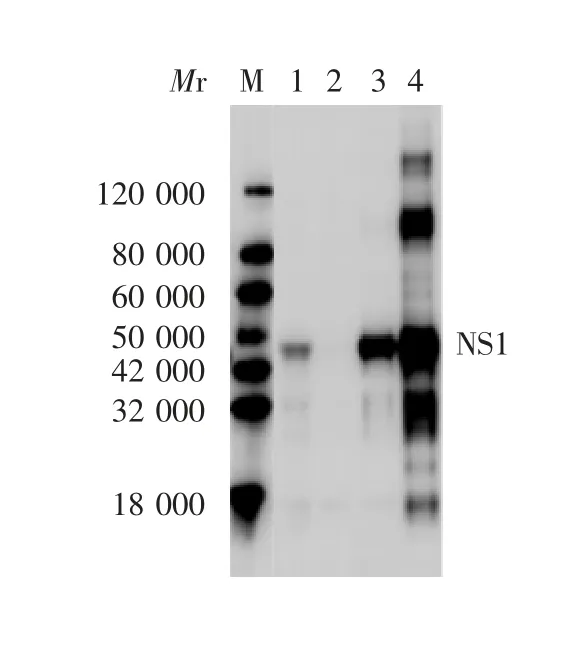
图3 表达产物的Western blot鉴定Fig.3 Western blotting of expressed products
综上,以37℃,4 h作为重组蛋白大量表达的诱导条件。
2.3 纯化产物的鉴定
2.3.1 SDS-PAGE分析 纯化的重组蛋白在相对分子质量44 000处可见特异性单一条带,见图4;用BCA蛋白定量分析试剂盒测得单次纯化后的蛋白液浓度为368 ng/μL;经Quantity One软件分析其纯度为94.8%。
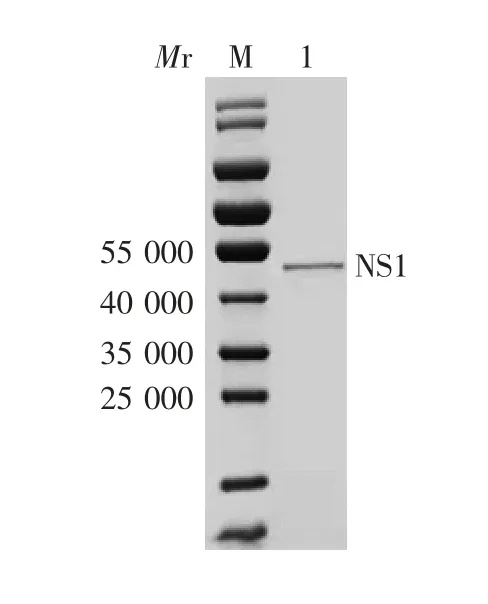
图4 纯化产物的SDS-PAGE分析Fig.4 SDS-PAGE profile of purified products
2.3.2 Western blot分析 纯化的重组蛋白可与兔抗6×His抗体特异性结合,在相对分子质量44 000处可见特异性条带,见图5。
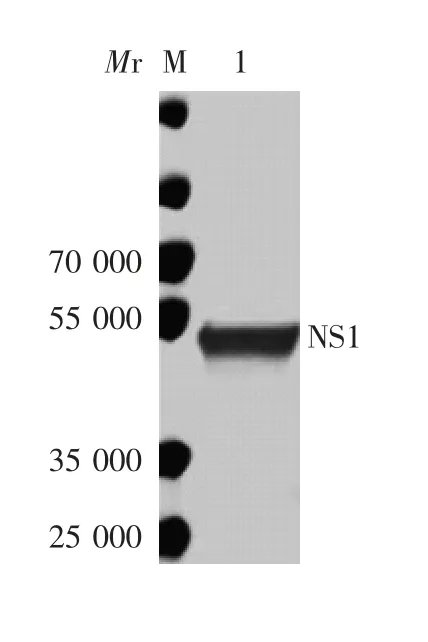
图5 纯化产物的Western blot鉴定Fig.5 Western blotting of purified products
2.4 兔多抗和鼠单抗的鉴定ELISA检测结果显示,纯化后的鼠单抗与兔多抗的效价分别为1∶108和1∶106。Western blot分析显示,分别以兔多抗和鼠单抗作为一抗,在相对分子质量44 000处均出现了单一的特异性条带(图略),表明两种抗体特异性良好。
2.5 JEV抗原定量检测方法的建立 以多抗作为捕获抗体、HRP-JEns1C1单抗作为酶标抗体,检测相同浓度样品得到的A450-A630值高于以JEns1C1单抗作为捕获抗体、多抗作为检测抗体的方式,表明前者灵敏度优于后者,因此选择前者进行方阵滴定,得到最佳捕获抗体浓度为1 μg/mL,酶标抗体稀释度为1∶2 000,此时A450-A630阳性/阴性值最高,为53.46,见表1和表2。建立的方法步骤如下:用1 μg/mL兔多抗包被96孔酶标板,100 μL/孔,4℃过夜;洗板3次后入加1% BSA,200 μL/孔,37℃下封闭1 h;用10%蔗糖溶液保护,200 μL/孔,作用20 min,于37℃干燥2 h;加入待测样品,100 μL/孔,37℃1 h;洗板5次,加入HRP-JEns1C1(1∶2 000稀释),100 μL/孔,37℃1 h;洗板5次,加入底物显色20 min;按50 μL/孔加入2 mol/L H2SO4终止反应。读取A450和A630值,以JEV-NS1内部参考品抗原含量与对应的A450-A630差值作线性拟合,得到内部参考品的线性公式。代入样品A450-A630差值计算待测样品抗原含量。
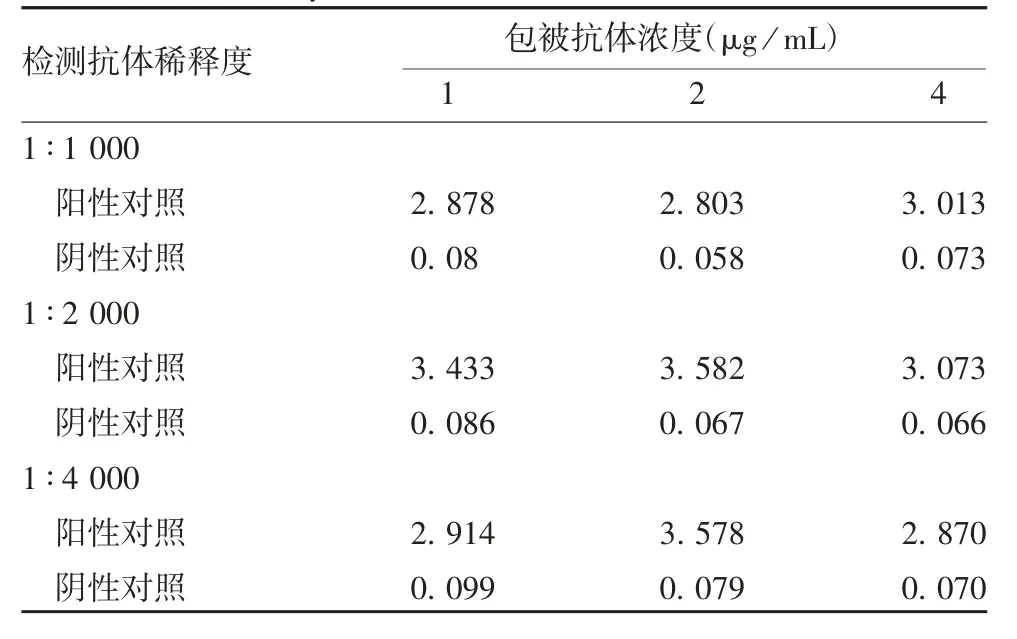
表1 多抗包被、单抗检测的ELISA方式Tab.1 ELISA developed by polyclonal antibody for coating and monoclonal antibody for detection
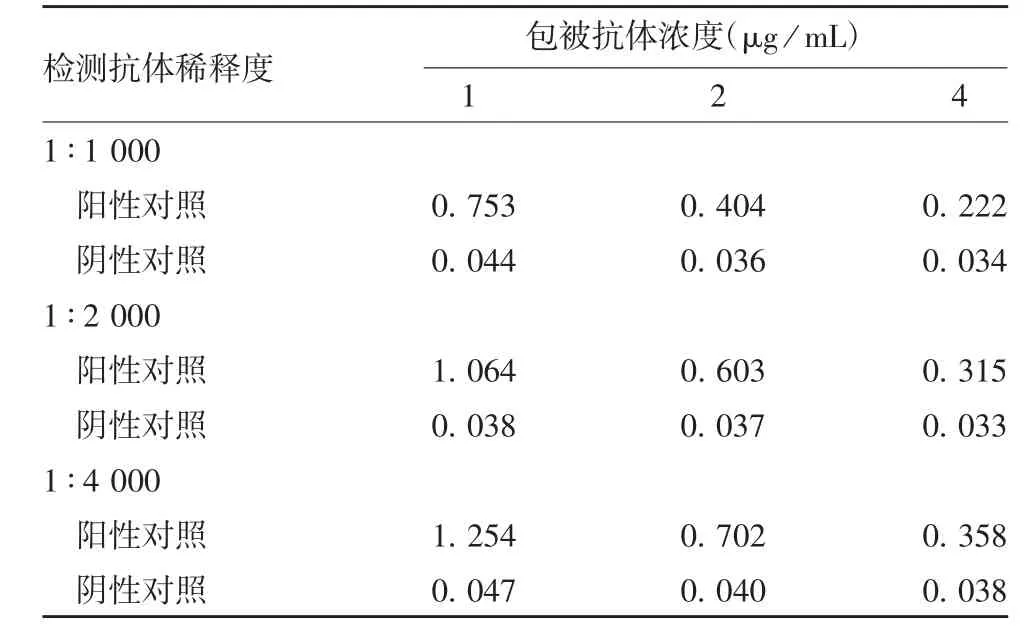
表2 单抗包被、多抗检测的ELISA方式Tab.2 ELISA developed by monoclonal antibody for coating and polyclonal antibody for detection
2.6 方法的验证
2.6.1 线性范围及灵敏度 重复检测5次得到的标准曲线方程分别为y=0.542 1x-1.156 0、y=0.559 7x-1.205 2、y=0.551 8x-1.169 1、y=0.538 5x-1.133 9、y=0.549 1x-1.157 7,R2分别为0.992、0.993、0.993、0.990、0.990。JEV内部参考品在250.0~4 000.0 ng/mL范围内,R2>0.90,符合规定。重复5次ELISA检测所得均值的线性拟合结果见图6。

图6 标准曲线线性范围及灵敏度验证Fig.6 Linear range of standard curve and validation for sensitivity
2.6.2 准确度 高、中、低浓度(2 000.0、1 000.0、500.0 ng/mL)的JEV内部参考品回收率分别为85.3%~103.4%、83.7%~100.3%、83.7%~92.1%,见表3,符合规定的80%~120%。

表3 准确度验证结果Tab.3 Validation for accuracy
2.6.3 精密度
2.6.3.1 重复性 高、中、低浓度的JEV内部参考品测定结果的CV值分别为5.8%、3.8%和2.9%,符合乙型脑炎疫苗检验规定中不超过15%的要求,见表4。
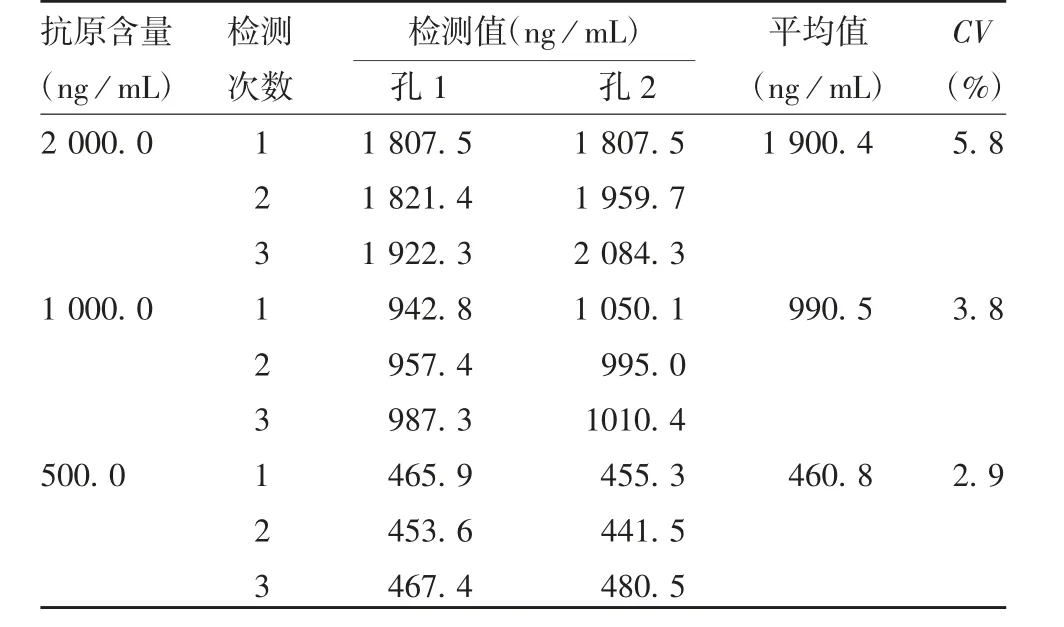
表4 重复性验证结果Tab.4 Validation for reproducibility
2.6.3.2 中间精密度 高、中、低浓度的JEV内部参考品测定结果的CV值分别为5.7%、5.8%和5.3%,符合乙型脑炎疫苗检验规定中不超过15%的要求,见表5。

表5 中间精密度验证结果Tab.5 Validation for intermediate precision
2.6.4 专属性 用建立的方法分别检测JEV-NS1参考品、TBEV、YFV、CV-A16、CV-A17、Echo11病毒液,结果该方法只识别JEV-NS1参考品,不识别其他病毒,见图7。表明该方法对于JEV检测专属性良好。

图7 专属性验证结果Fig.7 Validation for specificity
2.6.5 耐用性 用孵育时间不同的酶标板检测浓度相同的样品,测得CV值分别为3.7%、5.7%和5.3%,符合乙型脑炎疫苗生产规定中不超过15%的要求,见图8。
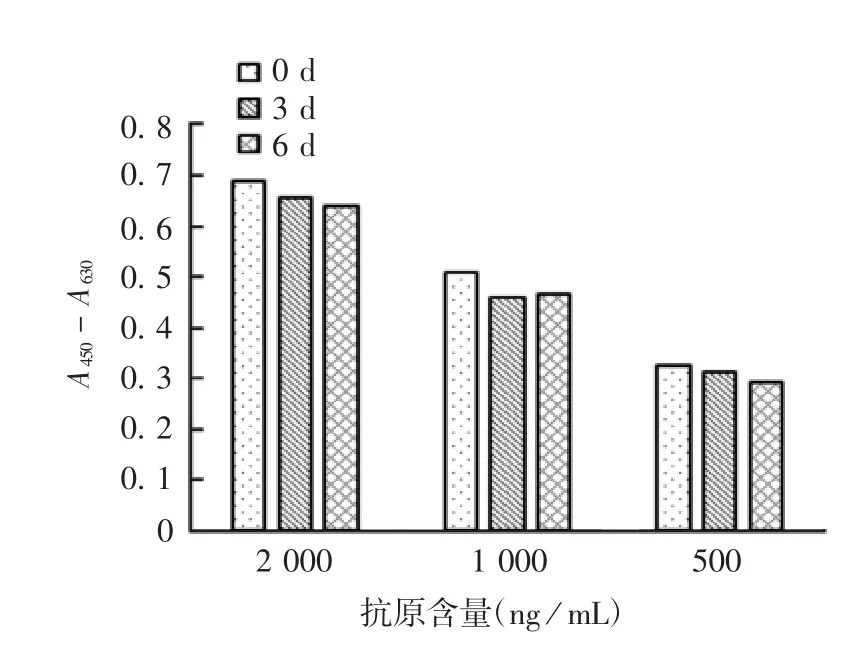
图8 耐用性验证结果Fig.8 Validation for durability
3 讨论
针对JEV诱发的乙型脑炎尚无特效的抗病毒药物,疫苗接种是其主要防控措施[19]。目前,全球有4种不同类型的乙型脑炎疫苗可供使用:鼠脑灭活疫苗、细胞来源的弱毒活苗、细胞来源的灭活疫苗、基因工程的弱毒嵌合活疫苗[20-23]。我国目前使用的两种乙型脑炎疫苗为SA14-14-2株减毒活疫苗和灭活的P3毒株疫苗,SA14-14-2株减毒活疫苗作为使用最广泛的抗JEV疫苗,在流行性乙型脑炎的防控中发挥了重要作用[24-25]。在疫苗的制备和生产中,抗原的检测始终占据重要一环。基于黄病毒属非结构蛋白NS1的高度保守性[26],本研究构建了JEV NS1原核重组质粒,利用表达的NS1蛋白免疫动物,制备了抗JEV NS1蛋白的单抗和多抗,对研究JEV NS1蛋白的功能具有一定的借鉴意义。且这两种抗体对黄病毒科黄病毒属的其他成员如YFV、TBEV无交叉反应,显示对JEV的检测具有特异性。另外,为提高方法的灵敏度,研究中分别采用兔多抗包被、酶标鼠单抗检测和用鼠单抗包被、酶标兔多抗检测两种不同的方式,检测浓度相同的内部参考品来比较二者的灵敏度,结果显示,前者灵敏度更优。再通过方阵滴定法确定了最佳包被抗体浓度为1 μg/mL、最佳检测抗体稀释度为1∶2 000,建立了双抗体夹心ELISA检测JEV抗原的方法。
用于JEV检测的ELISA方法目前多为间接法和双抗体夹心法。吴鹏等[27]利用重组JEV NS1蛋白检测猪乙型脑炎,建立了JEV NS1蛋白间接ELISA诊断方法,可应用于猪群临床血清样品检测。李海洋等[28]通过对猪JEV重组E基因的克隆表达,建立了JEV E蛋白间接ELISA检测方法,用于检测猪JEV感染情况。范煜[29]应用纯化的兔源JEV NS1蛋白多抗作为捕获抗体,HRP标记的NS1'单抗作为检测抗体,建立了JEV NS1'蛋白双抗体夹心ELISA方法,用于猪群JEV感染血清流行病学调查。商品化的ELISA检测试剂盒多面向于畜牧业和临床诊断,用于JEV感染情况的检测和乙型脑炎的诊断,无法很好地反映JEV的抗原情况。本研究针对乙型脑炎疫苗生产制备过程中的抗原含量检测,以制备的特异性抗JEV NS1单抗和多抗为基础而建立的双抗体夹心ELISA方法,可有效定量检测抗原、监测抗原制备回收率、评估纯化工艺合理性,对乙型脑炎疫苗的研发及生产具有一定的指导意义。且该方法灵敏度高、特异性强,与乙型脑炎疫苗传统质控方法如中和实验、蚀斑法相比,具有检测成本低、便捷易操作、省时的优势。经验证,该方法的专属性、准确度、精密度、线性、耐用性均较好。在抗原含量为250.0~4 000 ng/mL时,R2≥0.990,线性良好,检测范围符合乙型脑炎疫苗生产检定要求,可应用于乙型脑炎疫苗制备过程中不同阶段的抗原定量检测以及质量控制。此外,经验证,该方法专属性好,不识别其他黄病毒属成员如TBEV和YFV,进而可用于JEV与TBEV或YFV的鉴别诊断。
