强化瑞舒伐他汀治疗脑梗死伴CAA 患者的效果探讨
2022-10-25吴俊生
吴俊生
脑梗死也被叫做缺血性脑卒中,是临床上高发的一种脑血管疾病,也是老年群体中的常见病,本病是因为局部脑组织血液供应障碍,造成局部脑卒中发生缺血或缺氧性坏死等情况,以致神经功能损伤而引起的一系列症状表现。随着人口老龄化社会不断发展,脑梗死患病人数有不断增加趋势,主要特征为致残率、致死率高,病死率为10%~15%,患者会出现头痛、眩晕、步态异常等表现,损害身心健康,降低生活质量。现有研究证实[1],CAA 是诱发脑梗死的一种危险因素,抑制CAA 的发生、蔓延发展过程,有助于减少发生心脑血管事件的风险,进而改善预后。他汀类药物有稳定斑块、预防斑块掉落、抑制血管炎症反应等功效,进而防控缺血性脑卒中。本科室尝试采用强化瑞舒伐他汀治疗脑梗死伴CAA,取得的效果较理想,现选择52 例患者,通过分组对比分析不同药物方案的治疗效果。报告如下。
1 资料与方法
1.1 一般资料 选择2018 年7 月~2020 年3 月收治的52 例脑梗死伴CAA 患者,随机分为传统组与实验组,各26 例。传统组男15 例,女11 例;年龄44~78 岁,平均年龄(65.87±7.31)岁;体质量指数(BMI)23~28 kg/m2,平均BMI(25.57±0.86) kg/m2;梗死分布:基底节梗死10 例,小脑梗死6 例,腔隙性梗死5 例,枕叶梗死3 例,额叶梗死2 例。实验组男13 例,女13 例;年龄44~77岁,平均年龄(64.94±6.98) 岁;BMI 22~28 kg/m2,平 均BMI(25.79±1.27)kg/m2;梗死分布:基底节梗死8 例,小脑梗死7 例,腔隙性梗死5 例,枕叶梗死4 例,额叶梗死2 例。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。患者均符合临床诊断标准[2],经颅CT/磁共振成像(MRI)检查证实,颈动脉超声检查提示出现了不同程度的CAA。排除有缺血性脑卒中病史、2 周内接受抗凝或溶栓治疗、肝肾功能严重不全者或妊娠、哺乳期妇女。
1.2 方法 传统组接受常规治疗,实验组在传统组基础上辅助强化瑞舒伐他汀治疗。常规治疗包括抗凝、活血化瘀、降糖及降压治疗等。实验组加用瑞舒伐他汀,10 mg/次,1 次/d,睡前口服。两组患者均连续治疗3 个月。
1.3 观察指标 在治疗前后,利用彩超诊断仪(SEQUOI-A512)分别检测两组患者的IMT 与颈动脉斑块面积,探头型号15L-8,频率10~14 MHz。检测血清指标:抽取患者空腹状态下3 ml,分离血清,低温环境(-70℃)下保存,利用酶联免疫吸附测定(ELISA)法检测HMGB1、IL-17A、S100A12。
1.4 统计学方法 采用SPSS22.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者治疗前后的IMT、颈动脉斑块面积比较治疗前,两组IMT、颈动脉斑块面积比较,差异无统计学意义(P>0.05);治疗后,两组IMT、颈动脉斑块面积均小于治疗前,且实验组小于传统组,差异有统计学意义(P<0.05)。见表1。
表1 两组患者治疗前后的IMT、颈动脉斑块面积比较(±s)
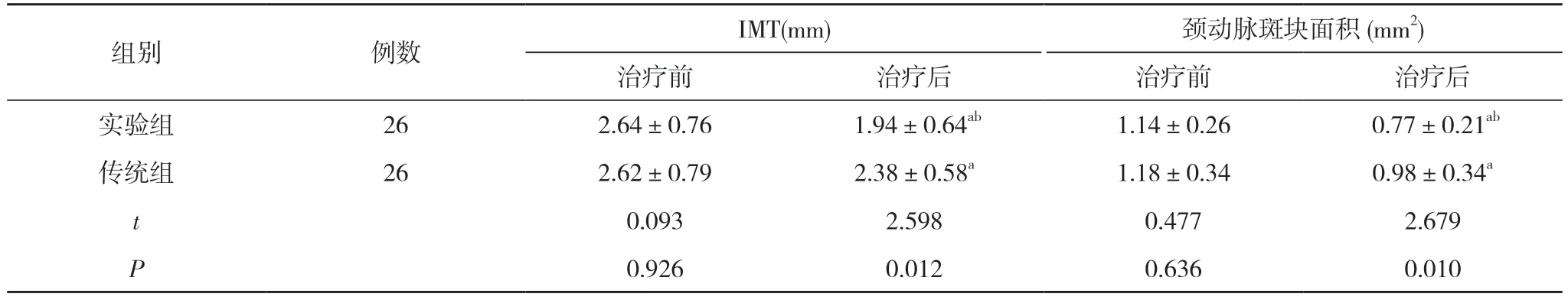
表1 两组患者治疗前后的IMT、颈动脉斑块面积比较(±s)
注:与本组治疗前比较,aP<0.05;与传统组治疗后比较,bP<0.05
2.2 两组患者治疗前后的血清指标比较 治疗前,两组HMGB1、IL-17A、S100A12 比较,差异无统计学意义(P>0.05);治疗后,两组HMGB1、IL-17A、S100A12 均低于治疗前,且实验组低于传统组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者治疗前后的血清指标比较(±s)

表2 两组患者治疗前后的血清指标比较(±s)
注:与本组治疗前比较,aP<0.05;与传统组治疗后比较,bP<0.05
3 讨论
脑梗死是临床上发病率较高的一种神经系统疾病,通常是以动脉粥样硬化为基础形成血栓,进而引起本病,病理过程表现出高度的复杂性,涉及到炎症反应、氧自由基及新生血管形成等诸多机制[3]。失语、偏瘫、面瘫、肢体运动功能降低等是患者常见症状表现,致残率、致死率分别为50%、10%,并且幸存者的复发率也高达40%,严重损害患者的社会功能,降低生命质量[4-6]。当下,越来越多的学者认为,在动脉粥样硬化及相关并发症发生、发展过程中,炎症反应起到了十分重要的作用。单核-巨噬细胞等炎症细胞能聚集在斑块周边,释放出大量的炎性因子,诱发炎症反应。动脉粥样硬化斑块形成、破裂是引起脑梗死的独立危险因素之一,脑组织缺血以后,出现的炎症级联放大反应是导致缺血以后神经细胞出现不同程度损伤的主因[3,7]。
颈动脉是脑梗死经常涉及的位置,且有广泛性、浅表性特征,容易被体表超声检出,IMT 增厚为反映早期动脉硬化发生情况的常用指标之一。抑制动脉粥样硬化形成并阻隔脑组织缺血以后炎症信号通道,始终是现代临床治疗缺血性脑卒中的重要环节之一。故而,临床针对脑梗死伴CAA 的患者要尽早干预,力争将脑血管事件的复发率降至最低,最大限度的改善预后[8-11]。针对CAA 引起脑梗死的机制可以做出如下表述[4]:①粥样硬化斑块持续增加,直接堵死血管通路;②斑块状态不稳发生破裂,掉落后的斑块在远侧血管上形成栓子,引起栓塞问题;③斑块表面粗糙,激发了血小板与凝血因子活性,诱导了血栓形成过程;④管径变窄的颈动脉造成远端血管的灌注压力降低,分水岭区血供量不够,这是形成边缘带或者低灌注性梗死的重要基础。
他汀类药物不仅有降低血脂的作用,还能抑制炎症反应,进而维持粥样斑块的相对稳定性及缩小其面积。并且既往已经有研究证实,他汀类药物能延迟CAA 的形成过程,弱化炎症与氧化应激反应,这是改善脑梗死患者预后的重要基础。瑞舒伐他汀类是第三代他汀类药物,和其他他汀类药物相比较,其调脂作用更强,肝脏代谢相对较少,不同药物之间相互作用更小,半衰期较长,在临床上可以加大其推广应用[12-14]。并且有研究证实[5],本药物能较好的保护血脑屏障的完整性,抑制发生功能障碍的过程,避免出现部分神经毒性物质和白细胞进入至脑实质的情况,不仅能改善患者的脑血流量,对脑功能恢复过程还起到一定的促进作用,降低血肿周围细胞的坏死数目,帮助脑梗死患者更快速的恢复前期损伤的感觉、运动功能。IMT 是当前临床上测评动脉粥样硬化疾病发展进程的常用指标之一,在脑卒中预测、诊断治疗及预后评估等诸多方面均表现出较高效能。既往有资料记载,由颈动脉IMT 厚度增加到CAA 发生发展过程中,最早累及的位置是动脉壁内膜。并且在临床检查中不难发现IMT 增厚引起管腔狭窄(>50%)的几率相对较低。超声检查能探测到的硬斑块,因为其结构自身稳定性较高,由此引起的脑卒中危险性偏小;而软斑块以及混合性斑块因为不够稳定而非常容易脱落进而引起脑卒中,临床采用动脉粥样硬化药物治疗干预后,斑块会由不稳定性转变成稳定性,降低继发脑血管疾病的发生率[15-17]。当下,国内外均有临床研究指出,动脉粥样硬化是颈动脉斑块形成的主要原因,通常会在颈动脉内形成硬化斑块,导致内膜厚度增加、管腔局部狭窄甚至是闭塞。临床上评价颈动脉狭窄危险程度并不单纯是测量斑块大小,主要是结合由斑块引起的颈动脉狭窄度与颈动脉血管的流速做出相应判断。颈内动脉、颈总动脉的直径大概分别是5~6 mm、6.0~7.5 mm[18]。针对发生狭窄度>50%的中重度颈动脉狭窄,引起脑梗死或者脑供血不足的风险会显著增加,面对这样的患者时可以考虑进行外科手术治疗。
本研究中,治疗后,两组IMT、颈动脉斑块面积均小于治疗前,且实验组IMT(1.94±0.64)mm、颈动脉斑块面积(0.77±0.21)mm2小于传统组的(2.38±0.58)mm、(0.98±0.34)mm2,差异有统计学意义(P<0.05)。提示和常规抗炎、抗血小板聚集方法相比较,瑞舒伐他汀治疗脑梗死患者,能更好的降低CAA 厚度,缩小颈动脉斑块面积,这是减轻脑梗死相关症状表现,提升临床治疗效果的重要基础。臧业峰等[6]选择90 例急性脑梗死患者为研究对象,将其分成对照组、治疗组,均为45 例,均给予常规西药治疗,治疗组联合瑞舒伐他汀治疗,治疗6、9、12 个月时,治疗组IMT 依次是(1.30±0.36)mm、(1.22±0.29)mm、(1.13±0.31)mm,对照组分别是(1.36±0.21)mm、(1.34±0.36)mm、(1.32±0.20)mm,臧业峰等认为,瑞舒伐他汀治疗脑梗死,能较明显的改善其动脉粥样硬化程度,本文与其研究结论具有一致性。
HMGB1 属于DNA 结合蛋白的范畴,在哺乳动物细胞内有广泛分布,是当下临床判断某些细胞凋亡或坏死的重要信号之一,在CAA 形成中扮演着炎症调节因子的重要角色,其主要是在细胞外发挥自身的作用,具体是激活各种炎症细胞,分泌、释放相应的细胞因子[7]。故而在脑梗死患者群体中,血清HMGB1 水平会明显上升,参与脑卒中后炎症反应的发生、发展过程,并使其严重化[19]。当机体细胞坏死或者受损时,细胞核内HMGB1 可以释放到细胞外,诱导巨噬细胞分泌促炎因子;而促炎因子也能反向作用促进HMGB1 的分泌过程,以上是正反馈环形成的基础。在炎症反应的后期,以上这种正反馈效应在维持炎症反应状态时表现出巨大作用。IL-17A 是近些年临床上发现的一种新细胞因子,其是前炎症因子,并对炎症反应过程起到一定的调节作用,结合部分受体后,会对血管内皮、平滑肌细胞等形成不同程度的刺激作用,生成和CAA 形成相关的前炎症细胞因子、粘附分子等,对动脉血管内皮造成不同程度的损害,诱导平滑肌细胞迁移,使更多的单核-巨噬细胞参与到CAA 的形成过程中[20]。现已经证实,白细胞介素-17(IL-17)是由CD4+T 细胞分泌而来的,其能够诱导上皮、内皮、成纤维细胞合成并分泌白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、粒细胞集落刺激因子(G-CSF)、前列腺素 E2(PGE2),促进细胞间粘附分子(ICAM-1)表达的提升。针对IL-17 在急性脑梗死疾病发生、发展中的确切机制,国内外临床至今没有做出统一结论,有学者在大量研究中指出星形胶质细胞为大脑生成IL-17 的重要来源细胞,在脑缺氧条件下星形胶质细胞高表达IL-17,IL-17 能够协同IL-6 诱导并激活星形胶质细胞中核因子-κB(NF-κB)、细胞外信号调节激酶(ERK)、丝裂原活化蛋白激酶(MAPK)、c-Jun 氨基末端蛋白激酶(JNK)与p38丝裂原活化蛋白激酶(p38 MAPK),IL-17 协同IL-6/R,能够诱导星形胶质细胞明显上调IL-6 的表达水平,且星形胶质细胞自身存在着IL-6 正反馈表达通路,这是IL-6 高表达的重要基础,IL 一6 因子的高表达会进一步加重缺血局部的炎症反应,以致大脑神经系统的损害更加严重。S100A12 为中性粒细胞对外表达的一种细胞因子,在CAA 巨噬及中性粒细胞中表达均上升,对巨噬、内皮细胞促炎症因子生成、粥样硬化斑块形成过程均能起到一定的促进作用。在本次研究中,治疗后,两组HMGB1、IL-17A、S100A12 均低于治疗前,且实验组低于传统组,差异有统计学意义(P<0.05),提示瑞舒伐他汀能更好的抑制脑梗死患者的炎症反应。
综上所述,脑梗死伴CAA 患者辅助强化瑞舒伐他汀治疗,能明显减小粥样硬化斑块面积,减轻血清炎症反应,进而提高疾病临床治疗效果,具有一定的推广价值。本次研究存在一定不足,如纳入样本量较少,没有观察远期疗效及药物不良反应等,均需要在后续研究中加强。
