盐析辅助液液萃取/超高效液相色谱-串联质谱法测定含乳饮料中12种邻苯二甲酸酯
2022-10-22王东旭王新财胡奇杰王凤丽
王东旭, 王新财, 胡奇杰, 王凤丽, 厉 芬
(湖州市食品药品检验研究院, 浙江 湖州 313000)
含乳饮料是指以乳或乳制品为原料, 加入水及适量辅料经配制或发酵而成的饮料制品[1]。研究表明, 含乳饮料是城市年轻人群仅次于矿泉水之外销量最高的饮品[2]。饮料包装较多使用聚丙烯(PP)、聚对苯二甲酸乙二醇酯(PET)、高密度聚乙烯(HDPE)等材质, 受环境等因素影响, 塑料中的单体可能从包装材料迁移到饮料中, 从而损害人体健康[3]。邻苯二甲酸酯(PAEs)是其中应用最为广泛的一类增塑剂, 每年全球产量接近600万吨, 其中中国消耗量接近220万吨[4-6]。毒理学研究表明, PAEs分子与雌激素部分结构具有相似性, 对内分泌系统、免疫系统和神经系统有干扰作用, 具有潜在的生物毒性、肾毒性和致畸性[7-9]。目前, 美国环保总局已将邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸丁基苄基酯(BBP)、邻苯二甲酸二(2-乙基)己酯(DEHP)和邻苯二甲酸二正辛酯(DNOP)列入“优先污染物名单”;欧盟将DBP、DEP列为第2类生殖毒性化合物[10]。我国食品安全标准也对食品、食品添加剂中的DEHP、邻苯二甲酸二异壬酯(DINP)和DBP的最大残留量做了限值规定[11]。
目前食品中PAEs的检测方法主要有气相色谱法[12]、气相色谱-质谱法[13-14]、液相色谱法[15-16]以及液相色谱-质谱法[17-18]等。由于食品基质较复杂, 其中PAEs的浓度往往较低, 因此选择合适的富集和纯化前处理技术必不可少[12]。常见的前处理技术主要有液液萃取法[19]、固相萃取法[20]、固相微萃取法[21]、分散液液微萃取法[22]、磁性固相萃取法[23]等。含乳饮料含有较高的脂肪和蛋白质, 前处理的关键在于去除脂肪和蛋白质, 目前采用的前处理方法以固相萃取法[24]为主, 但该法检验成本高, 操作相对繁琐, 不适合高通量检测。盐析辅助液液萃取法(SALLE)通过向样品溶液与萃取溶剂混合物中加入适当的无机盐, 可促进萃取溶剂更好地从混合物中分离[25-26]。该方法具有操作简便、有机试剂消耗少、萃取效率高等优点。本研究以12种典型的PAEs为检测目标, 采用盐析辅助液液萃取法对含乳饮料中PAEs进行前处理, 结合超高效液相色谱-串联质谱法(UPLC-MS/MS), 建立了一种前处理快速简单、成本低的含乳饮料中12种PAEs的检测方法, 可为含乳饮料中PAEs的高通量检测提供技术参考。同时基于该方法考察了不同温度及光照条件下PET包装材质的含乳饮料中PAEs的迁移规律。
1 实验部分
1.1 仪器与材料
ACQUITYTM超高效液相色谱和XevoTMTQD三重四极杆串联质谱仪(美国沃特斯公司);ME204E型电子分析天平(瑞士梅特勒公司);Genius 3漩涡混合器(德国艾卡公司);Allegra X-12R型台式冷冻离心机(美国贝克曼公司);DHG型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);针式滤膜过滤器:0. 22μm聚醚砜滤膜(PES)、0. 22μm尼龙滤膜(Nylon)、0. 22μm玻璃纤维滤膜(MCE)、聚丙烯滤膜(PP)、0. 22μm聚四氟乙烯滤膜(PTFE)、0. 22μm聚偏氟乙烯滤膜(PVDF)(天津市津腾实验设备有限公司)。
标准品:DMP、DEP、邻苯二甲酸二(2-甲氧基)乙酯(DMEP)、邻苯二甲酸二(2-乙氧基)乙酯(DEEP)、邻苯二甲酸二异丁酯(DIBP)、DBP、邻苯二甲酸二戊酯(DPP)、BBP、邻苯二甲酸二环己酯(DCHP)、DEHP、DNOP、DINP, 质量浓度均为1 000μg/mL, 购自北京坛墨质检科技有限公司。
乙腈(ACN)、甲醇(MeOH)、丙酮、四氢呋喃、乙醇(色谱纯, 德国默克公司);甲酸、氯化钠(NaCl)、碳酸钠(Na2CO3)、硫酸钠(Na2SO4)、硫酸铵((NH4)2SO4)、硫酸镁(MgSO4)(分析纯, 上海麦克林生化科技有限公司);实验用水为屈臣氏蒸馏水, 10批次含乳饮料购于湖州市超市。
1.2 溶液制备
1.2.1 混合对照品溶液的制备准确吸取各PAEs标准溶液适量, 用乙腈稀释, 配制质量浓度为1 mg/L的PAEs混合标准储备液, -20℃下避光保存。吸取PAEs混合标准储备液适量, 经空白基质溶液稀释, 配制质量浓度分别为0、5. 00、10. 0、50. 0、100、200μg/L的混合标准工作溶液。取1. 00 mL混合标准溶液过0. 22μm聚四氟乙烯滤膜后供仪器分析。
1.2.2 供试品溶液的制备准确称取5. 00 g含乳饮料(精确至0. 01 g)置于15 mL离心管中, 依次加入2. 0 g硫酸铵和1. 5 mL乙腈, 涡旋至硫酸铵固体完全溶解(约1 min), 以10 000 r/min离心5 min。移取0. 75 mL上层有机层置于1. 00 mL容量瓶中, 加水定容至刻度, 混匀, 过0. 22μm聚四氟乙烯滤膜后供仪器分析。空白实验未加入样品, 其他步骤相同。
1.3 测定方法
精密吸取上述混合标准工作溶液各5μL进行超高效液相色谱-串联质谱检测, 以进样质量浓度(X, μg/L)为横坐标, 定量离子对峰面积(Y)为纵坐标, 绘制12种PAEs基质标准溶液的标准曲线。供试品溶液在相同条件下测定, 采用基质标准曲线外标法定量。
1.4 色谱及质谱条件
色谱柱:Waters ACQUITY UPLC BEH phenyl(50 mm×2. 1 mm, 1. 7μm);流动相:A为甲醇, B为0. 05%甲酸水溶液;流速为0. 3 mL/min;进样体积为5μL;柱温为35℃。梯度洗脱程序:0. 0~1. 0 min, 50%~60% A;1. 0~2. 5 min, 60%~70% A;2. 5~4. 0 min, 70% A;4. 0~4. 5 min, 70%~80% A;4. 5~6. 0 min, 80%A;6. 0~7. 0 min, 80%~90%A;7. 0~12. 0 min, 90%A;12. 0~12. 1 min, 90%~50%A;12. 1~18 min, 50%A。为抑制仪器管路中的塑化剂本底干扰[27], 在混合池与六通阀之间加装Agilent Zorbax SB-C18反相色谱柱(4. 6 mm×150 mm, 5μm)。
质谱条件:电喷雾电离(ESI)源, 正离子模式扫描, 多反应监测(MRM)模式检测;毛细管电压为0. 5 kV;离子源温度为150℃;脱溶剂气温度为350℃;脱溶剂气流速为800 L/h;锥孔气流速为50 L/h;碰撞气为氩气;PAEs的质谱参数见表1。
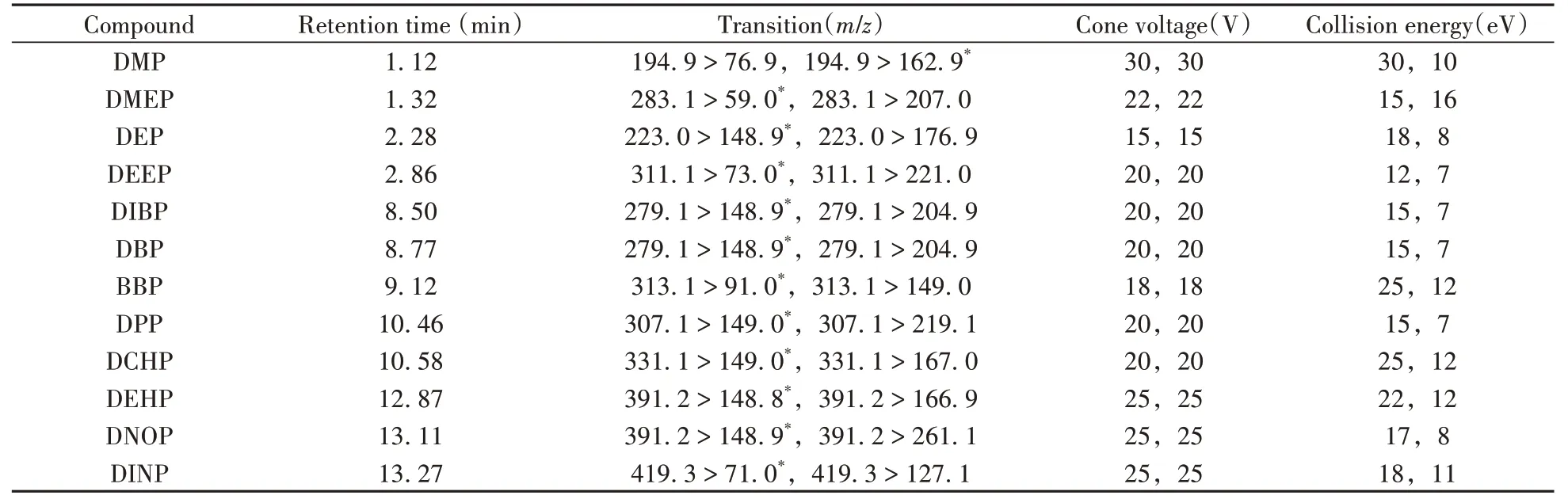
表1 待测物的监测离子对及最佳质谱参数Table 1 Selected transitions and optimized mass spectrum parameters of the target compounds
1.5 基质效应
采用相对响应值法考察基质效应(ME)的影响, 计算公式为:ME=k2/k1×100%。式中:k1为空白溶液标准曲线斜率;k2为基质标准曲线斜率。
李峤汝越想越觉得母亲确实有精神问题。母亲不太说话,要按城里人的标准,就是自闭。自闭的人总在心里琢磨事,这还不算抑郁?抑郁,就是精神层面的问题了。
2 结果与讨论
2.1 前处理条件的选择
在盐析辅助液液萃取法中影响萃取效率的因素主要有萃取溶剂、盐析剂的种类及用量等。萃取溶剂一般选择既能溶于水又能在盐析剂作用下与水分层的溶剂, 因此本研究考察了乙腈、甲醇、乙醇、丙酮和四氢呋喃5种常见萃取溶剂的效果。结果表明, 加入硫酸铵后, 除甲醇外, 其余4种溶剂均发生了有机相和水相的分离, 4种溶剂中PAEs的萃取回收率大小顺序为乙腈>丙酮>乙醇>四氢呋喃, 考虑到乙腈有沉淀蛋白的作用, 所以选择乙腈作为萃取溶剂。
实验还考察了氯化钠、碳酸钠、硫酸钠、硫酸铵、硫酸镁5种常见盐析剂的效果。结果表明硫酸铵的萃取回收率最高, 其原因可能由于硫酸铵具有更好的水溶性和更强的盐析能力, 因此选择盐析剂为硫酸铵。进一步对乙腈和硫酸铵的用量进行了优化, 结果见图1。综合考虑萃取回收率和节省试剂, 得到优化的前处理条件为:5. 00 g含乳饮料中添加1. 5 mL乙腈和2. 0 g硫酸铵。
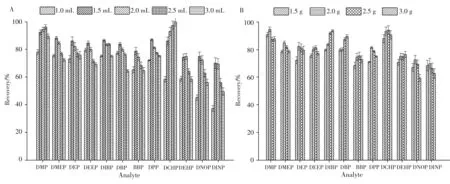
图1 乙腈(A)与硫酸铵(B)用量的影响(n=3)Fig. 1 Effects of the dosage of acetonitrile(A)and(NH4)2SO4(B)(n=3)
2.2 背景消除
由于环境中无处不在的塑化剂和来自于分析系统本身的干扰, PAEs检测过程中的本底干扰非常高, 本实验在混合池与六通阀间加装C18反相色谱柱, 能很好地消除系统背景中塑化剂的干扰。同时, 检测时要扣除试剂空白带来的本底, 以保证定性和定量分析结果的准确性。研究发现, 常见滤膜会引入PAEs, 实验筛选了聚醚砜滤膜、尼龙滤膜、玻璃纤维滤膜、聚丙烯滤膜、聚四氟乙烯滤膜、聚偏氟乙烯滤膜6种滤膜, 每种滤膜过滤相同体积的空白样液, 发现聚四氟乙烯滤膜可以有效避免PAEs的引入。
2.3 基质效应
鉴于含乳饮料基质较为复杂, 本研究按照“1. 5”方法考察基质效应的影响, 若基质效应在80%~120%之间, 说明可忽略基质的影响, 采用溶剂标准曲线定量即可;反之, 则应考虑基质效应对实际检验结果的影响。结果显示, 12种PAEs的ME为33. 5%~55. 3%(见表2), 存在较强的基质抑制效应。通常消除基质效应的方法有同位素内标法和基质匹配标准曲线法, 考虑到12种PAEs的同位素内标获取难度大, 成本较高, 因此本方法采用基质标准曲线外标法定量。
2.4 线性范围、检出限与定量下限
将“1. 2. 1”中系列质量浓度的PAEs混合标准工作溶液依次按照本方法进行测定, 绘制12种PAEs的标准曲线(见表2)。结果显示, 12种目标物的线性关系良好, 相关系数(r2)不小于0. 997。12种PAEs混合标准工作溶液(10. 0μg/L)的色谱图见图2。由图2可见, 12种PAEs分离完全, 峰形对称, 无杂峰干扰, 可以满足定量检测要求。采用在空白含乳饮料中添加3倍预估检出限浓度目标组分的方法, 以信噪比S/N=3和S/N=10分别确定各组分的检出限(LOD)和定量下限(LOQ)。结果表明, 12种PAEs的检出限为0. 03~0. 6μg/kg, 定量下限为0. 1~2. 0μg/kg(见表2)。GB 5009. 271-2016《食品安全国家标准食品中邻苯二甲酸酯的测定》国标方法中PAEs的定量下限最低为0. 3 mg/kg[28], 因此本方法的灵敏度优于或与国标方法相当, 且本方法检测时间缩短10 min, 并降低了有机试剂用量。
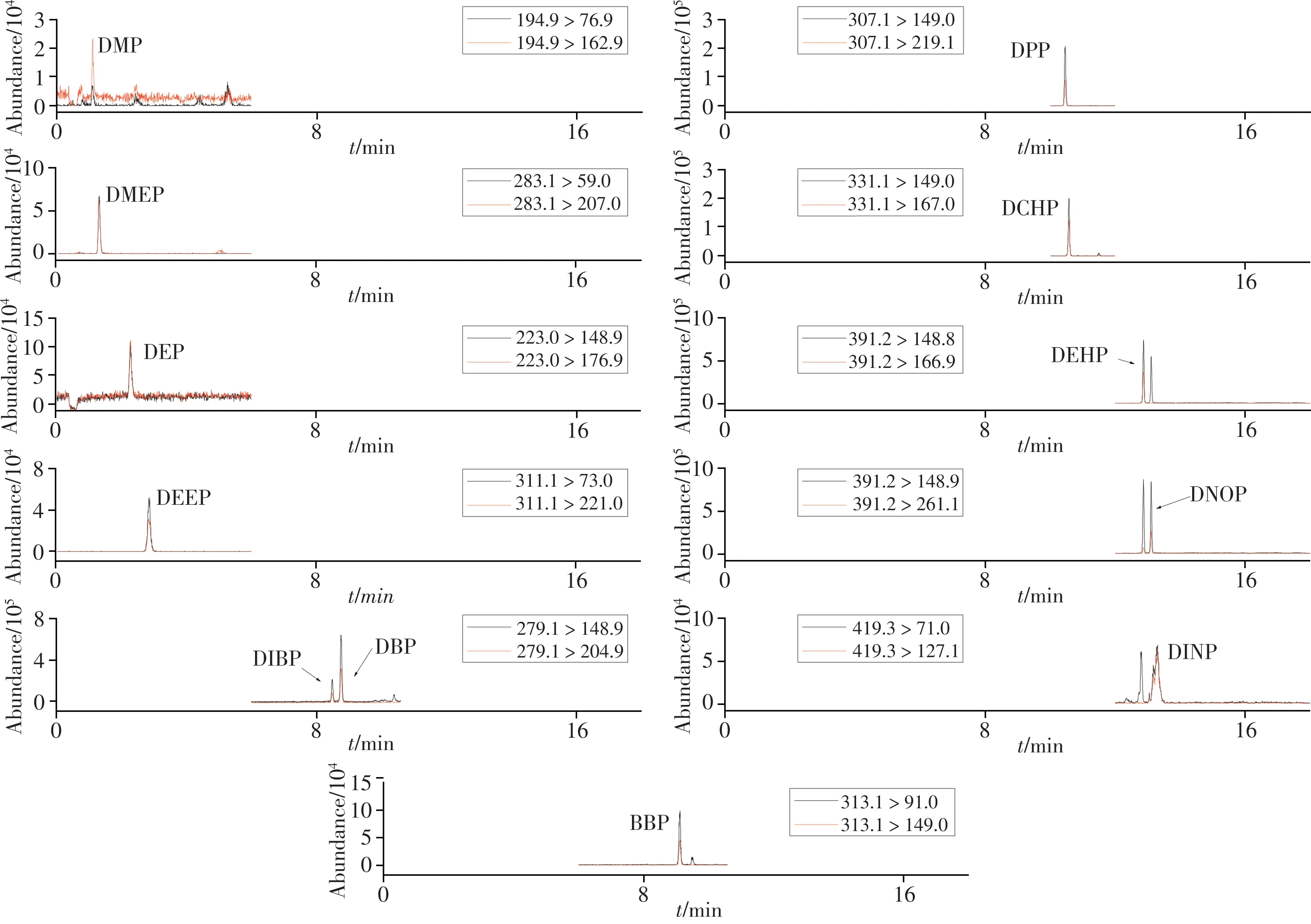
图2 PAEs混合标准工作溶液的色谱图(10. 0μg/L)Fig. 2 Chromatograms for mixed standard solution of PAEs(10. 0μg/L)
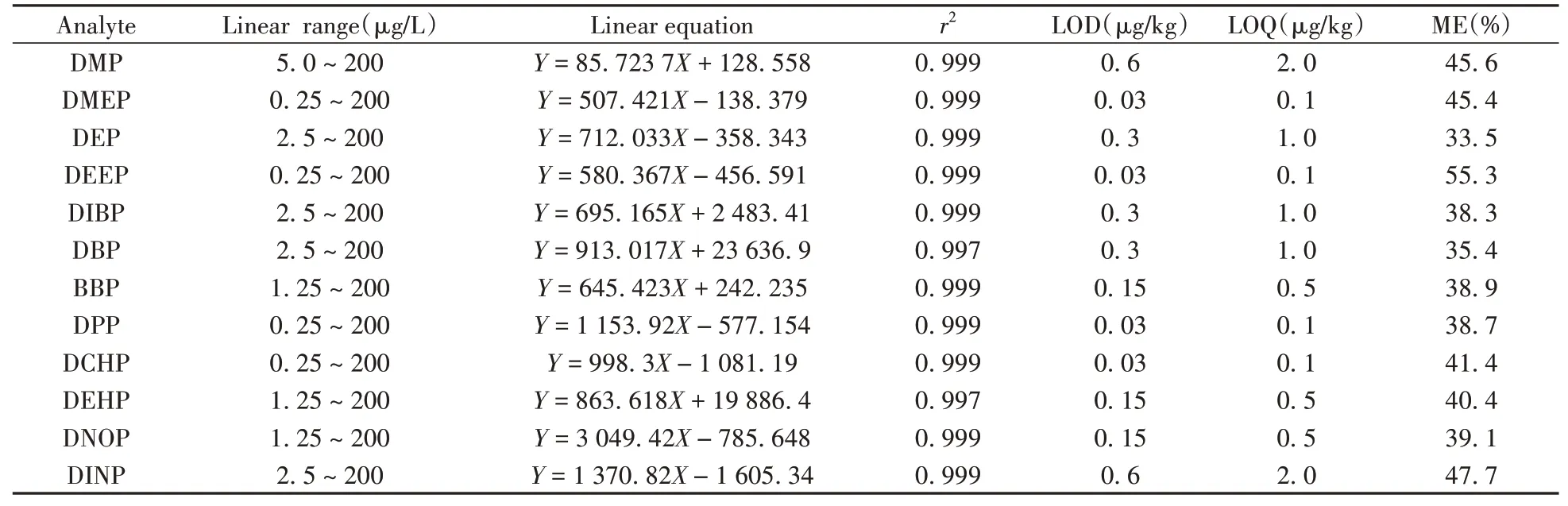
表2 12种PAEs的线性关系、检出限、定量下限及基质效应Table 2 Linear relations, limits of detection(LODs), limits of quantitation(LOQs)and matrix effects(MEs)of 12 PAEs
2.5 准确度与精密度
在空白含乳饮料样品中分别加入低、中、高及LOQ 4种浓度的PAEs混合标准溶液, 按照本方法重复测定6次, 得到加标回收率和相对标准偏差(RSD), 结果见表3。由表3可知, 12种PAEs的加标回收率为70. 8%~111%, RSD为0. 30%~7. 2%, 准确度和精密度均能满足定量检测要求。
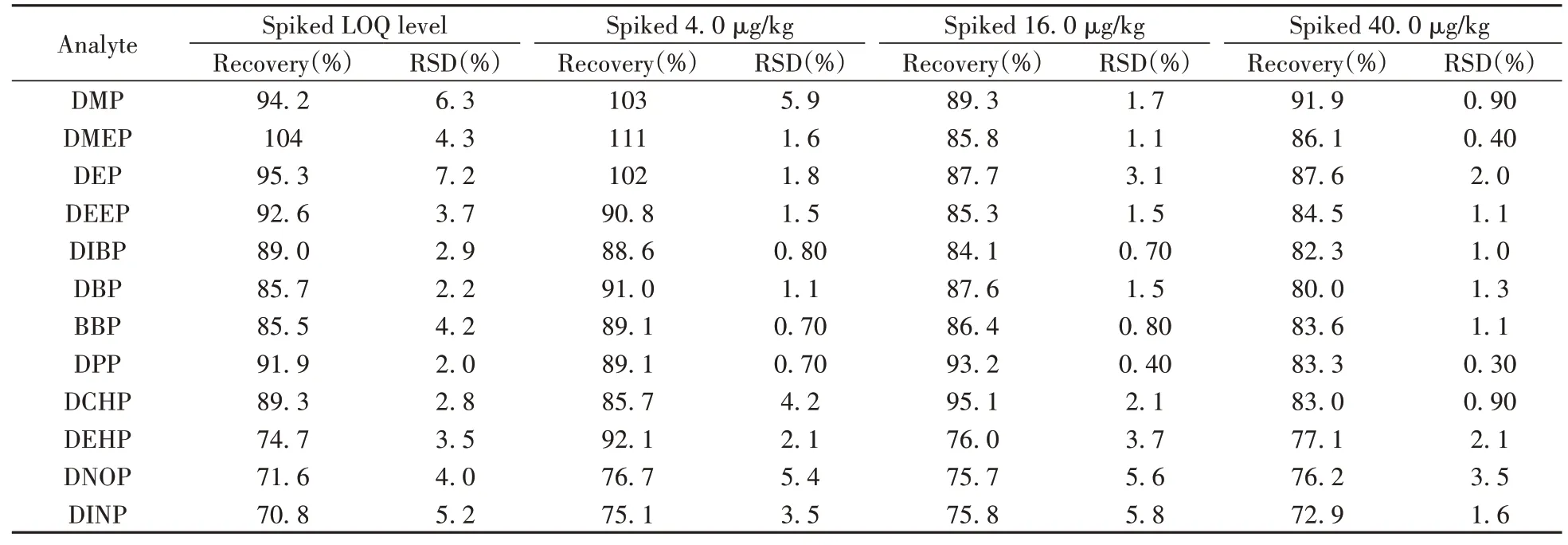
表3 12种PAEs的平均回收率及相对标准偏差(n=6)Table 3 Mean recoveries and relative standard deviations(RSDs)of 12 PAEs(n=6)
2.6 实际样品检测
采集当地市场随机抽取的含乳饮料样品共10批, 采用本方法进行前处理并检测12种PAEs的含量。结果有4批次样品检出DMP、DIBP、DBP、DEHP、DINP, 检 出 率 为40%, 含 量 为0. 83~49. 6μg/kg(见表4);其余7种PAEs均未检出。典型阳性样品的色谱图见图3。我国GB 9685-2016《食品安全国家标准食品接触材料及制品用添加剂使用标准》中规定DEHP、DINP和DBP的最大残留量分别为1. 5、9. 0、0. 3 mg/kg[11], 因此上述10批次样品为合格样品。

表4 含乳饮料阳性样品中PAEs的检出结果(μg/kg)Table 4 Detected results of PAEs in positive milk beverage samples(μg/kg)

图3 阳性样品的色谱图(样品2)Fig. 3 Chromatograms for the positive sample(sample 2)
2.7 温度及光照因素考察
对PAEs在不同温度及光照下的迁移行为进行了研究, 以空白含乳饮料样品(塑料瓶材质为PET)为例, 分别选取40、60、80℃避光及60 W光照4个条件, 在48 h内定期检测样品中12种PAEs的含量。结果表明, 80℃下短时间内DBP的迁移最为显著, 最高迁移量达到7. 82μg/kg, 40℃和60℃下短时间内迁移并不明显;值得注意的是, 60 W光照下, 短时间内DBP也产生了部分迁移(如图4)。其他11种PAEs则未发现含量变化。我国食品安全标准GB 9685-2016规定[11], PET材质包装DBP的允许迁移量为0. 3 mg/kg, 本研究中DBP在48 h内的最大迁移量远低于国家标准, 因此短时间内的高温和光照下12种PAEs的污染风险较小。

图4 不同温度及光照下DBP的迁移量对比(n=3)Fig. 4 Comparison of DBP migration under different temperatures and lighting condition(n=3)
3 结 论
本文建立了检测含乳饮料中12种PAEs的盐析辅助液液萃取/超高效液相色谱-串联质谱法。与GB 5009. 271-2016国标方法[28]相比, 该方法的检出限优于或达到现有国家标准, 检测时间缩短10 min, 有机试剂用量减少, 成本大大降低, 且操作简单快捷, 实用性强, 非常适合含乳饮料中PAEs含量的高通量检测。此外, 部分PAEs在80℃或60 W光照下短时间内会微量从塑料瓶中迁移至饮料中, 因此瓶装含乳饮料长时间存储应避免高温光照, 以降低污染风险。
