高效液相色谱法测定藜麦中芦丁含量
2022-10-21田旭静崔小芳
田旭静,崔小芳
(1.山西铁道职业技术学院,山西 太原 030013;2.山西锦烁生物医药科技有限公司,山西 晋中 030600)
藜麦是一种原产于南美洲安第斯中高海拔山区的藜科藜属植物,具有相当全面的营养物质,因此被赋予“营养黄金”的称号[1]。至今,藜麦已有几千年的种植和食用历史,藜麦不仅具有高蛋白,还富含对人体健康有利的多酚、皂苷、维生素等营养物质,被推荐为全谷全营养食品[2]。藜麦的营养品质受气候、土壤、种植条件等因素的影响,目前在山西、四川、陕西等地广泛种植。
芦丁是维生素P属的一类黄酮类化合物,可以通过清除氧自由基,进而对油脂过氧化作用产生明显的抑制作用,可用作开发新型食用油脂[3]。芦丁可以改善血管的功能,维持毛细血管的弹性,使血管的脆性和通透性降低,医学上可降低高血压、糖尿病、视网膜出血等一系列疾病的发生率。目前可以采用比色法、薄层扫描法、高效液相色谱法、紫外分光光度法等来测定芦丁的含量,其中效率最高、应用最广的方法是高效液相色谱法[4]。
高效液相色谱法(HPLC)是一种重要的分离检测技术,已作为食品、药品检验的重要方法之一。HPLC是采用高压输液系统,将流动相注入系统,样品通过进样系统随流动相进入分离系统,样品中各组分由于极性不同,在分离系统中实现分离,依次进入检测系统在相应条件下得到不同的响应值,依据响应值对样品中各组分进行定量分析。流动相可以为多种溶液按照规定的比例制作为混合溶液,也可以使用单一溶液的方式。分离系统有色谱柱和控温组成。HPLC技术和传统的色谱检验方法相比,具有检测自动化水平高,分析速度快、精度高的优势,精度能够达到0.01 ng,所以在食品检验领域价值高[5]。本试验采用高效液相色谱法测定藜麦中的芦丁含量,并对此方法的重复性、稳定性和精密度进行研究,旨在为进一步提取芦丁原料和筛选芦丁含量高的藜麦种质奠定基础。
1 材料与方法
1.1 仪器
ASl0200AT超声波清洗器,天津奥特赛恩斯;Vanquish Core(VWD)高效液相色谱仪,赛默飞世尔科技有限公司;MILLIPORE超纯水器(美国密理博公司),电子分析天平(德国赛多利斯CP-224S)。
1.2 试剂
芦丁标准品(坛墨质检科技股份有限公司,纯度98.%),甲醇为色谱纯,超纯水,山西忻州静乐县藜麦。
1.3 色谱条件
采用Agela Technologies Venusil ABS C18柱,流动相为乙腈-水(2∶8),采用梯度洗脱,流速为0.8 mL·min-1,柱温为30℃,检测波长200 nm,进样量20μL。
1.4 芦丁标准溶液的配制
用天平准确称定芦丁标准品10 mg于量瓶中,加入甲醇溶液进行溶解,然后稀释定容至25 mL,摇匀,得到质量浓度为400μg·mL-1的芦丁标准品储备液。取适量储备液稀释成2μg·mL-1、4μg·mL-1、8μg·mL-1、35μg·mL-1、60μg·mL-1、120μg·mL-1质量浓度梯度,按前述色谱条件取20μL进样[6]。芦丁标准品的色谱图见图1。

图1 芦丁标准品色谱Fig.1 The standard chromatogram of rutin
1.5 样品处理
取藜麦样品80 g,先进行脱壳处理,然后置于40℃烘干箱中鼓风干燥3 h后研细,过0.25 mm筛,用天平精密称定5.0 g,加入50 mL甲醇溶液溶解于150 mL磨口锥形瓶中,密塞摇匀,超声提取30 min,再回流水解1.5 h,用甲醇溶液补足减失的质量,摇匀,过滤,取一定量的提取液经0.45μm滤膜(Milipore,USA)过滤后,取20μL直接进样[7]。
2 结果与分析
2.1 标准曲线和线性范围
将芦丁标准溶液系列从低浓度到高浓度进行排序,根据试验方法分别进样20μL进行测定。标准曲线是以质量浓度x值为横坐标,以峰面积Y值为纵坐标绘制而成,见图2。结果可见,在2~120μg·mL-1芦丁标准品的质量浓度和相应的峰面积之间线性关系保持良好。线性回归方程为y=0.316 44x-0.068 1,相关系数r=0.999 9[7]。

图2 芦丁标准曲线Fig.2 The standard curve of rutin
2.2 加样回收率试验
用天平准确称定藜麦样品5 g(其中芦丁含量为2.83μg/g)共6份,分别置于量瓶中,将芦丁浓度为2μg·mL-1的标准品溶液以1 mL,15 mL的标准各加入3份于6份样品中。按照样品测定方法进行峰面积的测定和芦丁含量的计算[8]。由表1可以看出,芦丁的平均回收率为98.33%,相对标准偏差RSD为2.02%。

表1 回收率试验结果Tab.1 The recovery test results
2.3 样品的测定
按照上文1.5所述对样品进行处理,用天平精密称取6份样品,超声提取后将提取液进行过滤,分别取20μL直接进样。样品1~6的芦丁含量分别为2.76μg/g,2.81μg/g,2.74μg/g,2.84μg/g,2.88μg/g,2.71μg/g[8]。
2.4 精密度试验
取同一浓度芦丁标准品溶液,重复精密吸取5次各20μL,在1.3色谱条件下进样,将5次的峰面积值做好记录,结果表明5次峰面积值的RSD为1.22%,说明仪器具有良好的精密度[6]。
2.5 重复性试验
用天平准确称定藜麦样品5.0 g共5份,对样品处理后,进行提取制备,从5份样品提取液中各取20μL进样,进行5次峰面积值的测定和芦丁含量的计算,RSD为0.69%,说明本法重复性比较好[7]。
2.6 稳定性试验
选择藜麦样品溶液进行稳定性试验,分别在0 h、2 h、4 h、6 h、8 h、12 h进样20μL测定,不同时间内的峰面积值见表2。结果表明藜麦样品中芦丁峰面积值的RSD为0.91%,表明该样品在12 h内具有较好的稳定性[6]。
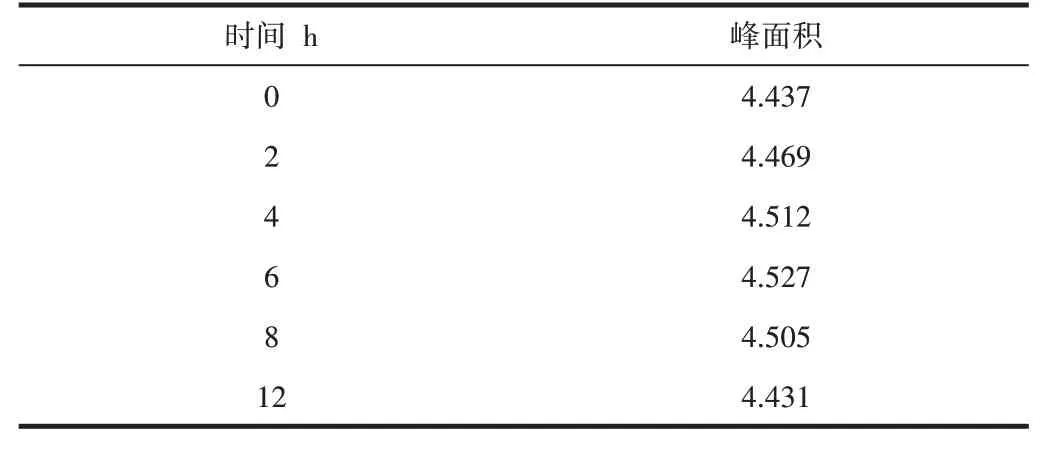
表2 藜麦中芦丁稳定性试验结果Tab.2 The stability test results of rutin in Quinoa
3 结语
本试验结果表明,在2~120μg·mL-1范围内,芦丁标准品的质量浓度和相应的峰面积之间线性关系保持良好。线性回归方程为y=0.316 44x-0.068 1,r=0.999 9,平均加样回收率为98.33%,RSD为2.02%。其中重复性,稳定性,精密度均能符合试验要求,因此本试验方法测定芦丁方法可靠简便,适合于藜麦产品的质量标准检测。
在很多芦丁测定的研究中,样品中的芦丁一般采用乙醇或甲醇来进行提取[8]。本试验分别用乙醇和甲醇对藜麦中芦丁进行提取试验,结果发现,采用甲醇作为藜麦中芦丁的提取剂效果更好,样品的回收率、稳定性、重复性更符合试验要求[9]。同时测定藜麦种质的芦丁含量,筛选出芦丁含量比较高的藜麦种质,可为后续藜麦功能育种研究提供相关依据。
