头孢哌酮舒巴坦联合吸入用乙酰半胱氨酸对反复加重支气管扩张症患者的临床疗效及安全性观察
2022-10-21李贺梅
李贺梅
(洛阳伊洛医院 呼吸与危重症医学科,河南 洛阳 471000)
支气管扩张症作为呼吸系统常见病,是指患者支气管及周边组织出现慢性炎症及气道阻塞的现象,使得支气管结构受损,最终导致管腔异常扩张,患者临床表现为咳嗽、咳痰等,严重者可出现喘息、呼吸困难等情况,给患者健康造成极大危害[1]。目前,临床针对反复加重的患者,若未能够尽早选择合适的治疗方案,随着疾病不断加重,可增加呼吸功能障碍及慢性肺源性心脏病发生的风险,直接危及患者生命[2]。既往,临床除了常规疗法之外,多选择乙酰半胱氨酸进行干预,其作为痰液裂解剂,虽然能够减轻患者咳嗽及咳痰的症状,但效果未能达到预期,甚至延长治疗周期,导致较多不良反应出现,不利于病情尽快恢复[3-4]。近些年,医学技术不断进步,临床发现在此基础上采取头孢哌酮舒巴坦的效果更为理想,其属于复合制剂,不仅能够发挥杀菌效果,同时可提升抗菌活性,进一步增强整体疗效,且不会引起严重不良反应,可保障患者预后[5]。本文对此进行分析,选择洛阳伊洛医院纳入的68例支气管扩张症患者,探讨头孢哌酮舒巴坦+吸入用乙酰半胱氨酸运用于反复加重的支气管扩张症患者中的价值,阐述如下。
1 资料与方法
1.1 一般资料
选择本院2020年1月至2021年10月纳入的68例支气管扩张症患者,通过随机数字表法分为两组,各34例。其中研究组男19例,女15例;年龄38~64岁,平均(50.24±3.26)岁;病程1~8年,平均(4.29±1.24)年;体重47~73 kg,平均(62.57±2.55)kg。对照组男20例,女14例;年龄36~65岁,平均(50.78±3.11)岁;病 程1~7年,平 均(4.33±1.06)年;体 重45~71 kg,平均(62.90±2.67)kg。两组基础信息相比,差异无统计学意义(P>0.05)。此研究经本院医学伦理委员会批准。
纳入标准:(1)与《中国成人支气管扩张症诊断与治疗专家共识》[6]中诊断相符;(2)具备基础的听说读写能力;(3)患者与亲属均知情;(4)病情处于反复加重期。
排除标准:(1)肺间质纤维化;(2)活动性肺结核;(3)支气管囊性纤维化;(4)支气管哮喘;(5)对药物过敏者。
1.2 方法
所有患者均接受常规治疗,包含心电监护、氧气支持、解痉平喘及对症疗法等。对照组选择乙酰半胱氨酸(意大利赞邦集团,国药准字H20150548,规格:3 mL∶0.3 g),与生理盐水(5 mL)混合后实施雾化吸入,0.3 g/次,2次/d。
研究组在上述基础上增加头孢哌酮舒巴坦钠针(深圳立健药业,国药准字H20054880,规格:30 g),与0.9%氯化钠溶液混合稀释,静滴,3 g/次,3次/d。两组持续2周。
1.3 观察指标
(1)药物治疗2周后测评治疗有效率,显效:症状积分改善85%以上,痰液细菌转阴率超出90%;好转:症状积分改善65%~85%,痰液细菌转阴率75%~90%;无效:症状积分改善低于65%,且痰液细菌转阴率不足75%。治疗有效率=(显效例数+好转例数)/总例数×100%[7]。(2)选择肺功能检测仪于药物治疗前后测量最大呼气流量(PEF)、第1 s用力呼气容积(FEV1)、用力肺活量(FVC)。(3)药物治疗前后的清晨取空腹静脉血(5 mL),以3 000 r/min速度开展离心操作,5 min后分离血清,按酶联免疫吸附法检测肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)。(4)统计两组服药前后的咳痰量,并进行咳嗽症状、呼吸困难(mMRC)评分的调查。①咳嗽症状:0分,无咳嗽;每日咳嗽次数小于10次(1分);每日咳嗽次数10~20次(2分);每日咳嗽次数大于20次(3分)[8]。②mMRC:仅剧烈运动出现呼吸困难(0分);快速行走时出现气短症状(1分);步行速度较慢或者步行一段距离后需休息(2分);步行100 m后体力不支(3分);呼吸困难影响日常生活(4分)[9]。上述量表总体Cronbach's α系数为0.920,各个维度的α系数值均大于0.80,折半信度系数为0.945,信度和效度较好,适合做咳痰、咳嗽、呼吸困难的测评。(5)统计不良反应(肺部感染、恶心呕吐、皮疹)。(6)药物治疗前后测定血气指标,包括二氧化碳分压(PaCO2)、血氧分压(PaO2)、血氧饱和度(SaO2)。(7)服药前后调查症状积分,按咳痰、全身乏力、喘息、呼吸困难的严重程度记为0~3分,得分与症状严重程度呈正相关[10]。
1.4 统计学处理
全文数据选择SPSS 20.0系统计算,±s为计量数据,选择t检验;%为计数数据,选择χ2检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 两组治疗有效率比较
研究组治疗有效率(91.18%)大于对照组(67.65%),差异有统计学意义(P<0.05)。见表1。
2.2 两组肺功能变化比较
两组服药前的肺功能差异无统计学意义(P>0.05),研究组服药后的PEF、FEV1、FVC均大于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组肺功能变化比较(± s )
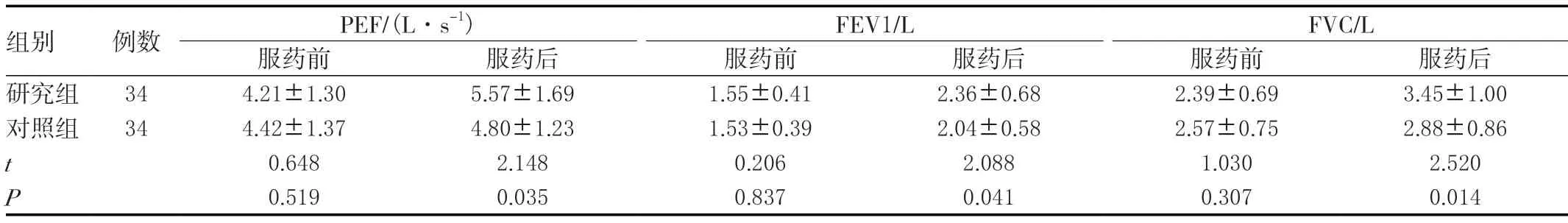
表2 两组肺功能变化比较(± s )
组别 例数 PEF/(L·s-1) FEV1/L FVC/L服药前 服药后 服药前 服药后 服药前 服药后研究组 34 4.21±1.30 5.57±1.69 1.55±0.41 2.36±0.68 2.39±0.69 3.45±1.00对照组 34 4.42±1.37 4.80±1.23 1.53±0.39 2.04±0.58 2.57±0.75 2.88±0.86 t 0.648 2.148 0.206 2.088 1.030 2.520 P 0.519 0.035 0.837 0.041 0.307 0.014
2.3 两组炎性因子比较
两组服药前的炎性因子差异无统计学意义(P>0.05),研究组服药后的TNF-α、IL-6、IL-8均小于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组炎性因子比较(± s )
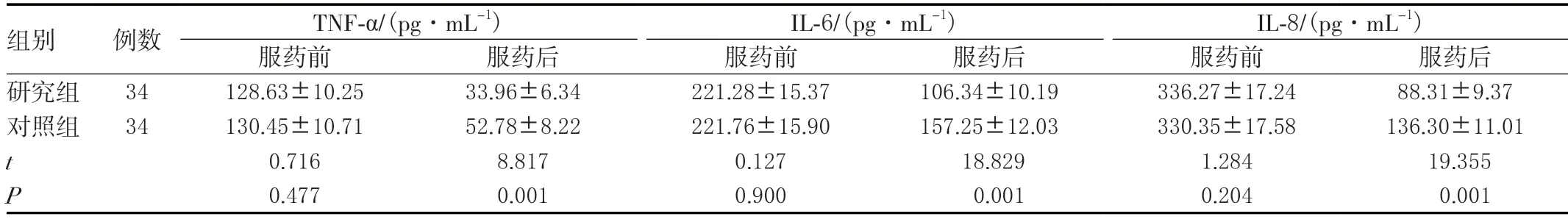
表3 两组炎性因子比较(± s )
组别 例数 TNF-α/(pg·mL-1) IL-6/(pg·mL-1) IL-8/(pg·mL-1)服药前 服药后 服药前 服药后 服药前 服药后研究组 34 128.63±10.25 33.96±6.34 221.28±15.37 106.34±10.19 336.27±17.24 88.31±9.37对照组 34 130.45±10.71 52.78±8.22 221.76±15.90 157.25±12.03 330.35±17.58 136.30±11.01 t 0.716 8.817 0.127 18.829 1.284 19.355 P 0.477 0.001 0.900 0.001 0.204 0.001
2.4 两组病情变化比较
两组服药前的病情差异无统计学意义(P>0.05),研究组服药后的咳痰量、咳嗽症状、mMRC评分均小于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组病情变化比较(± s )
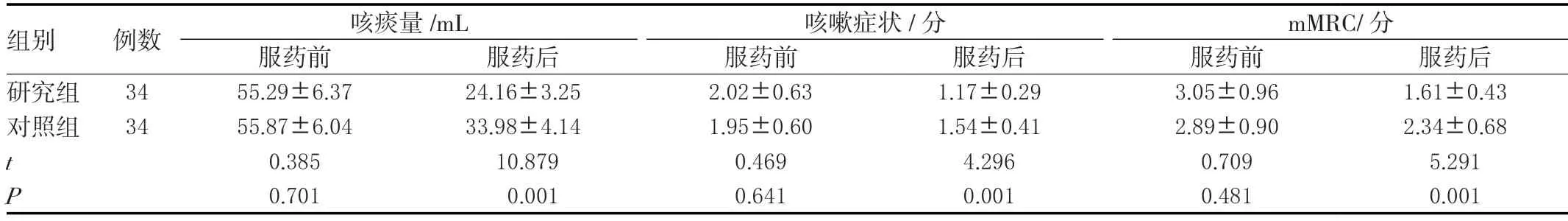
表4 两组病情变化比较(± s )
组别 例数 咳痰量/mL 咳嗽症状/分 mMRC/分服药前 服药后 服药前 服药后 服药前 服药后研究组 34 55.29±6.37 24.16±3.25 2.02±0.63 1.17±0.29 3.05±0.96 1.61±0.43对照组 34 55.87±6.04 33.98±4.14 1.95±0.60 1.54±0.41 2.89±0.90 2.34±0.68 t 0.385 10.879 0.469 4.296 0.709 5.291 P 0.701 0.001 0.641 0.001 0.481 0.001
2.5 两组不良反应比较
研究组不良反应(11.76%)与对照组(20.59%)差异无统计学意义(P>0.05)。见表5。
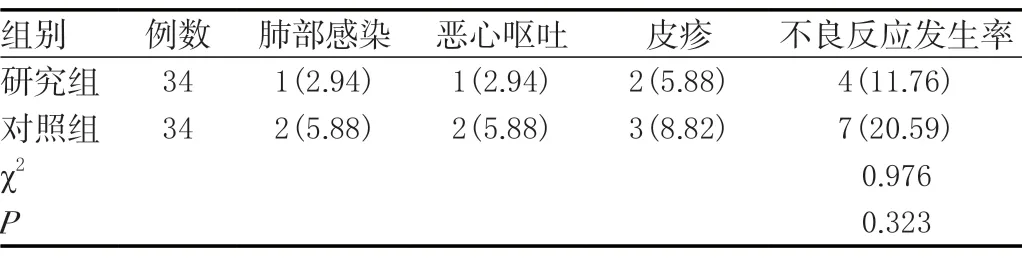
表5 两组不良反应比较[n(%)]
2.6 两组血气指标变化比较
两组服药前的血气指标差异无统计学意义(P>0.05),研究组服药后的PaCO2小于对照组,PaO2、SaO2大于对照组,差异有统计学意义(P<0.05)。见表6。
表6 两组血气指标变化比较(± s )
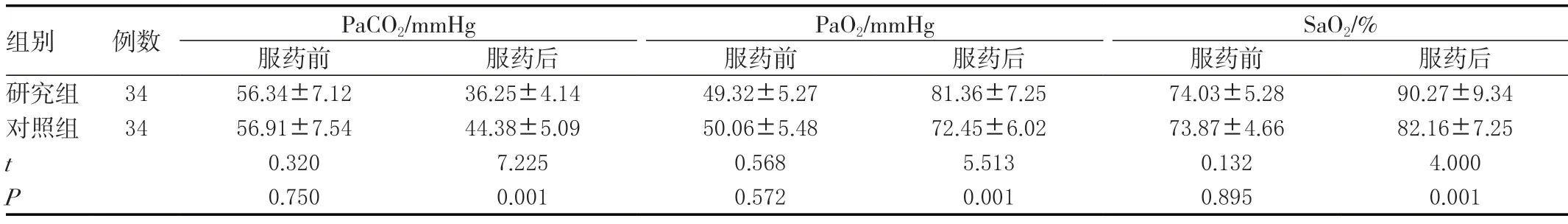
表6 两组血气指标变化比较(± s )
组别 例数 PaCO2/mmHg PaO2/mmHg SaO2/%服药前 服药后 服药前 服药后 服药前 服药后研究组 34 56.34±7.12 36.25±4.14 49.32±5.27 81.36±7.25 74.03±5.28 90.27±9.34对照组 34 56.91±7.54 44.38±5.09 50.06±5.48 72.45±6.02 73.87±4.66 82.16±7.25 t 0.320 7.225 0.568 5.513 0.132 4.000 P 0.750 0.001 0.572 0.001 0.895 0.001
2.7 两组症状积分变化比较
两组服药前的症状积分差异无统计学意义(P>0.05),研究组服药后的积分均小于对照组,差异有统计学意义(P<0.05)。见表7。
表7 两组症状积分变化比较(± s )
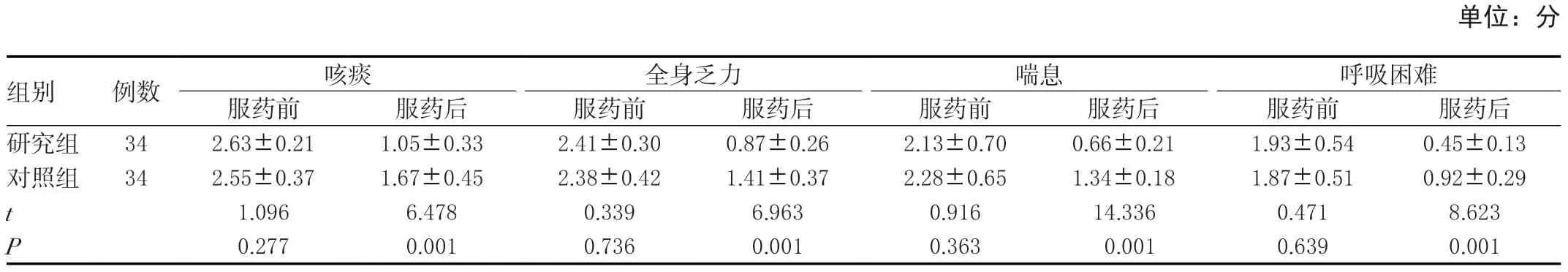
表7 两组症状积分变化比较(± s )
单位:分组别 例数 咳痰 全身乏力 喘息 呼吸困难服药前 服药后 服药前 服药后 服药前 服药后 服药前 服药后研究组 34 2.63±0.21 1.05±0.33 2.41±0.30 0.87±0.26 2.13±0.70 0.66±0.21 1.93±0.54 0.45±0.13对照组 34 2.55±0.37 1.67±0.45 2.38±0.42 1.41±0.37 2.28±0.65 1.34±0.18 1.87±0.51 0.92±0.29 t 1.096 6.478 0.339 6.963 0.916 14.336 0.471 8.623 P 0.277 0.001 0.736 0.001 0.363 0.001 0.639 0.001
3 讨 论
临床认为支气管扩张症的发生机制较复杂,多与纤毛运动异常、遗传、感染、免疫功能缺陷等因素息息相关[11]。此外有数据[12]显示,该病在我国的患病率较高,且呈现日渐升高趋势,其中成年人的发生率达到1.2%左右。据研究报道表示[13],支气管扩张症通常指支气管与周围肺组织出现慢性化脓性炎性反应及纤维化,从而牵连支气管壁肌肉、弹性组织受损,使得支气管变形,且永久性扩张。一旦与感染合并后,可呈现反复加重趋势,不仅给患者带来较大痛苦,同时提升临床治疗的难度。因此,尽早选择合适的治疗方案在保障患者预后上具有重要意义。
乙酰半胱氨酸作为天然的氨基酸合成物,其中活性巯基基团能够对痰液进行裂解,同时经雾化吸入途径给药,可加速患者痰液内黏蛋白向小分子肽链裂解的速度,使得痰液的流变学特性变化,以此减低痰液的黏滞性,最终使痰液排出[14]。另外,该药还可促进气道黏膜的纤毛运动,增强黏膜纤毛的清除功能,刺激Ⅱ型肺泡细胞,使肺泡中积液排尽,有助于清除炎性病灶组织。尤其是针对反复加重期患者而言,乙酰半胱氨酸可有效控制患者呼吸道中定植菌生长,并促进氧自由基消失,对支气管黏膜上皮能力发挥保护作用[15]。但随着该药的使用,实际工作中发现单一用药的效果较局限,无法达到预期,甚至延长治疗时间,增加家庭及社会的负担。随着临床研究的不断深入,研究人员发现支气管扩张症反复加重的关键在于稳定期细菌感染,因此,基于乙酰半胱氨酸的基础上,应联合头孢哌酮舒巴坦进行干预。头孢哌酮舒巴坦属于复合制剂,包含头孢哌酮与舒巴坦,前者属于第三代头孢菌素,能够避免细菌细胞壁发生合成反应,从而起到杀菌效果;而后者不仅能够控制β内酰胺酶的活性能力,同时提升对产酶耐药菌株的抗菌活性,使得抗菌谱范围扩大,且两者相互作用,进一步增加抗菌活性,并提升整体疗效[16-18]。
本文研究结果显示:研究组治疗有效率(91.18%)大于对照组(67.65%),差异有统计学意义(P<0.05);研究组不良反应(11.76%)与对照组(20.59%)差异无统计学意义(P>0.05);两组服药前的肺功能、炎性因子、病情、血气指标、症状积分差异无统计学意义(P>0.05),研究组服药后的PEF、FEV1、FVC、PaO2、SaO2均大于对照组,但TNF-α、IL-6、IL-8、PaCO2、咳痰量、咳嗽症状、mMRC评分、症状积分均小于对照组,差异有统计学意义(P<0.05),上述结果说明研究组不仅能够促进症状消失,减轻炎性反应,同时促进肺功能好转,缓解咳嗽及咳痰症状,不良反应少,安全性高。由于支气管扩张症的发生发展过程中,通常伴有炎性因子的共同参与[19]。其中TNF-α能够调控机体的炎症与免疫,适量表达可对机体进行保护,而过度表达可牵连组织受损;IL-6能够调控炎性反应,成为判断细菌感染的重要标志;IL-8则是趋化因子家族的细胞因子,可调节人类生殖生理及病理过程,且能够特异性与受体发生结合反应[20-22]。本文结果中显示,研究组服药后的TNF-α、IL-6、IL-8较对照组更低,进一步证实了研究组能够清除机体炎性反应,促进病情尽快恢复。但此次试验中仍存在较多不足及缺点,比如试验开始前虽然按照入组及排除标准选择观察对象,但最后纳入的观察对象是否合理,仍需要商榷;同时该试验的样本数量较少,且未对患者进行长时间的随访,未观察其长期疗效,针对此,临床可选择更多观察对象,增加样本的丰富性,同时延长随访时间,对患者长期疗效进行评价,以此保证试验结果的准确性。
综上所述,头孢哌酮舒巴坦+吸入用乙酰半胱氨酸的疗效更为理想,增强肺功能,可促进炎性反应消失,减少咳痰量,不良反应少,改善血气指标,使症状快速减轻,安全性较高,值得使用。
