妊娠期暴露代森锰锌对子代小鼠肝脏的损伤作用
2022-10-21宫英阑包佳鹭王晓丹
温 冉,宫英阑,包佳鹭,张 妍,王晓丹
(河北农业大学 中兽医学院,河北 保定 071000)
代森锰锌(mancozeb,MCZ)是一种多位点乙撑双二硫代氨基甲酸盐类(EBDCs)广谱杀菌剂,主要用来保护蔬菜和果树等经济作物免受真菌引起的多种病害。由于其具有低急性毒性和短暂的环境持久性因此在世界范围内广泛应用[1]。然而其代谢产物乙撑硫脲是一种多器官致癌物质,具有在各种器官中形成肿瘤的潜在风险[2]。随着全球对水果和蔬菜的需求增加以及MCZ持续的非选择性杀菌效力,MCZ的产量将继续快速增长,因此人类和动物接触及食用受污染的农产品(如西红柿,土豆,葡萄类水果)或水的几率将会大大增加[3]。研究表明,长期暴露MCZ会诱导哺乳动物产生显著的细胞毒性[4]、遗传毒性[5]和神经毒性[6]。MCZ还能够通过血-胎盘[7]和血-乳屏障[8]损害下一代的生长发育。
目前,关于MCZ的毒性研究主要集中在亲代,而对子代的损伤机制研究较少。因此,本研究采用ELISA法对子代小鼠血清中的炎症因子水平进行测定,并采用qPCR对子代小鼠肝脏中的凋亡基因的mRNA表达水平进行分析,以探究妊娠期暴露MCZ对子代小鼠肝脏损伤的机制。
1 材料与方法
1.1 试剂和仪器MCZ(商品级Dithane-M45,80%);Eastep®Super总RNA提取试剂盒(LS1040)购自Promega(北京);Light Cycler®96全自动荧光定量PCR仪购自罗氏诊断产品有限公司(上海);Synergy HTX多功能酶标仪(BioTek,USA);丙氨酸氨基转移酶(ALT)测试盒(C009-2-1)、天门冬氨酸氨基转移酶(AST)测试盒(C010-2-1)均购自南京建成生物科技有限公司;白介素-1β(IL-1β)试剂盒、白介素-6(IL-6)试剂盒、肿瘤坏死因子-α(TNF-α)试剂盒均购自上海酶联生物科技有限公司。
1.2 实验动物及分组未经产的8周龄健康昆明小鼠(SPF级),体质量(38±2)g,购自斯贝福(北京)生物技术有限公司,许可证号:SCXK(京)2019-0010。小鼠每日给予光照、黑暗各12 h,饲养环境温度保持在(25±0.5)℃,湿度50%~60%,自由采食和饮水。适应性饲养1周后,小鼠于当天晚上9点合笼,次日上午7点检查阴栓。检出阴栓者,定为孕0 d。将孕0 d的母鼠随机分为5组,每组10只。A组为空白对照组,灌胃去离子水0.2 mL,B、C、D、E组为MCZ处理组,孕1~17 d分别灌服溶于去离子水的MCZ(50,100,150,200 mg/kg)0.2 mL。所有母鼠单独喂养,产后与其子鼠同窝喂养,哺乳期不饲喂MCZ。在子代小鼠出生21 d时,每组随机选取10只子代小鼠采集血液和肝脏。本研究中动物的使用经河北省动物保护协会批准,动物处理过程通过实验动物管理和使用委员会的动物伦理学审查。
1.3 指标测定
1.3.1子代小鼠肝脏指数 小鼠称质量后处死,剥离肝脏,并在生理盐水中洗涤,滤纸吸干水分后称质量。
肝脏指数(%)=肝脏质量(g)/体质量(g)×100%。
1.3.2子代小鼠肝脏组织形态学观察 将固定好的子代小鼠肝脏取出,梯度酒精脱水,二甲苯透明,浸蜡、包埋、制备成5 μm切片,苏木精-伊红(HE)染色,显微镜下进行组织形态学观察。
1.3.3子代小鼠血清中ALT、AST含量的测定 子代小鼠眼眶窦采血,血液经3 500 r/min离心15 min,收集血清。按照ALT测试盒(C009-2-1)和AST测试盒(C010-2-1)操作说明处理血清样品并检测,计算得到子代小鼠血清中相应的ALT、AST含量。
1.3.4子代小鼠血清中IL-1β、IL-6、TNF-α含量测定 采用酶联免疫吸附法(ELISA)测定子代小鼠血清中IL-1β、IL-6、TNF-α的含量。
1.3.5子代小鼠肝脏中Bax、Bcl-2和Caspase-3 mRNA的表达 使用总RNA提取试剂盒提取肝脏中总RNA,随后用反转录试剂盒合成cDNA。采用Real-time quantification PCR法对Bax、Bcl-2、Caspase-3基因转录水平进行检测,引物(表1)由TaKaRa(大连,中国)设计并合成。反应条件:95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环。以β-actin为内参照基因,用2-ΔΔCt计算各目的基因相对转录水平。

表1 引物序列及扩增产物长度

2 结果
2.1 MCZ对子代小鼠体质量和肝脏指数的影响由表2可知,与0 mg/kg MCZ组相比,MCZ处理组子代小鼠的体质量和肝脏指数明显升高,差异极显著(P<0.01);并且随着MCZ暴露量的增加,子代小鼠的体质量和肝脏指数也明显增大,呈剂量依赖性。

表2 MCZ对子代小鼠体质量和肝脏指数的影响
2.2 MCZ对子代小鼠肝脏组织形态结构的影响子代小鼠肝脏组织病理学变化如图1所示。与0 mg/kg MCZ组相比,50 mg/kg MCZ处理组子代小鼠肝脏出现结构紊乱,100 mg/kg MCZ处理组肝脏出血,150和200 mg/kg MCZ处理组子代小鼠肝脏出现肝细胞肿大,发生空泡变性。
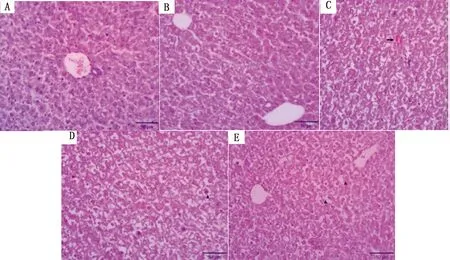
A,B,C,D,E.0,50,100,150,200 mg/kg;注:→表示出血点;▲表示空泡变性
2.3 MCZ对子代小鼠血清AST、ALT活性的影响由表3可知,与0 mg/kg MCZ组相比,100 mg/kg MCZ可显著提高子代小鼠血清中AST含量(P<0.05),150和200 mg/kg MCZ极显著提高子代小鼠血清中AST含量(P<0.01)。与0 mg/kg MCZ组相比,150 mg/kg MCZ可显著提高子代小鼠血清中ALT含量(P<0.05),200 mg/kg MCZ极显著提高子代小鼠血清中ALT含量(P<0.01)。

表3 MCZ对子代小鼠血清AST、ALT活性的影响 U/L
2.4 MCZ对子代小鼠血清中炎症因子IL-1β、IL-6、TNF-α水平的影响子代小鼠血清中炎症因子IL-1β、IL-6、TNF-α含量如图2所示。与0 mg/kg MCZ组相比,150 mg/kg MCZ组子代小鼠血清中IL-1β和TNF-α含量显著升高(P<0.05),200 mg/kg MCZ组子代小鼠血清中IL-1β和TNF-α含量极显著升高(P<0.01),200 mg/kg MCZ组子代小鼠血清中IL-6含量显著升高(P<0.05)。
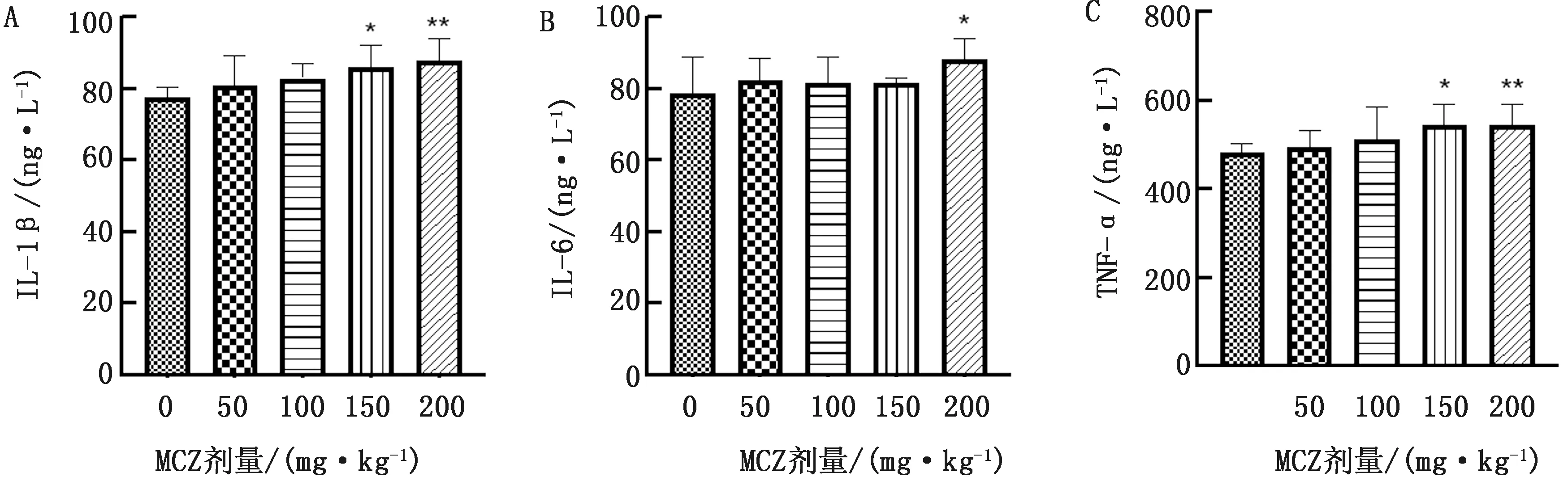
注:与对照组相对,*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。下同
2.5 MCZ对子代小鼠肝脏中Bax、Bcl-2和Caspase-3 mRNA表达水平的影响由图3可知,与0 mg/kg MCZ组相比,MCZ暴露组肝脏中Bcl-2/Bax比值明显降低,Caspase-3 mRNA的表达水平明显升高,具有显著性差异。150 mg/kg MCZ暴露显著降低子代小鼠肝脏中Bcl-2/Bax比值(P<0.05),200 mg/kg MCZ暴露极显著降低子代小鼠肝脏中Bcl-2/Bax比值(P<0.01),200 mg/kg MCZ暴露显著提高子代小鼠肝脏中Caspase-3 mRNA表达水平(P<0.05)。
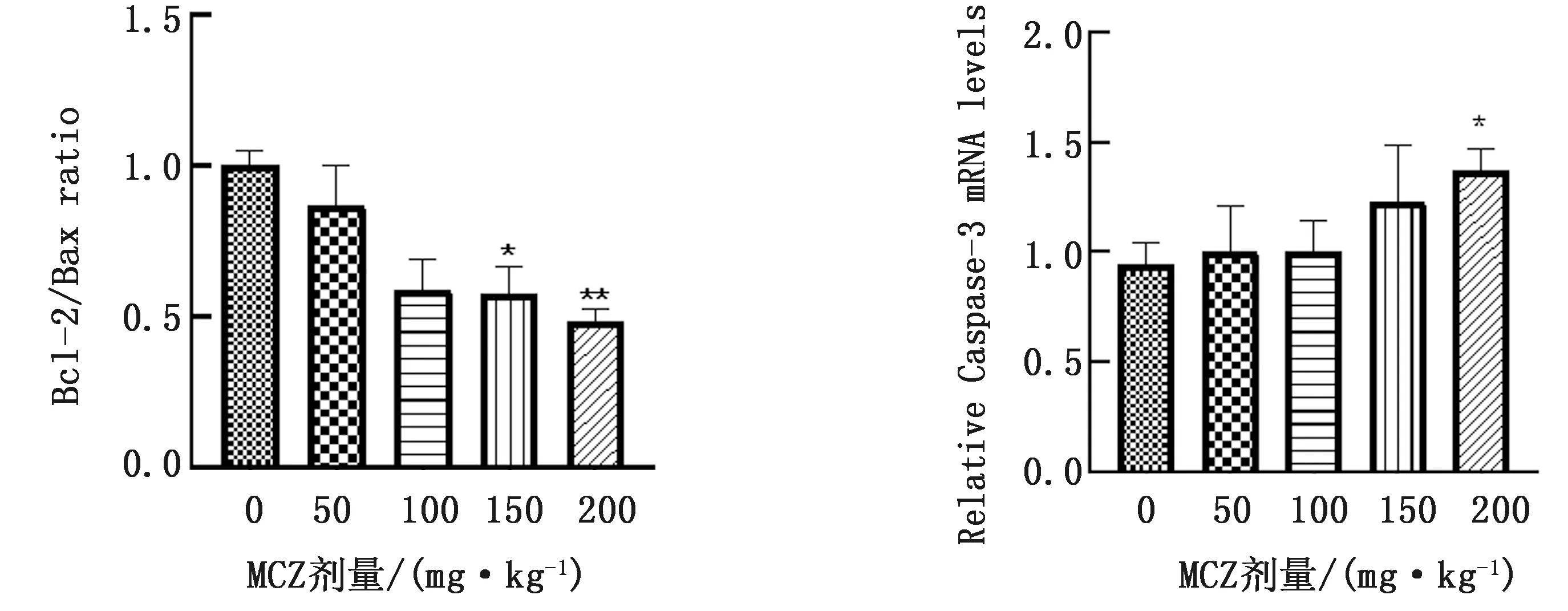
图3 MCZ对子代小鼠肝脏中Bcl-2/Bax比值(A)和Caspase-3 mRNA(B)表达水平的影响
3 讨论
据报道,长期接触MCZ会对动物机体的健康产生影响,例如胰腺、肾上腺和甲状腺功能障碍[9],此外暴露于MCZ的成年大鼠还会出现肝毒性和DNA损伤[10]。在发育过程中接触MCZ会引起雄性小鼠下丘脑氨基酸神经传递的改变,对下丘脑神经内分泌系统造成损害[11]。尽管如此,MCZ因为在环境中短暂存在而被广泛使用[12]。本研究结果表明,与对照组相比,暴露于MCZ的子代小鼠体质量和肝脏指数显著增加,组织病理学观察也显示子代小鼠肝脏组织出现严重的损伤和结构异常。
肝脏是机体中最重要的代谢器官,它是物质合成与代谢、能量产生和转换的重要枢纽[13]。AST和ALT主要分布于肝细胞内,然而当肝细胞发生损伤或坏死时,肝细胞膜通透性增加,AST和ALT会从细胞中逸出流入到血液中,因此血液中ALT、AST的含量能够反映肝脏的损伤程度[14]。YAHIE等[15]的研究发现暴露于MCZ的雄性大鼠血清中的AST和ALT含量明显增加。与本研究结果一致,暴露于MCZ后的子代小鼠血清中的AST和ALT的含量随MCZ的剂量增加而增多,表明MCZ造成子代小鼠肝脏损伤。
肝脏中含有许多先天性免疫细胞,如库普弗细胞、树突状细胞和自然杀伤细胞,它们通过产生细胞因子来引发和维持炎症[16]。TNF-α主要由单核巨噬细胞分泌,是炎症早期级联反应启动的关键因子,通过提高中性粒细胞的吞噬功能,促进炎症细胞分化作用[17]。IL-1β会导致组织局部发生炎症反应,且作用于单核巨噬细胞,诱导IL-6的合成和分泌,进一步导致肝细胞发生免疫病理反应[18]。而IL-6是IL家族的核心成员,在T细胞增殖、B细胞分化等方面发挥着重要作用,也是反映机体炎症程度的指标之一。因此TNF-α、IL-1β、IL-6的含量能够间接反映肝脏的损伤程度。与对照组相比,暴露于MCZ的子代小鼠血清中的促炎因子(IL-1β、TNF-α和IL-6)水平显著升高,表明MCZ会造成子代小鼠出现炎症反应。
细胞凋亡是细胞程序性死亡,其主要分为线粒体途径、内质网途径和死亡受体途径[19],其中线粒体途径是经典的细胞凋亡途径之一。Bax和Bcl-2是细胞凋亡中最重要的调控基因,其中Bax是促凋亡基因,在凋亡信号的诱导下,Bax会转位至线粒体膜上形成Bax-Bax同源二聚体,并破坏线粒体外膜的完整性,使细胞色素C释放,进而激活Caspase-3,启动Caspase-3级联反应从而导致细胞凋亡[20]。与之相反,Bcl-2抑制凋亡基因,存在于线粒体外膜上,可与Bax竞争性的结合,形成Bax-Bcl-2异源二聚体,中和Bax的促凋亡作用,抑制细胞凋亡的发生[21]。因此,Bcl-2/Bax的比值能够决定细胞凋亡是否发生[22-23]。当Bcl-2/Bax的比值降低时,会促进细胞凋亡的发生。本试验通过检测子代小鼠肝脏中的Bax、Bcl-2和Caspase-3的mRNA表达水平来验证MCZ是否会导致子代小鼠的肝细胞发生凋亡,结果发现暴露于MCZ的子代小鼠肝脏中Bcl-2/Bax的比值随剂量增加而降低,而 Caspase-3的mRNA表达水平明显升高,表明MCZ会导致子代小鼠发生肝细胞凋亡。
