犬流感病毒诱导的Beagle犬NLRP3炎性小体相关基因表达谱
2022-10-21宁章勇王贵平贾爱卿李守军张桂红
陶 攀,宁章勇,王贵平,贾爱卿,周 沛,李守军*,张桂红*
(1.华南农业大学 兽医学院,广东 广州 510642;2.广东海大集团 畜牧兽医研究院,广东 广州511400)
犬流感(canine influenza,CI)是犬群的一种接触性呼吸道传染病,该病由正黏病毒科A型流感病毒属的犬流感病毒(canine influenza virus,CIV)引起。患犬主要表现为发热、咳嗽、打喷嚏、食欲减退、精神沉郁等,严重者可因呼吸系统衰竭而死亡。由于流感病毒基因组是由单股分节段的RNA所组成,这使得流感病毒基因很容易发生重组而导致跨物种传播。此外,与其他RNA病毒相比,流感病毒的RNA依赖于自身聚合酶,在病毒复制过程中容易出错,无法通过常规方法控制突变病毒的进化,对全球公共安全造成了巨大的危害[1-2]。CIV主要有2个亚型:马源H3N8[3-6]和禽源H3N2[7-9]。2004年马源H3N8 CIV首次报道,在美国弗罗里达州赛犬场的赛犬身上检测出。2007年首次从犬上分离到禽源H3N2 CIV。H3N2 CIV最初仅在亚洲国家流行[9-11],现已传播到美国和世界其他地区[12-13]。H3N2 CIV能引起犬典型呼吸道症状,如流鼻涕、打喷嚏和咳嗽等,以及呼吸道以外的其他许多器官的损伤[14-15]。
NLRP3炎性体途径是宿主早期关键的炎症反应机制之一,能够检测病原体并启动炎症细胞因子的产生,从而诱导效应细胞聚集到感染部位。2002年首次提出炎症小体通路,现被认为是宿主防御感染先天效应机制的一个组成部分[16]。NLRP3炎性体激活后能导致细胞炎症因子IL-1β和IL-18前体的成熟以及分泌,进而导致嗜中性粒细胞、单核细胞和巨噬细胞聚集到感染部位以及驱动宿主炎症反应。IL-1β和IL-18的诱导和激活被认为是炎性体激活的关键特征。除了调节宿主炎症外,炎症小体还被证明对后天性免疫反应的发展至关重要,包括免疫记忆[17]。NLRP3炎症小体的激活是宿主抵抗甲型流感病毒(IAV)感染的重要组成部分[18]。由IAV感染引起的致死性疾病往往与肺内严重的免疫病理反应有关[19],如高致病性IAV暴发的特征是超炎性细胞因子反应,这可能导致高死亡率[20-22]。而季节性IAV感染中,NLRP3炎症小体的激活在限制感染导致的肺损伤方面起着关键作用[18,23],炎症反应微弱,有助于清除IAV。因此,NLRP3炎症小体的激活代表了IL-1β和IL-18炎症细胞因子受控产生的关键平衡,因为过度旺盛或长时间的刺激会增加炎症疾病的负担[23],而适当的激活则能够对病毒感染和清除产生有效的反应。炎症细胞因子对流感病毒感染的调节机制尚不完全清楚,越来越多的证据表明炎症小体激活可能对炎症性疾病产生显著影响[24]。
1 材料与方法
1.1 毒株、细胞、菌株、质粒和实验动物H3N2 CIV(A/canine/Guangdong/B/2013)、犬肾上皮细胞系(madin-darby canine kidney,MDCK)由本实验室保存;DH5α感受态细胞、BL21(DE3)感受态细胞(唯地生物有限公司);pET32a为本实验室保存;pET32a-NLRP3、pET32a-ASC和pET32a-Caspase-1为本实验构建;新西兰大白兔(南方医科大学实验动物中心)。本试验使用的比格犬组织为本实验室保存的样本,动物试验所有程序经华南农业大学实验动物福利伦理委员会批准(编号SYXK(YUE)2014-0136)。
1.2 犬NLRP3炎症小体相关基因的克隆和原核表达载体的构建以NCBI上预测的犬NLRP3 mRNA(序列号:XM_025467830.1)、ASC mRNA(序列号:XM_014114362.2)、Caspase-1 mRNA(序列号:XM_025465696.1)为模板,通过Primer Primer 5.0软件设计NLRP3、ASC和Caspase-1基因开放阅读框(ORF)的PCR扩增引物(表1)并通过华大基因有限公司合成。克隆NLRP3、ASC和Caspase-1基因并连接至pET32a载体上,获得pET32a-NLRP3、pET32a-ASC和pET32a-Caspase-1表达载体。
1.3 NLRP3、ASC与Caspase-1的原核诱导表达及重组蛋白的纯化分别将鉴定正确的阳性重组质粒转化到BL21(DE3)感受态细胞中,进行IPTG诱导表达,获得重组表达蛋白。采用切胶方法对蛋白进行纯化并浓缩,使蛋白终质量浓度达到1 g/L左右。
1.4 NLRP3、ASC与Caspase-1蛋白多克隆抗体的制备及多抗特异性检测将上述纯化的蛋白(约为1 g/L)与弗氏佐剂等体积混合乳化后免疫新西兰大白兔,无菌双蒸水免疫耳静脉作为阴性对照。免疫时重组蛋白的用量为500 μg/只,背部皮下多点注射法进行免疫。2周后进行2次免疫,以后间隔7 d加强免疫,共4次。最后1次免疫后7 d耳静脉少量采血,经ELISA测血清抗体效价,合格后即可采血,分离血清获得抗体,然后用Western blot方法检测多抗特异性。
1.5 荧光定量PCR检测犬炎症相关基因的表达谱
1.5.1检测感染H3N2 CIV的MDCK细胞炎症相关基因的转录 首先用MDCK铺6孔板,待细胞长到85%左右后,用H3N2 CIV感染(MOI = 1),分别在12,24,48 h收取细胞,提取细胞总RNA。用荧光定量PCR检测炎症相关基因mRNA的转录水平(表2)。

表2 荧光定量PCR引物序列
1.5.2检测犬各组织炎症相关基因的转录水平 感染H3N2 CIV后3,7 d,将比格犬安乐死,取心脏、肝脏、脾脏、肺脏、肾脏、脑、气管和淋巴放-80℃ 冰箱保存,检测犬各组织炎症相关基因的转录水平。
1.6 免疫组织化学检测犬各组织NLRP3、ASC和Caspase-1蛋白的表达分别在感染H3N2 CIV后3和7 d对比格犬安乐死,取心脏、肝脏、脾脏、肺脏、肾脏、脑、气管和淋巴结用10%福尔马林固定2 d,制作HE染色切片和免疫组织化学染色切片,并通过显微镜观察结果。
2 结果
2.1 比格犬NLRP3、ASC和Caspase-1基因的克隆与蛋白序列分析以比格犬脾脏组织RNA为模板,反转录成cDNA,通过特异性引物经RT-PCR扩增反应后,分别得到比格犬NLRP3、ASC与Caspase-1基因的扩增产物,经1%琼脂糖凝胶电泳检测,都分别得到1条单一的条带,其大小分别与预测的NLRP3、ASC和Caspase-1基因的理论大小相符。将目的片段分别克隆到pMD18-T载体,转化DH5α感受态细胞,扩大培养。经质粒PCR鉴定和测序分析结果均为正确,并将重组质粒命名为pMD18-T-NLRP3、pMD18-T-ASC和pMD18-T-Caspase-1。
2.1.1比格犬NLRP3蛋白氨基酸序列分析 将比格犬NLRP3蛋白序列与人(NM_004895)、小鼠(NM_145827)、大鼠(NM_001191642)、猫(XM_023253644.1)、牛(NM_001102219)、羊(KM236558.1)、马(XM_023618258.1)、猪(NM_001256770)、鸡(KF318520)、猕猴(NM_001114351.1)、黑猩猩(XM_024254358.1)、兔(XM_017339176.1)和非洲象(XM_023540335.1)的对应蛋白序列用DNAStar进行序列比对分析,发现比格犬NLRP3蛋白与猫的对应蛋白同源性最高,为90.2%,与鸡的对应蛋白同源性最低,为33.7%(图1)。构建的NLRP3蛋白氨基酸序列进化树显示,该蛋白在种属内具有保守性,种属间具有差异性。用DNAStar对NLRP3蛋白的理化性质分析表明,比格犬NLRP3基因编码976个氨基酸,蛋白相对分子质量为112.45 kDa。Conserved domains工具分析发现该蛋白存在PYD、NACHT和LRR结构域,是结构保守蛋白。
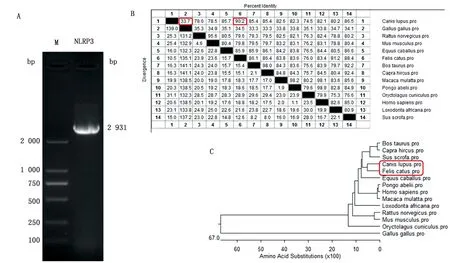
A.犬NLRP3基因的扩增;B.NLRP3氨基酸同源性比较;C.NLRP3的系统发育树分析
2.1.2比格犬ASC蛋白氨基酸序列分析 将比格犬ASC蛋白氨基酸序列与人(NM_145182.2)、大鼠(NM_172322.1)、小鼠(NM_023258.4)、猫(XM_003998633.5)、牛(NM_174730.2)、羊(KM576770.1)、马(XM_014842338.1)、斑马鱼(NM_131495.2)、猕猴(NM_001194572.1)、蝙蝠(XM_006106048.3)、猩猩(XM_002826376.3)、猪(MK302492.1)、非洲爪蟾(NM_001113079.1)的对应蛋白用DNAStar进行序列比对,发现比格犬ASC蛋白与猫的对应蛋白同源性最高,为78.6%,与斑马鱼的对应蛋白同源性最低,为27.5%(图2)。构建的ASC蛋白序列进化树显示,该蛋白在种属内具有保守性,种属间具有差异性。用DNAStar对ASC蛋白的理化性质分析表明,比格犬ASC基因编码195个氨基酸,蛋白相对分子质量为21.80 kDa。Conserved domains工具分析发现该蛋白存在PYD、CARD结构域,是结构保守蛋白。
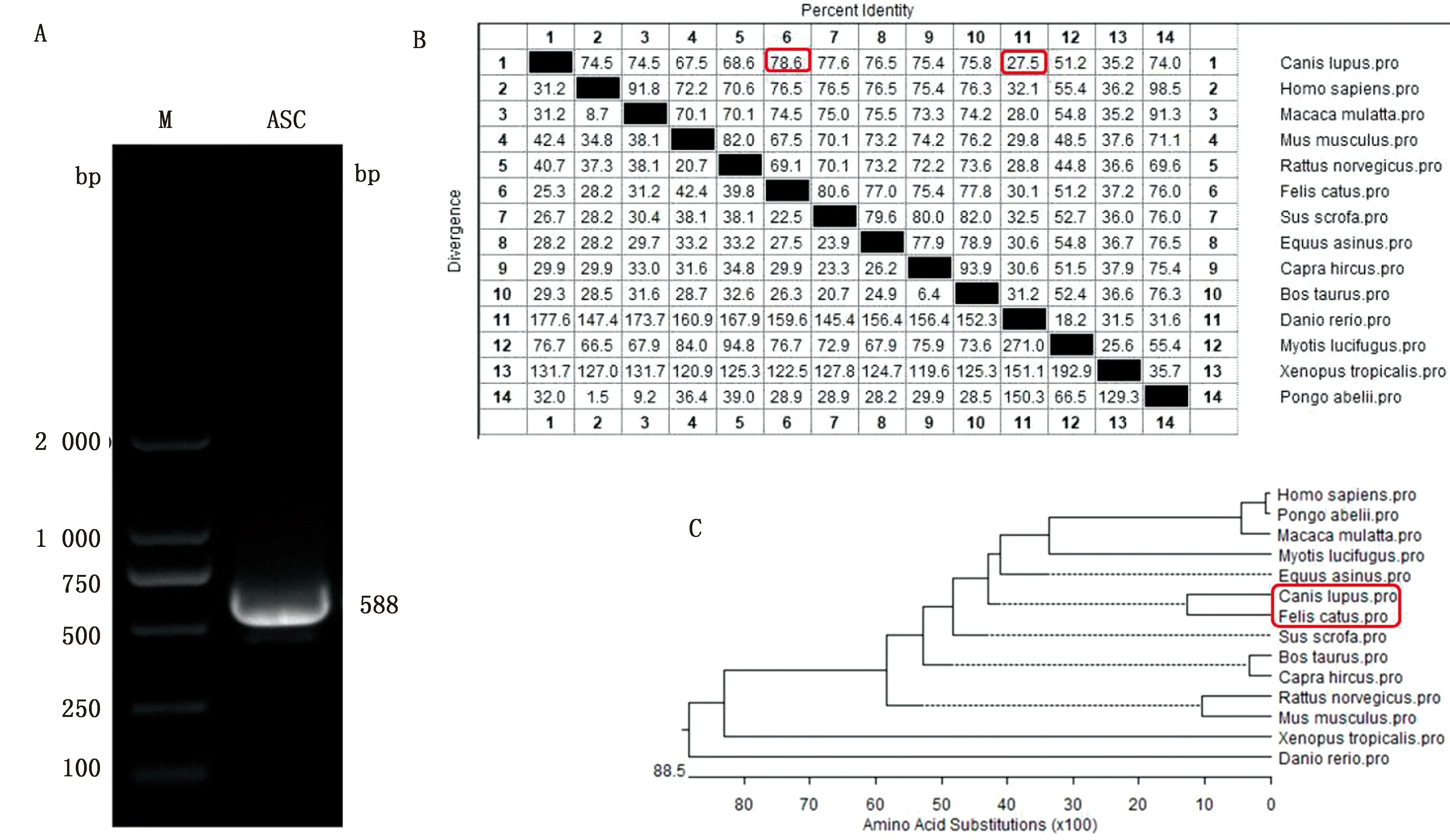
A.犬ASC基因的扩增;B.ASC氨基酸同源性比较;C.ASC的系统发育树分析
2.1.3比格的Caspaase-1蛋白氨基酸序列分析 将比格犬Caspase-1蛋白氨基酸序列与人(NM_001257118.3)、小鼠(NM_009807.2)、大鼠(NM_012762.2)、牛(XM_019975839.1)、羊(KP999980.1)、马(AF090119.1)、猪(NM_214162.1)、猫(AF135968.1)、鸡(AF031351.1)、猩猩(XM_009247004.2)、家蚕(AF448494.1)、斑马鱼(MG957992.1)的对应蛋白序列用DNAStar进行序列比对,发现比格犬Caspase-1蛋白氨基酸序列与猫的对应蛋白同源性最高,为75.9%,与斑马鱼的对应蛋白同源性最低,为32.5%(图3)。构建的Caspase-1蛋白氨基酸序列进化树显示,该蛋白在种属内具有保守性,种属间具有差异性。用DNAStar对Caspase-1蛋白的理化性质分析表明,比格犬Caspase-1基因编码404个氨基酸,蛋白相对分子质量为45.60 kDa。Conserved domains工具分析发现该蛋白存在CASc和CARD_CASP1-like结构域,是结构保守蛋白。

A.犬Caspase-1基因的扩增;B.Caspase-1氨基酸同源性比较;C.Caspase-1的系统发育树分析
2.2 比格犬NLRP3、ASC和Caspase-1基因的原核表达与蛋白纯化及多克隆抗体制备将鉴定正确的阳性质粒转化至BL21(DE3)感受态细胞中,挑取生长良好的菌株进行诱导表达。经过不同条件的诱导,发现NLRP3、ASC基因在37℃下表达量较高,而Caspase-1基因在25℃诱导表达量较高。pET-32a空载诱导未见目的蛋白表达(图4A)。诱导表达的重组蛋白通过切胶回收方式在变性条件下进行纯化回收后,可见回收蛋白基本上为条带单一的目的蛋白(图4B)。用抗His标签的抗体检测重组蛋白是否具有抗原特性,及抗原决定簇是否完整。结果表明,制备并纯化的重组蛋白能够被His标签抗体检测到,抗原决定簇的完整性没有受到破坏,能够用于多克隆抗体制备(图4C)。通过纯化蛋白4次免疫新西兰大白兔,得到高免血清。将制备好的兔抗NLRP3、ASC和Caspase-1蛋白多克隆抗体做间接ELISA测定抗体效价,结果显示血清效价都能达到1∶320 000,血清可以用于后续试验。Western blot检测抗体的抗原性,结果条带单一,无明显的杂带(图4D),表明所制备的抗血清的抗原性较好。
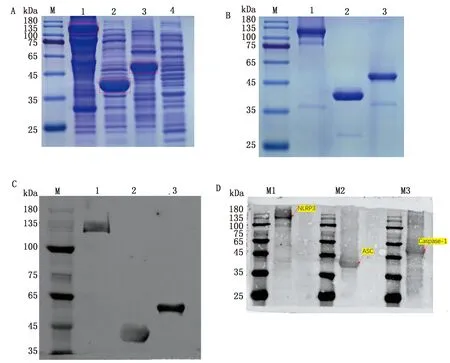
A.蛋白Marker;1.NLRP3;2.ASC;3.Caspase-1;4.Control
2.3 H3N2 CIV感染MDCK细胞后炎症因子的表达对感染H3N2 CIV的MDCK细胞进行炎症相关基因相对表达水平的检测,结果表明MDCK细胞感染H3N2 CIV后炎症相关基因的表达水平均在病毒快速复期间下降,病毒复制后期升高,只有IL-6一直保持高水转录(图5)。
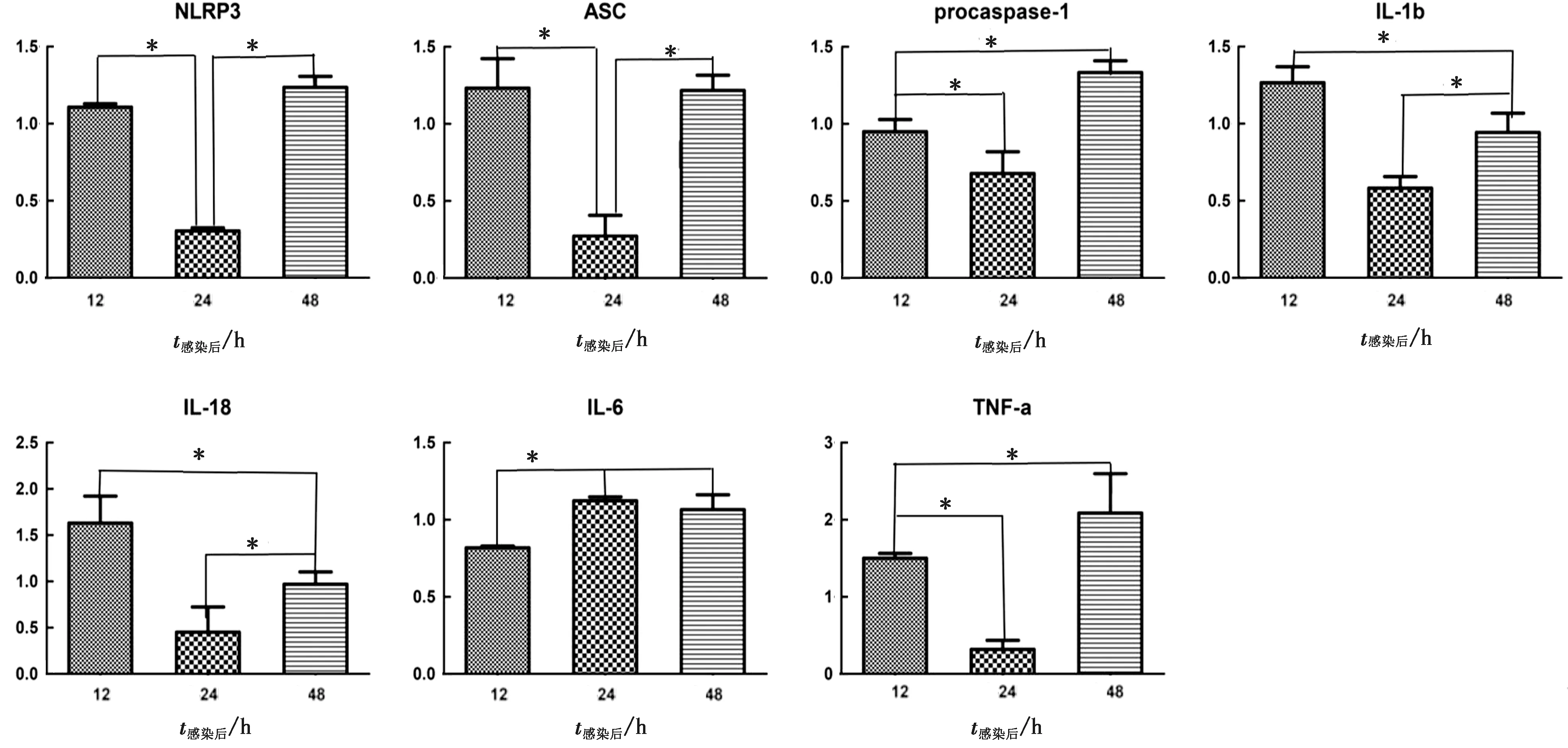
注:数据代表3组独立数据下同
2.4 H3N2 CIV感染比格犬后炎症因子的表达分别在H3N2 CIV感染比格犬后3和7 d安乐死比格犬,解剖并获取了心脏、肝脏、脾脏、肺脏、肾脏、脑、气管和淋巴结组织器官。分别对各个组织器官进行荧光定量检测炎症因子mRNA表达水平,结果显示H3N2 CIV感染比格犬3 d后犬各组织炎症相关基因的表达水平与对照组相比显著降低,而7 d后在脾脏、肺脏、脑、气管、淋巴结等组织中表达显著升高(图6)。

a~h.分别为心脏、肝脏、脾脏、肺脏、肾脏、脑、气管、淋巴结的荧光定量PCR检测结果
2.5 H3N2 CIV感染比格犬后各组织器官病理变化采集对照犬及攻毒3,7 d犬的心脏、肝脏、脾脏、肺脏、肾脏、脑、气管等,常规固定、制片并进行HE染色后观察其病理组织学变化,结果表明:各组织器官与对照组没有明显的差异,只是攻毒7 d的犬肺组织间质有明显增生。表明是机体正在清除病毒,修复损伤组织(图7)。
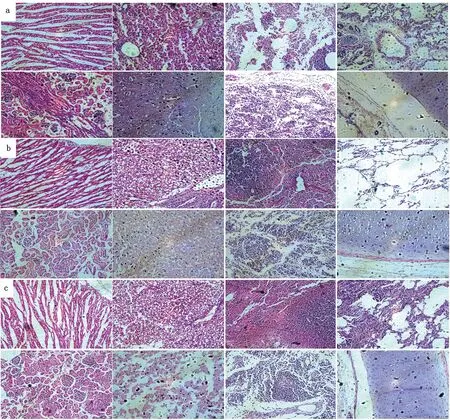
a.未攻毒犬组织;b.攻毒3 d犬组织;c.攻毒7 d犬组织;各组织依次为心脏、肝脏、脾脏、肺脏、肾脏、脑,淋巴结和气管,放大倍数为×200。下同
2.6 H3N2 CIV感染比格犬后各组织NLRP3、ASC和Caspase-1蛋白的表达采集对照犬、攻毒3和7 d 犬的心脏、肝脏、脾脏、肺脏、肾脏、脑、淋巴结、气管等,常规固定、制片1式4份,并分别用未免疫阴性血清(图8)、NLRP3、ASC和Caspase-1抗体血清进行免疫组织化学染色,对NLRP3、ASC和Caspase-1蛋白进行组织特异性表达的分析。结果表明:攻毒3 d的犬各组织NLRP3蛋白的阳性反应与对照组相比整体上没有明显的变化,但攻毒7 d的犬各组织NLRP3、ASC和Caspase-1蛋白的阳性反应整体上明显高于3 d,特别是在脾脏中的阳性反应更加明显。说明NLRP3蛋白在犬感染流感病毒后期高表达,这与荧光定量PCR结果一致(图9,10,11)。
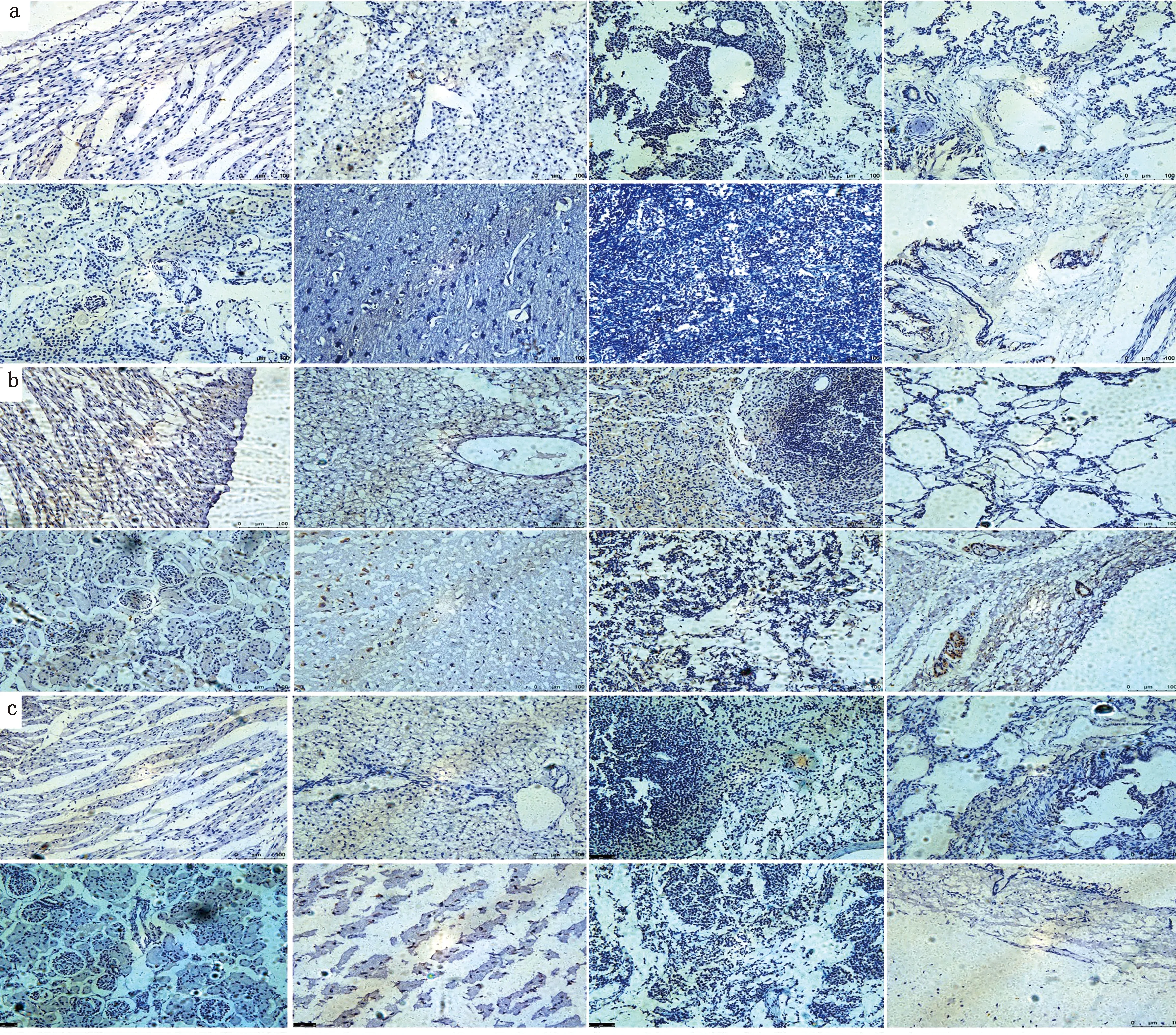
a.未攻毒犬组织;b.攻毒3 d犬组织;c.攻毒7 d犬组织
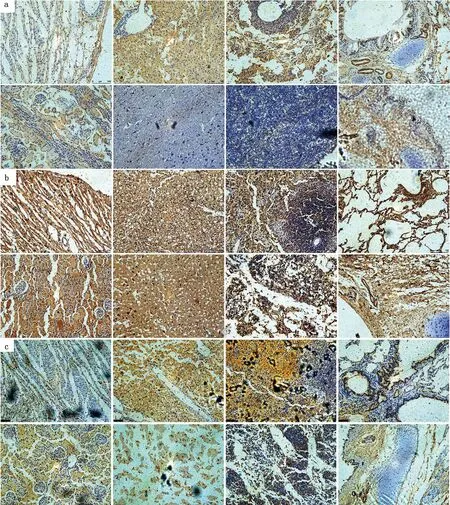
a.未攻毒犬组织;b.攻毒3 d犬组织;c.攻毒7 d犬组织
3 讨论
犬的攻毒试验表明,比格犬感染H3N2 CIV后早期肺部的病理变化与对照组相比没有明显的差异,炎症反应微弱,但感染晚期出现明显病理变化,炎症反应增强。NLRP3炎症小体的活化是机体内炎症反应活动的主要标志之一。所以本研究通过荧光定量PCR对炎症反应的相关的基因NLRP3、ASC、Caspase-1、IL-6、IL-1β、IL-18和TNF-α的mRNA进行检测,结果发现在CIV感染MDCK或比格犬早期细胞因子mRNA转录会被抑制,而后期会逐渐恢复。本研究进一步克隆比格犬NLRP3炎症小体组成蛋白NLRP3、ASC和Caspase-1的基因,通过DNAStar进行蛋白序列比对分析,发现比格犬NLRP3、ASC和Caspase-1蛋白均与猫的对应蛋白同源性最高,分别为90.2%,8.6%,75.9%,说明犬与猫的亲缘关系比较接近。用DNAStar对NLRP3蛋白的理化性质分析表明,比格犬NLRP3基因编码976个氨基酸,蛋白相对分子质量为112.45 kDa。Conserved domains工具分析发现该蛋白存在PYD、NACHT和LRR结构域,是结构保守蛋白。对ASC蛋白的理化性质分析表明,比格犬ASC基因编码195个氨基酸,蛋白相对分子质量为21.80 kDa。Conserved domains工具分析发现该蛋白存在PYD和CARD结构域,是结构保守蛋白。对Caspase-1蛋白的理化性质分析表明,比格犬Caspase-1基因编码404个氨基酸,蛋白相对分子质量为45.60 kDa。Conserved domains工具分析发现该蛋白存在CASc结构域、CARD-CASP1-like结构域,是结构保守的蛋白。
通过原核表达蛋白纯化,免疫新西兰大白兔,成功获得免疫原性较好的多克隆抗体。由于在纯化蛋白时发现NLRP3蛋白是在大肠杆菌包涵体,尝试不同方法,依然不能得到大量的纯化蛋白,本试验采用切胶纯化蛋白,通过His标签检测蛋白抗原决定簇的完整性,结果表明切胶纯化的蛋白可以被His标签抗体识别,纯化蛋白可以用于下一步试验。
随后用制备的多克隆抗体对比格犬NLRP3、ASC和Caspase-1蛋白进行组织表达谱检测。对攻毒后3,7 d的犬心脏、肝脏、脾脏、肺脏、肾脏、脑、淋巴结和气管进行免疫组织化学染色,检测NLRP3、ASC和Caspase-1蛋白表达谱,结果表明:攻毒7 d的犬各组织NLRP3、ASC和Caspase-1蛋白阳性反应更强,而攻毒3 d的与对照组相比没有明显差异。说明犬NLRP3炎症小体蛋白在犬感染流感病毒后期高表达,从而清除感染的病毒粒子。这些结果表明CIV可能在早期能够抑制机体炎症反应,从而逃逸机体的免疫反应。
克隆犬NLRP3、ASC和Caspase-1基因,通过蛋白序列分析结果发现,犬的NLRP3、ASC和Caspase-1蛋白与猫的对应蛋白同源性最高;通过荧光定量PCR检测了MDCK细胞和比格犬感染H3N2 CIV后炎症相关基因的转录水平,发现在感染流感病毒早期炎症相关基因转录水平显著降低,而在感染流感病毒后期的炎症相关基因转录比早期显著升高;对NLRP3、ASC和Caspase-1基因进行原核表达,制备多克隆抗体,通过免疫组织化学检测犬组织器官中炎症相关蛋白的表达情况,结果发现在感染H3N2 CIV后3 d犬组织中NLRP3、ASC和Caspase-1蛋白的阳性反应与对照组相比没有明显的变化,而在感染7 d的犬组织中NLRP3、ASC和Caspase-1蛋白阳性反应明显增强。
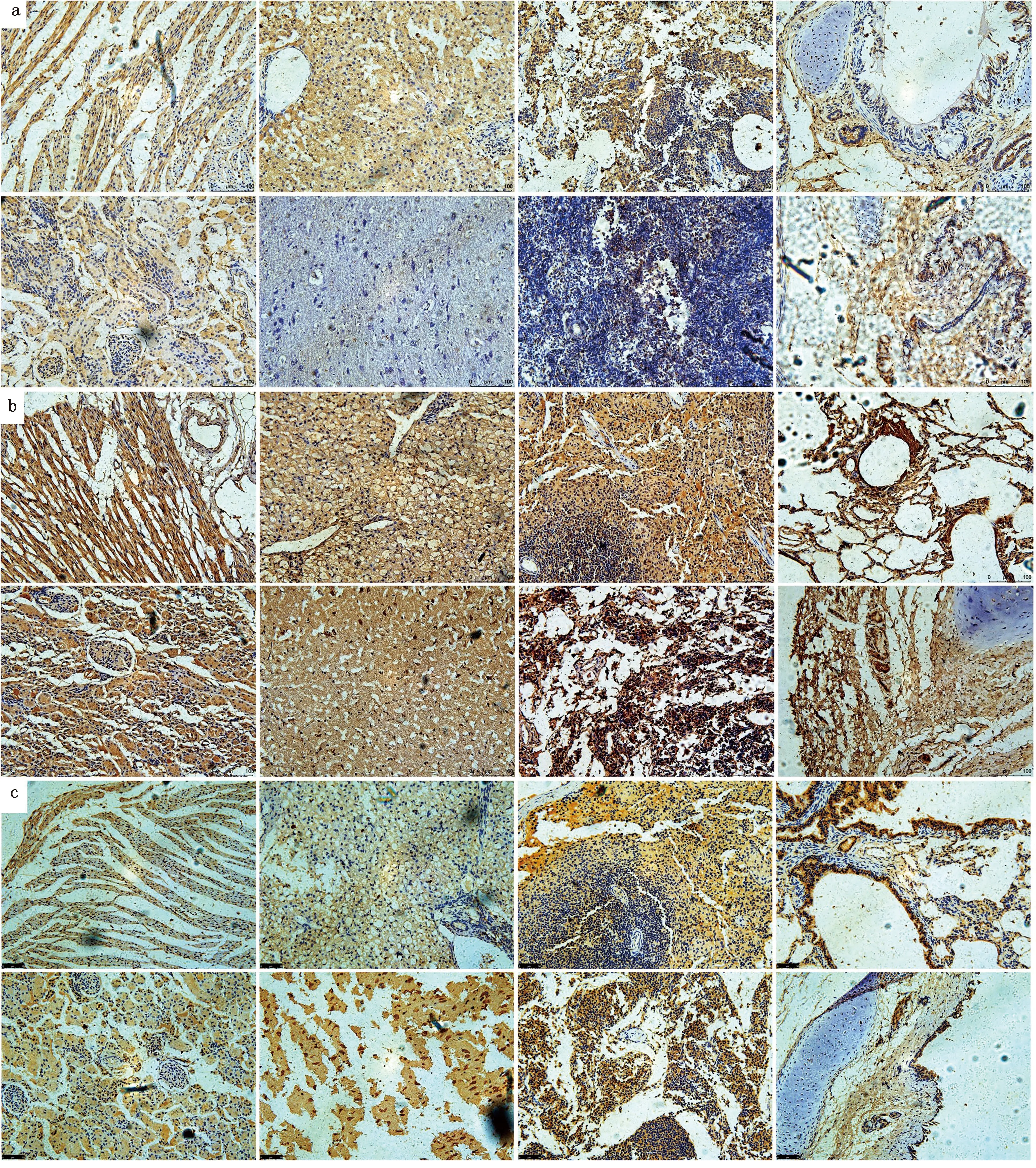
a.未攻毒犬组织;b.攻毒3 d犬组织;c.攻毒7 d犬组织
炎症小体在炎症性疾病发生、发展中发挥重要作用,同时也是炎症调控的靶标。炎症小体激活导致诱导宿主炎症反应以对抗病毒感染,现在被认为是先天免疫的关键机制之一。尽管炎性体的活化导致病毒的有效清除和伤口愈合,但是过度和长时间的活化对疾病恢复有不利影响。显然,如果要有效地靶向治疗炎症以减轻疾病负担,就必须更好地理解流感病毒感染期间炎症因子的动态平衡。本研究克隆了比格犬NLRP3、ASC和Caspase-1基因,并对其进行组织特异性表达分析,为进一步探究犬NLRP3炎症小体的功能及其在感染中的作用奠定理论基础。
