果子狸源细小病毒分离鉴定及VP2基因遗传进化分析
2022-10-20张淑琴
谭 斌,王 超,王 岩,张淑琴
(1.中国农业科学院特产研究所,长春 130122;2.黑龙江省农业科学院,哈尔滨 150086)
肉食兽细小病毒可感染猫科、犬科、浣熊科和鼬科等多种动物,导致患病动物出现以剧烈腹泻和出血性肠炎为主要特征的疾病,死亡率达80%。肉食兽细小病毒病已成为对世界犬猫等宠物、经济动物、野生动物及实验动物等危害最为严重的传染病之一[1-3]。肉食兽细小病毒依据感染宿主不同,主要包括猫泛白细胞减少症病毒(Feline panleukopenia virus,FPV)、水貂肠炎病毒(Mink enteritis virus,MEV)、犬细小病毒(Canine parvovirus,CPV)等,他们同归属于细小病毒科(Parvoviridae)细小病毒亚科(Parvovirinae)的自主复制病毒。细小病毒为单股负链无囊膜的DNA病毒,其利用宿主细胞中的聚合酶在细胞核中复制[4-5]。自然变异株或在细胞上传代的高代次病毒基因序列变异率和一些RNA病毒的变异率相当。自1978年CPV-2被鉴定后不久就发生抗原变异,2个新型抗原突变体出现CPV-2a和CPV-2b型,随后,CPV-2a和CPV-2bVP2基因发生297位(S→A)的突变,产生了New CPV-2a和 New CPV-2b变异株;2000年,以426位(D→E)突变为特征的另一种新的抗原突变体CPV-2c被报道[6-8]。相对于最初的CPV-2,抗原突变体对犬的致病性更高,且病毒的宿主范围不断扩大[9-10]。
果子狸学名花面狸,属于食肉目、灵猫科,是一种珍贵的经济动物[11]。腹泻是对果子狸养殖危害最为严重的疾病之一,群体发病多由细小病毒引起,给果子狸养殖业造成巨大经济损失。本研究从患肠炎果子狸病料中分离到1株细小病毒,并比较了与其他肉食兽细小病毒流行株的VP2基因的遗传变异情况,以期为细小病毒流行及抗原变异情况及防治提供理论依据和技术支撑。
1 材料与方法
1.1 样品采集及处理
果子狸肠道组织样品采集自山西省某果子狸养殖场。患病动物表现为拒食、脱水、腹泻、血便等临床症状。将病死动物的肠道组织用无血清 DMEM培养液(加入青霉素、链霉素浓度各为1 000 U/mL)制成 20%(V/V)悬液,冻融1次,以 5 000 r/min 离心10 min,吸取上清,用0.22 μm滤膜除菌,-80 ℃ 保存用于病毒分离。
1.2 主要试剂
猫肾细胞(CRFK细胞)由中国农业科学院特产研究所保存;FITC标记抗CPV荧光抗体购自VMRD公司;新生牛血清购自天津灏洋生物材料有限公司;细胞培养基MEM和胰酶均购自HyClone公司;DNA 提取试剂盒、Pfu聚合酶均购自北京全式金生物技术有限公司;DNA Marker和pMD18-T载体均购自TaRaKa公司。
1.3 病毒分离
CRFK细胞长满单层后,用胰酶消化成单个细胞,以40%的细胞密度铺入6孔细胞培养板,将制备的病毒样品采用同步接毒方法接种于上述CRFK细胞,同时设正常细胞对照,然后放入37 ℃、5% CO2细胞培养箱中进行培养,每天观察细胞状态和病变情况,当细胞病变效应(CPE)达到80%时,反复冻融3次后收获病毒于-80 ℃保存备用。
1.4 血凝试验
参照《中华人民共和国兽用生物制品质量标准(2001)》[12]进行微量血凝试验,分别用1%猪、鸡、绵羊和人“O”型血红细胞悬液测定第3代细胞培养物的血凝性,以50%以上红细胞出现凝集判定为阳性。
1.5 免疫荧光试验鉴定分离病毒
将收集的第3代病毒液同步接种于96 孔板内生长状态良好的CRFK细胞,同时以不接毒的正常细胞作为阴性对照,37 ℃恒温培养 60 h;弃去 96 孔板中的上清液,PBS 温和洗涤 3 次,加入预冷的固定液(甲醇∶丙酮=1∶3),4 ℃固定 30 min。弃去固定液,每孔加入 100 μL PBS 洗涤,洗涤 3次后,加入 FITC标记的抗CPV荧光抗体,每孔50 μL,37 ℃孵育 40 min,PBS 洗涤3次后,荧光显微镜下观察结果。
1.6 病毒形态观察
将收集到的第3代病毒液反复冻融3次后,以4 ℃、5 000 r/min离心10 min,取上清液进行磷钨酸负染,电镜观察。
1.7 病毒DNA提取与VP2基因克隆
按照病毒DNA快速提取试剂盒说明书提取病毒DNA,扩增VP2 基因。参照NCBI数据库肉食兽细小病毒VP2 基因保守区设计扩增引物,引物序列为:VP2F:5′-CATGAGTGATGGAGCAGTTC-3′;VP2R:5′-CTATGTTAATATAATTTTCT-3′。引物由上海英骏生物有限公司合成。PCR反应体系50 μL:2×TransStart FastPfuFly PCR SuperMix 25 μL,上、下游引物(10 μmol/L)各1.0 μL,模板2.0 μL,ddH2O补至50 μL。PCR扩增产物经1.0%琼脂糖凝胶电泳检测,胶回收PCR产物连接到pMD18-T载体中,克隆产物送上海英潍捷基生物工程有限公司进行测序。
1.8 VP2基因遗传进化分析
使用DNAStar软件对分离毒株VP2基因序列与GenBank中检索的不同基因型细小病毒VP2基因进行序列比对分析,并根据VP2基因中关键氨基酸位点对分离毒株进行基因型鉴定,应用Mega 7.0软件构建系统发育树。
2 结 果
2.1 病毒分离培养
病料样品接种于生长状态良好的CRFK细胞后,第4天出现CPE,呈现单个细胞圆缩、脱落,拉网等病变,而对照细胞生长状态良好,未出现CPE(图1)。随着传代次数的增加,CRFK细胞的病变更为明显。

A,正常CRFK细胞;B,接毒后CRFK细胞。下同 A,Normal CRFK cells;B,Infected CRFK cells. The same as below图1 分离株接种CRFK细胞后的CPE(100×)Fig.1 CPE of the isolated strain infected CRFK cells (100×)
2.2 血凝试验
分别用猪、鸡、绵羊、和人“O”型红细胞测定分离毒株的第3代细胞培养物的血凝特性,结果显示,该分离毒株仅对猪红细胞发生凝集作用,其余红细胞均不发生凝集,对猪红细胞血凝效价为1∶512。
2.3 免疫荧光试验鉴定病毒
将第3代病毒感染CRFK细胞60 h后,以FITC标记的抗CPV荧光抗体进行免疫荧光试验,在倒置荧光显微镜下观察。结果显示,分离病毒感染的CRFK细胞内有特异性亮绿色荧光,对照CRFK细胞无荧光(图2)。

图2 免疫荧光试验鉴定分离病毒(100×)Fig.2 Identification of the isolated strain by direct immunofluorescence assay (100×)
2.4 病毒形态电镜观察
在电镜下观察到无囊膜球形病毒粒子,大小约20 nm(图3),与细小病毒粒子形态一致。

图3 分离毒株电镜形态学观察结果(40 000×)Fig.3 Electron microscopic observation of the isolated strain (40 000×)
2.5 VP2基因克隆
应用VP2基因引物对第3代病毒的DNA进行扩增,得到大小约为1 750 bp的目的片段(图4),与预期片段大小相符,经过克隆后测序,确定为细小病毒基因序列,将此分离毒株命名为MPCPV-SX。

M,DL2000 DNA Marker;1,分离毒株VP2 基因扩增产物;2,阴性对照 M,DL2000 DNA Marker;1,VP2 gene of the isolated strain;2,Negative control图4 分离毒株 VP2 基因PCR扩增电泳图Fig.4 PCR amplification result of VP2 gene of the isolated strain
2.6 遗传进化分析
将MPCPV-SX的VP2 基因序列上传 GenBank,获得的登录号为KC262178。将VP2基因与数据库中的20个不同基因型的细小病毒的VP2基因构建系统发育树,发现该果子狸来源的细小病毒MPCPV-SX的VP2基因与犬细小病毒处于同一分支,但进化树位于CPV-2和CPV-2a型之间(图5)。

图5 VP2基因系统进化树Fig.5 Phylogenetic tree of VP2 gene
对VP2氨基酸序列分析发现,该分离毒株VP2氨基酸序列的87位氨基酸为亮氨酸(L)、101位氨基酸为苏氨酸(T)、300位氨基酸为丙氨酸(A),305位氨基酸为天冬氨酸(D),其余细小病毒VP2蛋白常见的氨基酸突变位点与CPV-2型毒株一致(表1)。
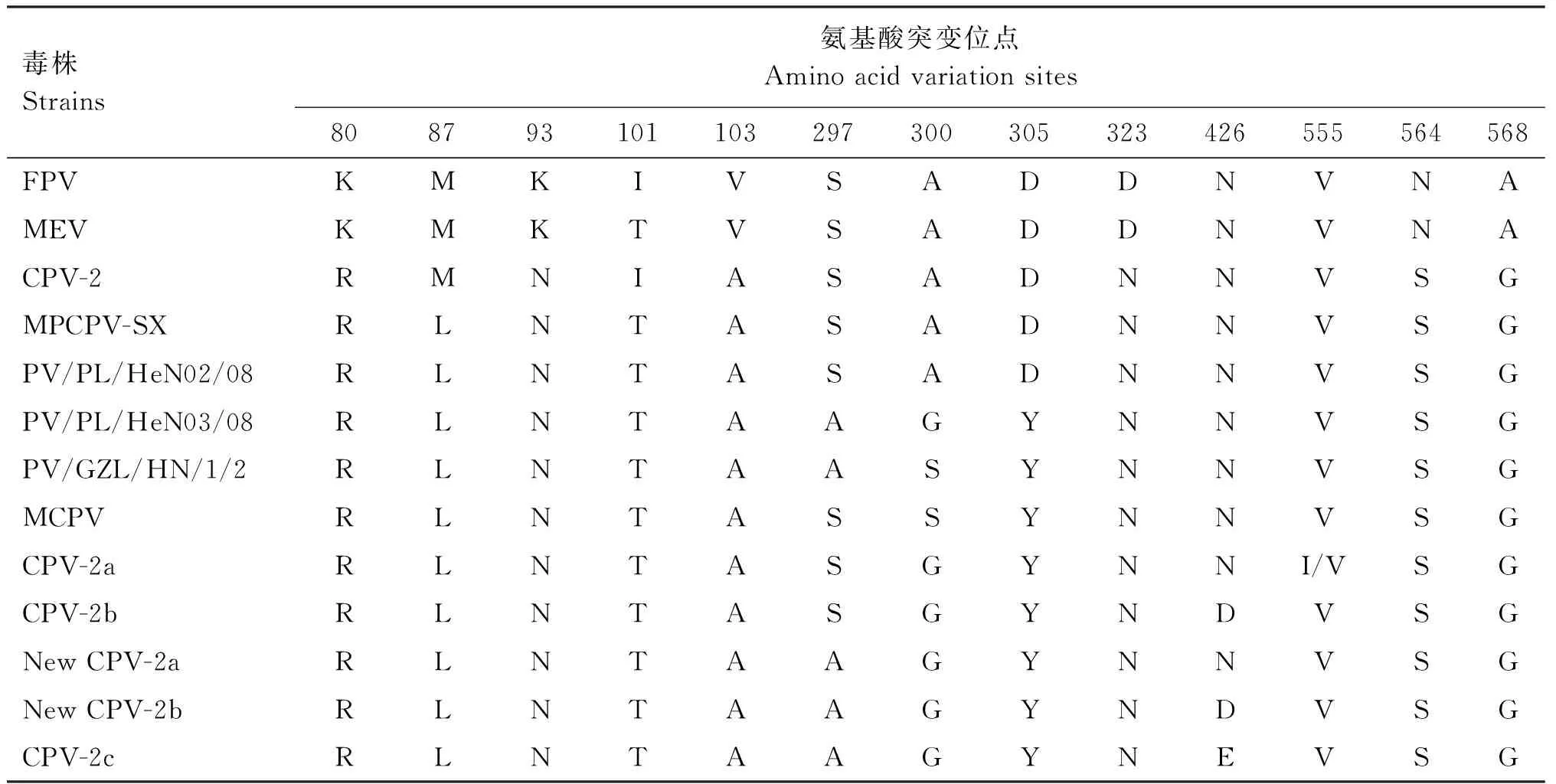
表1 MPCPV-SX株与不同肉食兽细小病毒VP2蛋白氨基酸序列变异位点比对Table 1 Comparison of amino acid sequence variation sites of VP2 protein between MPCPV-SX strain and different Carnivorous parvoviruses
3 讨 论
犬细小病毒发现于1978年,被认为是猫细小病毒的变异株,是由猫细小病毒样病毒通过适应野生肉食动物进化而来[13-14]。CPV-2自出现以来进化迅速,一些新的抗原和基因变异体出现并在全球范围内传播[15-18]。出现了CPV-2a、CPV-2b和CPV-2c等新型毒株。CPV除能感染犬外,还能感染狐狸、狼等犬科动物,而CPV-2a和CPV-2b还能感染猫、虎、熊、果子狸等动物。而出现这种感染宿主范围变化的原因与新毒株VP2衣壳蛋白氨基酸变化密切相关。与CPV-2型毒株相比,所有犬源的CPV-2a 型分离毒株的VP2衣壳蛋白都具有4个独特的氨基酸突变点,分别为87、101、300和305位氨基酸。这些变异体使新毒株不仅能感染犬科动物,且恢复了感染猫的能力(CPV-2中失去的特性)[19]。
本研究应用CRFK细胞从患有肠炎的果子狸肠道组织样品中分离到1株病毒,通过血凝试验、免疫荧光试验确定分离毒株为细小病毒。果子狸在分类学上属于灵猫科,基因进化分析其感染的病毒属于犬细小病毒,与猫细小病毒和水貂细小病毒等距离较远,因此在应用疫苗免疫时可考虑采用犬细小病毒预防。进一步分析其VP2基因的氨基酸序列发现,MPCPV-SX在87和101位氨基酸上与CPV-2a 相同,但在300和305位氨基酸上与CPV-2相同。VP2基因序列的系统进化树分析也显示了本次分离的毒株处在 CPV-2和 CPV-2a 序列之间的中间位置。
野生动物一直被认为是病毒的混合器,很多野生动物都是多种病原体携带者、中间宿主或是传染源。果子狸就是其中之一,果子狸携带多种体内寄生虫包括旋毛虫、斯氏狸殖吸虫等,其还是严重急性呼吸综合征冠状病毒(SARS-CoV)的中间宿主及狂犬病病毒的携带者。病毒在果子狸体内与宿主相互作用可能对于病毒遗传演化发挥重要作用[11,20]。细小病毒是果子狸常感染的病毒,研究报道表明果子狸可感染猫细小病毒和犬细小病毒[21],而国内学者在果子狸中分离到细小病毒均属于犬细小病毒,2003年赵忠鹏等[22]报道分离到果子狸细小病毒毒株PV/GZL/HN/1/02与Chen等[23]2011年所分离的果子狸细小病毒毒株MCPV(GQ502462)均属于CPV-2a,这2株病毒VP2蛋白关键位点除了在300位氨基酸处有1个突变(从 Gly到Ser)外,其余均与CPV-2a型一致。而柴秀丽等[24]2008年报道从河南某地送检的果子狸粪便中分离的2株果子狸源细小病毒PV/PL/HeN02/08(EU441279)和PV/PL/HeN03/08(EU441280),鉴定认为属于CPV-2a突变株,其中PV/PL/HeN02/08(EU441279)毒株与本研究所分离的毒株MPCPV-SX在这4个位置关键氨基酸(87、101、300和305)的突变完全一致。而另一毒株PV/PL/HeN03/08(EU441280)的4个关键氨基酸位点与CPV-2a 完全相同,除了在297位有一个Ser到Ala的突变。出现以上结果可能是由于不同基因型细小病毒感染果子狸后,在其体内发生基因重组引起,也有可能类似于犬细小病毒变异于猫细小病毒一样,是CPV-2适应果子狸进化而来。果子狸源细小病毒的基因序列也可能代表了一种介于 CPV-2和 CPV-2a 之间进化中间状态的病毒,进一步的结论还需要对不同地区来源的更多毒株的长时间监测。
4 结 论
本研究应用CRFK细胞成功从果子狸肠道组织样品中分离到1株细小病毒,并命名为MPCPV-SX。经VP2基因和关键位点氨基酸序列分析表明其是介于CPV-2和CPV-2a 之间进化中间状态的病毒。
