源于中高温大曲的米根霉制备米曲工艺优化及应用
2022-10-20黄科屹卫春会黄治国石选超任志强
黄科屹 邓 杰,2 卫春会,2 黄治国,2 石选超,2 任志强,2
(1. 四川轻化工大学酿酒生物技术及应用四川省重点实验室,四川 宜宾 644000;2. 中国轻工业酿酒生物技术及智能制造重点实验室,四川 宜宾 644000)
浓香型白酒是近几个世纪以来最受欢迎的酒精饮料之一,是采用中高温大曲作为糖化发酵剂进行泥窖固态发酵、固态蒸馏、陈酿、勾调而成的[1-2]。糖化发酵是中高温大曲发酵生产浓香型白酒的一道重要工序,即淀粉水解为葡萄糖。其关键为中高温大曲中丰富多样的微生物(如霉菌、细菌等)分泌的糖化酶、淀粉酶、液化酶等各类水解酶系的相互作用[3-4]。糖化酶是发酵过程中淀粉转化为葡萄糖的重要酶系之一,通常分布在米曲霉、根霉、黑曲霉等霉菌微生物中[5-7]。张杰等[8]从中温大曲中筛选出一株高产糖化酶的霉菌Mxzd-001并制备成霉菌麸曲,优化麸曲工艺后麸曲糖化酶活力为1 032 U/g;将该麸曲应用至浓香型白酒酿造生产中,平均可提高出酒率4.9%左右。宋克伟等[9]从清香型大曲中筛选出一株高产糖化酶的米根霉9#,并添加至牛栏山清香大曲白酒的酿造环境中,提高了优质酒的出酒率。大曲白酒相较于小曲白酒具有醇香浓郁、回味悠长的特点[10-11],但也存在出酒率低、成本高的缺陷,这与大曲白酒体系中的糖化酶活力较小曲白酒体系低下具有一定的相关性。因此以添加高产糖化酶的微生物强化剂为试验组,探究高产糖化酶的微生物强化剂对大曲白酒出酒率的影响,对大曲白酒的出酒率提升具有重要意义。
研究拟从中高温大曲中分离出10株根霉并选出产糖化酶活力最高的一株,通过形态学鉴定方法以及分子生物学鉴定方法确定该根霉至种水平。将该根霉制作成米曲,从制曲原料、培养时间、加水量、干燥温度4个条件优化根霉米曲的糖化酶活力,并将优化后的米曲作为微生物强化剂添加至中高温大曲的酿造环境中,以期提高大曲白酒的出酒率。
1 材料与方法
1.1 材料与试剂
中高温大曲:取自川南某浓香型酒厂,4 ℃冰箱贮藏用于筛选根霉菌;
蛋白酶K、DNA琼脂糖凝胶回收试剂盒:日本Takara公司;
可溶性淀粉培养基、马铃薯葡萄糖琼脂培养基:广东环凯微生物科技有限公司。
1.2 仪器和设备
显微镜:DM3000型,德国Leica公司;
高速冷冻离心机:5430R型,德国Eppendorf公司;
PCR仪:C1000Touch型,美国Bio-Rad公司;
酒精度测试仪:Super Alcoma型,德国Julabo公司。
1.3 菌株的筛选及鉴定
1.3.1 霉菌的分离纯化 称取10 g大曲样品,经研钵研磨后(无菌条件下)加90 mL蒸馏水,150 r/min振荡30 min,取上清液,得到10-1的稀释液,依次稀释至10-2~10-6,使用PDA固体培养基进行平板涂布培养,挑取少量各霉菌孢子点接入PDA斜面培养基,低温保存[12]。
1.3.2 形态学鉴定 将纯化菌株点植入选择培养基,30 ℃ 恒温培养72 h后,滴入3 mL碘液并使碘液均匀铺满整个平板。检测透明圈直径D,菌落直径d,计算D/d值,选择D/d值最大的菌株作为出发菌株;将纯化菌株点植入PDA固体培养基,28 ℃恒温培养72 h,观察菌落形态,挑取菌丝,染色后于显微镜下观察菌株形态特征,对菌株进行形态学鉴定[13]。
1.3.3 分子生物学鉴定 采用真菌基因组DNA试剂盒提取M-1菌株的DNA,以ITS1:5′-TCCGTAG-GTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATT-GATATGC-3′为引物扩增ITS序列。PCR反应体系:引物ITS1、ITS4各1 μL;模板(基因组)0.5 μL;Taq PCR Master Mix 25 μL;超纯水22.5 μL;PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s;55 ℃退火30 s;72 ℃延伸45 s;循环30次;72 ℃总延伸10 min。用DNA琼脂糖凝胶回收试剂盒回收扩增出的糖化酶基因产物并送至上海生物工程公司测序,测序结果于NCBI数据库比较分析,利用MEGA7.0软件构建发育树。
1.3.4 酒精度、糖化酶活力测定方法
(1) 霉菌米曲糖化酶活力:参照QB/T 4257—2011《酿酒大曲通用分析方法》。
(2) 酒精度:参照QB/T 4257—2011《酿酒大曲通用分析方法》。
1.4 米曲的制作及应用
1.4.1 米曲制作工艺
(1) 纯种霉菌麸曲的制作:称取50.0 g麸皮加入50 mL 去离子水,充分搅拌,121 ℃灭菌20 min,冷却。向无菌麸皮接种5×106的孢子悬浮液(用无菌水将试管斜面上的霉菌孢子洗下,150 r/min振荡10 min,25×16型血球计数板计数),28 ℃培养5 d。控温烘干,贮藏,制得霉菌的一级扩大培养产物——霉菌麸曲。
(2) 霉菌的二级扩大培养产物——纯种霉菌米曲的制作:工艺流程见图1[14]。以糖化酶活力为指标,考察m麸皮∶m米粉、培养时间、米曲含水量和干燥温度对米曲糖化酶活力的影响。

图1 纯种霉菌米曲工艺流程图
1.4.2 米曲在大曲白酒酿造中的应用 将米曲应用至中高温大曲酿造中,以添加米曲为试验组,等质量的米粉、麸皮的混合物为对照组(见表1),探究米曲对固态酿造出酒率的影响[15]。

表1 酿造用曲配比表(100 g粮食计)
综合考虑生产成本、出酒率来选定酿造用曲,随后扩大酿造规模进行验证实验。如图2所示,以100 kg粳高粱为原料,M-1米曲2 kg,大曲20 kg,放入发酵罐中发酵60 d,待发酵完成后取出糟醅蒸酒,测定出酒率。

图2 固态发酵酿造工艺图
1.5 数据处理
试验数据用“平均值±标准差”表示,运用SPSS 16.0软件对试验结果进行多重比较和显著性分析,每组试验重复3次。
2 结果与分析
2.1 菌株筛选及鉴定
由表1可知,从中高温大曲中共筛选出10株根霉,将D/d最高的菌株M-1作为米曲的出发菌株[16]。

表2 高产糖化酶菌株筛选结果
将菌株M-1接入PDA固体培养基中,发现菌落呈白色,孢子多为黑色,菌丝密集,呈网状,生长迅速。镜检下观察到菌落孢子梗不分枝,从假根处长出。由图3可知菌株M-1的rDNA-ITS序列基因片段全长约850 bp,其序列与RhizopusoryzaestrainFSU 6160的同源性达99.75%,与米根霉菌株(Rhizopusoryzae)(序列号EU484234.1)相似度为100%。
综合形态学鉴定和分子生物学结果,将M-1菌株鉴定为接合菌纲(Zygomycetes)、毛霉目(Mucorales)、毛霉科(Mucoraceae)、根霉属(Rhizopus)、米根霉(Rhizopusoryzae)。Xiang等[16]将印度毛霉(MucorindicusXH025)与米根霉(RhizopusoryzaeXH028)应用至米酒酿造中,获得的米酒相较于工业规模生产的米酒香气更浓郁、口感更和谐[17];米根霉能产生2-甲基-1-丁醇、3-甲基-1-丁醇等挥发性化合物,因此也常被用于米酒及黄酒酿造中[18-19]。米根霉M-1来源于中高温大曲,具有制备成适于大曲白酒酿造的微生物强化剂的潜能。

图3 菌株的筛选与鉴定
2.2 制曲条件优化
2.2.1 制作M-1米曲条件优化 糖化酶是参与淀粉转化为葡萄糖的关键酶系之一[20]。添加麸皮可以提高原料的疏松度,有利于微生物的生长繁殖。但麸皮也会给酒体带来杂味,影响酒质[21]。由图4(a)可知,随着麸皮的增加,该米曲的糖化酶活力呈先增后降的趋势,当m麸皮∶m米粉为2∶8时,糖化酶活力最高为861 U/g。随后糖化酶活力呈下降趋势,是因为增加麸皮的同时,米粉的含量相应减少,供微生物利用的营养物质也相应缩减。故最终确定m麸皮∶m米粉为2∶8。

字母不同表示差异显著(P<0.05)
由图4(b)可知,随着培养时间的延长,M-1米曲的糖化酶活力先迅速增加后缓慢下降。当培养时间为72 h时,微生物的代谢活动最为活跃,糖化酶活力也达到峰值,为863 U/g,显著高于72 h前的(P<0.05),72 h后糖化酶活力有所下降。考虑到培养时间过长容易滋生杂菌,确定培养时间为72 h。
水分是米曲培养阶段微生物生长繁殖的基本营养物质之一。含水量低容易引起曲药通气性差、氧气缺乏;含水量高容易延滞菌株的生长,生成孢子[22]。由图4(c)可知,随着米曲含水量的增加,糖化酶活力呈先上升后略微下降的趋势。当米曲含水量为45%时,糖化酶活力达到峰值858 U/g。考虑到含水量过高不仅需要更长的时间来干燥米曲,而且染菌的风险也会增加。故确定米曲含水量为45%。
为使M-1米曲具有较长的保质期,培育完成的米曲需进行干燥处理。由图4(d)可知,随着干燥温度的增加,米曲的糖化酶活力变化不明显。考虑到米曲的干燥时间与干燥温度呈负相关,从节约能源、时间的角度出发,确定干燥温度为40 ℃。
2.2.2 成品米曲检测 综合制曲条件优化结果,最终确定M-1米曲的制作工艺条件为m麸皮∶m米粉为2∶8,培养时间72 h,米曲含水量45%,干燥温度40 ℃。此条件下制作的米曲有利于米根霉M-1糖化酶活力的保持。
由表3可知,M-1成品米曲的酸度、淀粉、水分处于正常范围,糖化酶活力达864.50 U/g。相较于1#米曲(1 150 U/g)和M1米曲(1 246.9 U/g)的还存在差距[23-24]。然而米根霉M-1是直接从中高温大曲中筛选获得的,相较于原中高温大曲,M-1成品米曲的糖化酶活力提升显著(P<0.05),应用该米曲至大曲白酒酿造中能较好地发挥糖化性能。

表3 成品米曲的理化检测结果†
2.3 M-1米曲的应用
2.3.1 对大曲白酒出酒率的影响 由图5可知,随着M-1米曲的增加,大曲白酒的出酒率呈先快速上升后趋于平稳的趋势。酿造用曲配方为试验号2时,出酒率达43.17%,显著高于对照组(38.13%)。随后大曲白酒的出酒率变化不明显,说明添加该米曲能一定程度上提高大曲白酒的出酒率。从节约成本的角度考虑,选择粮食质量的2%为该米曲的添加量。

字母不同表示差异显著(P<0.05)
2.3.2 验证实验 为验证实验结果,将原料由5 kg扩大至100 kg,按图2的酿造工艺,以添加2 kg M-1米曲,20 kg 大曲为试验组;2 kg麸皮米粉(m麸皮∶m米粉为2∶8)混合的粮谷粉,20 kg大曲为对照组进行验证实验。
由图6可知,试验组的出酒率(44.61%)显著高于对照组(38.64%)(P<0.05),提高了5.91%,与图5的结果一致,证明了大曲白酒的出酒率与大曲体系的糖化酶活力呈正相关[25]。
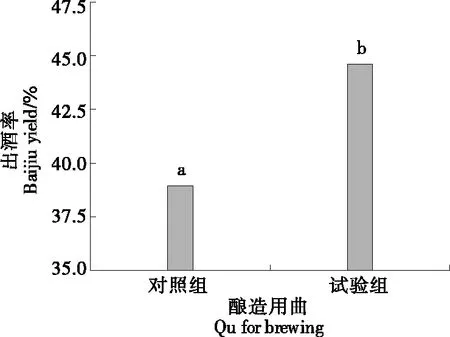
字母不同表示差异显著(P<0.05)
3 结论
从中高温大曲中筛选出一株产糖化酶能力较强的根霉M-1,通过形态学及分子生物学方法鉴定其为米根霉。
将该菌株制作成米曲,其糖化酶活力为864.50 U/g。添加米曲至大曲白酒酿造中,馏出酒的出酒率提升明显,说明出酒率与大曲体系的糖化酶活力呈正相关。米根霉M-1是从大曲中筛选获得的,应用该菌株制作的米曲(微生物强化剂)于大曲白酒的酿造中能更好的兼容,产糖化酶能力受环境的影响较小。然而该米曲对出酒率的提升存在限制性,其糖化酶活力尚未达到1 000 U/g,从中高温大曲中还能筛选出产糖化酶能力更强的微生物,应用该微生物的强化剂至大曲白酒酿造中,出酒率可能进一步提高。后续将从扩大试验规模、酒体风味等方向解决问题,以进一步完善理论支撑数据。
