冬小麦lncRNA1808调控PPP限速酶(Ta6PGDH)抗寒应答研究
2022-10-19李沅珊彭瞰看任治鹏徐庆华王军虹
李沅珊,彭瞰看,田 宇,任治鹏,苍 晶,徐庆华,王军虹
(东北农业大学生命科学学院,黑龙江哈尔滨 150030)
戊糖磷酸途径(pentose phosphate pathway,PPP)是植物中糖代谢的重要途径之一,其主要生理功能是产生还原性NADPH以及生成磷酸戊糖参与核酸代谢,该途径的中间产物参与脂肪酸和氨基酸等合成,其中6磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH,EC1.1.1.49)和6磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,6PGDH,EC1.1.1.44)为PPP限速酶。目前,已经分离了一些植物胞质或质体G6PDH、6PGDH的cDNA克隆,为分子水平解析PPP及G6PDH和6PGDH提供了研究材料。研究表明,PPP与植物的生长发育和应答多种环境胁迫有关。“寒富”苹果腋花芽处于-30 ℃以下低温时,呼吸代谢中PPP所占比例增多(即PPP活性增强),而顶花芽在-25 ℃以下低温时,PPP活性逐渐减弱;随低温处理时间延长,东方百合鳞片PPP被激活,G6PDH活性先减弱后增强。
长链非编码RNA(long noncoding RNA,lncRNA)是一种长度大于200个核苷酸的非编码RNA,根据其在基因组上的位置分为三类:内含子长链非编码RNA(intronic long noncoding RNA)、天然反向转录本(natural antisense transcript, NAT)和基因间长链非编码RNA(long intergenetic noncoding RNA,lincRNA)。由于lncRNA不具有明显编码序列(coding sequence,CDS),所以没有编码蛋白质的能力。目前已经在玉米、胡杨和小麦中鉴定出许多lncRNAs。研究表明,lncRNAs作为功能调控元件是真核生物基因表达调控的重要调控元件,并参与逆境响应过程。例如;甘蓝中的lncRNA(BoNR8)在非生物胁迫和ABA诱导下,在萌发种子根伸长区的表皮组织中大量表达;水稻的lncRNA(LAIR)使多个LRK基因上调表达,其高表达可提高水稻籽粒产量;植物开花途径中的关键调控基因FLC(flowering lous C)的mRNA转录受两个lncRNA(COOLAIR和COLDAIR)调控。目前有关lncRNA调控PPP关键酶基因表达及活性的研究未见报道。
小麦是人类主要粮食作物,低温(寒)胁迫严重影响小麦的生长和产量。东农冬麦1号(Dn1)是东北农业大学培育、能在黑龙江省高寒地区安全越冬的首个冬小麦品种,大田自然条件下,可耐-30 ℃低温,返青率高达85%,是耐寒研究的珍贵材料。前期研究发现,Dn1的Ta6PGDH积极响应寒胁迫,其活性和相应基因表达水平上调。高表达Ta6PGDH的拟南芥表现出更好的耐寒性,植株存活率升高、清除ROS能力增强、细胞质和过氧化物酶体中的PPP增强。已经构建了3个Dn1抗寒应答lncRNA库(5 ℃库、-10 ℃库和-25 ℃库),从中筛选出7 098个表达差异显著的抗寒应答lncRNAs,参与不同的代谢途径。但哪一条lncRNA调控Ta6PGDH还未可知。
基于以上结果,本研究应用生物信息学软件,从Dn1抗寒应答lncRNAs库中筛选调控PPP关键酶基因表达差异显著的lncRNAs,分析筛选出的lncRNAs与靶基因的互作共表达;用real-time PCR鉴定lncRNA及其靶基因协同共表达、应答寒胁迫的表达谱,初步解析lncRNA1808在PPP中应答寒胁迫的生物学功能,阐明lncRNA1808调控PPP限速酶(Ta6PGDH)的机制。
1 材料与方法
1.1 材 料
(1)东农冬麦1号(Dn1) 由东北农业大学小麦育种实验室提供。将Dn1种植于东北农业大学试验田(行长4 m;行距0.2 m;播种深度5 cm;每行播种50粒),田间常规水肥管理。大田自然降温条件下,连续10 d最低温度达5 ℃(2018年10月15日)、0 ℃(2018年11月02日)、-10 ℃(2018年11月23日)和-25 ℃(2019年01月14日)为取样时间点,随机选取长势一致的小麦苗,9:00-11:00间取样叶片和分蘖节,蒸馏水清洗、滤纸擦干后,剪成1 cm小段,锡纸包裹、液氮速冻后-80 ℃冰箱冻存。
(2)Dn1抗寒应答lncRNAs库 Dn1分蘖节抗寒应答lncRNAs库(对照组:5 ℃库;实验组:-10 ℃库和-25 ℃库),东北农业大学植物生理与分子生物学实验室建库。
1.2 方 法
1.2.1 调控PPP关键酶的表达差异显著lncRNAs的筛选及生物信息分析
以构建的3个Dn1抗寒应答lncRNAs库为研究对象,进行生物信息学分析及功能预测:(1)KEGG分析并筛选调控PPP关键酶的表达差异显著lncRNAs;(2)Cytoscop分析筛选出的lncRNAs及PPP关键酶互作关系,聚焦于lncRNA1808及Ta6PGDH;(3)ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)和CPC(http://cpc2.gao-lab.org/)在线软件分析lncRNA1808序列,验证其遗传功能;(4)RNAfoldWebSever在线软件(http://rna.tbi.univie.ac.at/cgi-bin/RNAWebSuite/RNAfold.cgi)预测lncRNA二级结构;(5)ProtParam在线软件(http://web.expasy.org/protparam/)预测Ta6PGDH的一级结构及理化性质,ProtScale在线软件(http://web.expasy.org/cgi-bin/protscale/protscale.pl)和SWISS-MODEL在线软件(https://swissmodel.expasy.org/interactive)预测Ta6PGDH的二、三级结构;(6)PlantCARE在线软件(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测lncRNA1808(TCONS-00021808)和Ta6PGDH(Traes1DLB4E0DFCC9)顺式作用元件;(7)Cytoscop绘制lncRNA1808-mRNA(Ta6PGDH)协同共表达的表达谱。
1.2.2 Real-time PCR鉴定lncRNA1808和Ta6PGDH应答寒胁迫的表达谱
用Trizol(康为世纪Ultrapure RNA Kit)方法提取Dn1叶片及分蘖节总RNA;反转录试剂盒(VazymeR233-01)合成cDNA第一链。
使用SYBR试剂盒(ChamQTM Universal SYBR qPCR Master Mix)、荧光定量PCR仪(MYCYCLER,美国 BIO-RAD)进行real-time PCR,小麦为内参基因,具体引物见表1。反应体系:2×ChamQTM Universal SYBR qPCR Master Mix 10 μL,cDNA模板 2 μL,上、下游引物各0.4 μL,ddHO 补足至20 μL),反应程序:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 34 s,40个循环;4 ℃∞。采用2法计算基因相对表达量。

表1 PCR所用引物
1.2.3 同源克隆lncRNA1808序列全长
采用CTAB法提取Dn1分蘖节的基因组DNA,用RNase(康为世纪生物科技有限公司)纯化DNA样品。
用Primer Premier 6.0设计特异性引物(表1):上游引物为lncRNA1808-F,5′端插入GGCTTAAU(PacI酶切位点)特定序列;下游引物为lncRNA1808-R,5′端插入GGTTTAAU(PacI酶切位点)特定序列;合成引物(博仕生物)。
以提取的总DNA为模板,以lncRNA1808-F/lncRNA1808-R为特异性引物,使用2×Taq Plus MasterMix(Dye)Kit(康为世纪生物科技有限公司)进行PCR扩增,回收PCR扩增的特异性片段,插入pClone007载体,转化于大肠杆菌DH5α,获得阳性菌株(pClone 007-lncRNA1808)经鉴定后,送生化公司测序并鉴定。
1.2.4 构建过表达lncRNA1808载体
将鉴定序列正确的pClone007-lncRNA1808质粒经USERTM酶切消化后,回收lncRNA1808特异性片段,插入经和双酶切的pCAMBIA230035Su线性载体,连接液转化于大肠杆菌DH5α,经鉴定后,获得含过表达载体pCAMBIA230035sU-lncRNA1808的阳性菌株,送生化公司测序并鉴定。
1.3 数据处理
试验所有数据均进行3次生物学重复,图表制作由SPSS 22软件完成,用Prism 6.0进行显著性分析。
2 结果与分析
2.1 lncRNA1808的功能预测及鉴定
2.1.1 鉴定TCONS-00021808(lncRNA1808)的编码潜能
TCONS-00021808的序列全长495 bp,位于小麦 1D染色体444 147 161~444 147 655 bp处,命名其为lncRNA1808。用ORF finder在线软件分析lncRNA1808序列全长发现,lncRNA1808潜在最长ORF为85个氨基酸,最短ORF为25个氨基酸(表2)。将上述预测的短ORF经NCBI Blastp在线软件比对后未找到有效的匹配,说明潜在编码的ORF未知或不存在;用CPC在线软件分析lncRNA1808序列全长后得知,其编码能力得分为0.043 954 2,是不完整性ORF,属于非编码类型,不具备编码能力(图1)。综上,确定TCONS-00021808为lncRNA,将其命名为lncRNA1808。
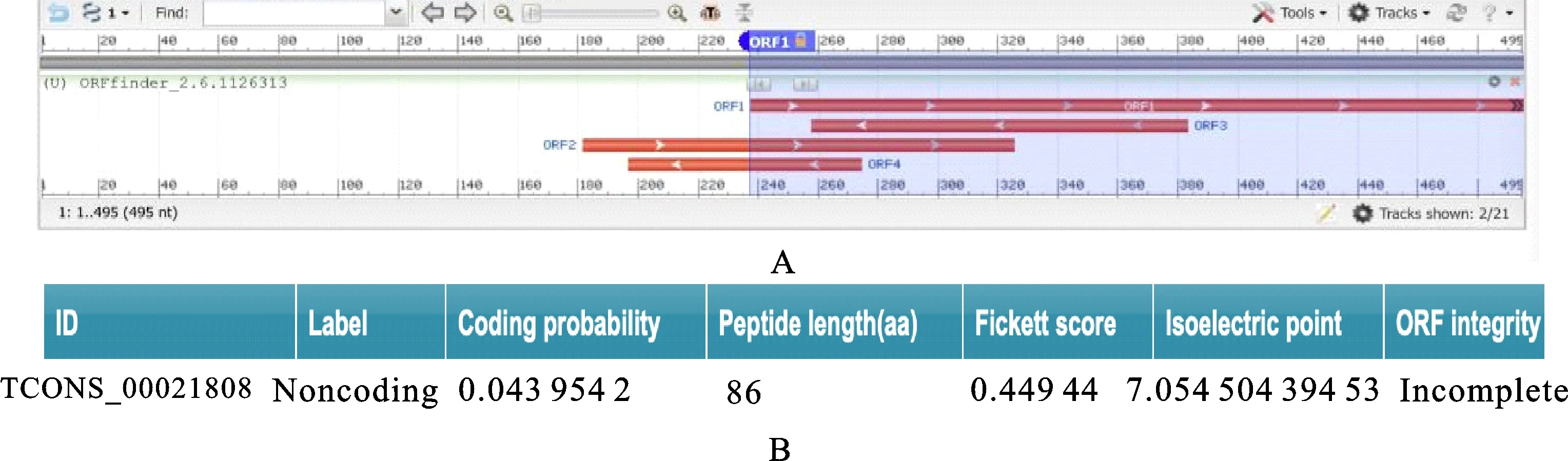
A:Blastp分析结果;B:CPC分析结果。

表2 ORF finder分析lncRNA1808的ORF
2.1.2 lncRNA1808二级结构
应用RNAfold在线软件预测lncRNA1808的最小自由能(minimum free energy,MFE)结构,lncRNA1808的最佳二级结构的MFE为-55.80 kcal·mol;富含稳定的茎环结构,且“大环”较多(图2)。茎环结构在RNA与RBPs(RNA结合蛋白)互作中发挥重要作用。推测,lncRNA1808在调控靶基因表达的过程中,可能通过“大环”结合某些RBPs与“lncRNA-靶基因”共同形成复合物,在Dn1应答寒胁迫中发挥重要作用,具体作用机制有待进一步研究。lncRNA1808二级结构的预测,为解析其生物学功能和揭示其参与的调控机制提供重要理论 依据。
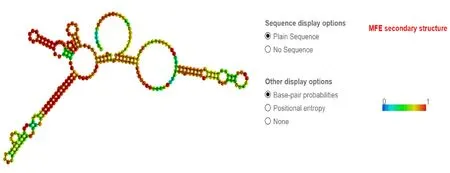
图2 lncRNA1808最佳二级结构预测图
2.1.3 lncRNA1808靶基因预测及鉴定
从已构建的3个lncRNAs库(5 ℃库、-10 ℃库和-25 ℃库)中共检测到7 098个抗寒应答lncRNAs,通过KEGG分析筛选到20条lncRNAs调控PPP关键酶基因的表达差异显著(表3)。通过Cytoscape软件预测并绘制lncRNA1808-靶mRNA(Ta6PGDH)互作关系如图3。初步确定:Ta6PGDH是lncRNA1808的靶基因。

表3 KEGG分析差异表达lncRNA1808及其靶基因(PPP关键酶)
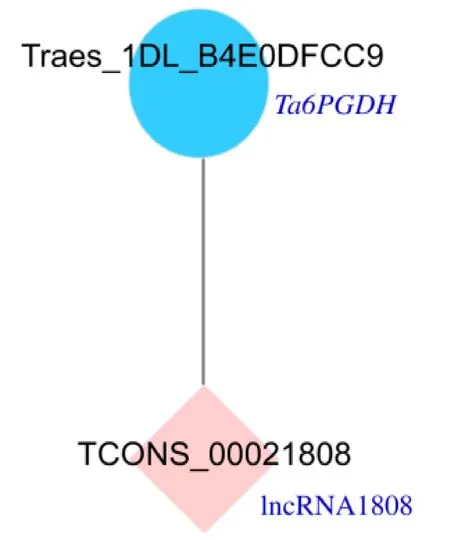
粉色:lncRNA;蓝色:靶基因。
2.1.4 lncRNA1808-靶基因互作对分析
鉴于lncRNA的调控模式中,存在lncRNA与邻近基因协同表达或调控其表达的模式,应用Cytoscape软件分析lncRNA1808及其上下游100 kb的mRNA进行blast比对。结果表明,lncRNA1808与18个靶mRNA是共表达的互作对,包括11个正相关和7个负相关。lncRNA1808和mRNA(Ta6PGDH)为自由能小于-30的互作对(identity>95%; E value<1E-5),lncRNA1808-mRNA(Ta6PGDH)正向共表达,同时mRNA(Ta6PGDH)间接通过lncRNA9163(TCONS_00199163)和lncRNA6323(TCONS_00226323)调控其靶mRNA——焦磷酸依赖性磷酸果糖激酶(pyrophosphate dependent phosphofructokinase,PPi-PFK,EC.2.7.2.90)的正表达(图4)。
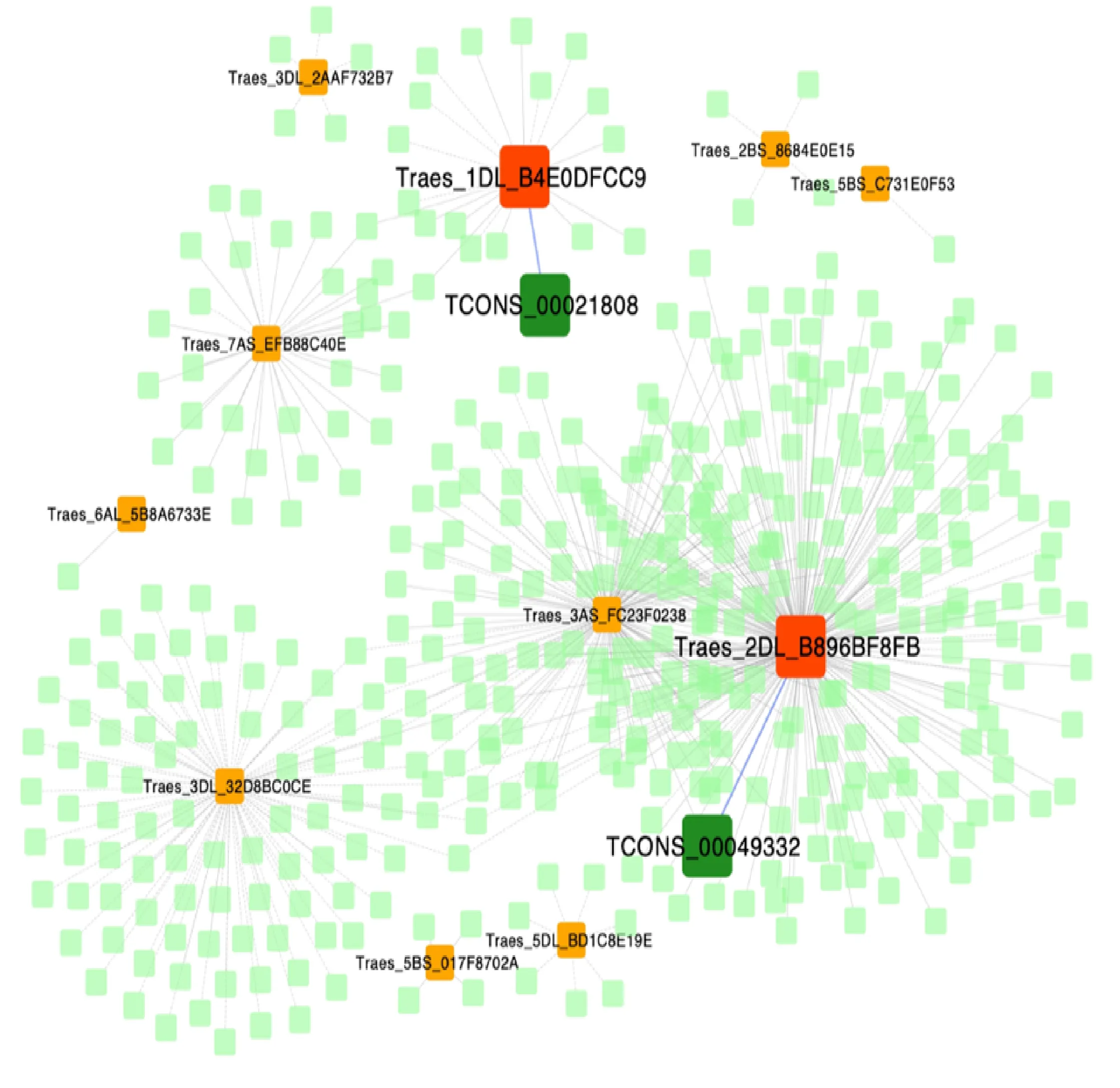
橙色和红色方块:mRNA;深和浅绿色:lncRNA;蓝色实线:lncRNA和mRNA正相关;蓝色虚线:lncRNA和mRNA负相关。
2.1.5 Ta6PGDH和lncRAN1808顺式作用元件分析及功能预测
顺式作用元件(cis-acting element)存在于基因旁侧序列中,影响基因的表达。顺式作用元件包括启动子、增强子、调控序列和可诱导元件等,参与基因表达的调控。应用Plant CARE在线软件自转录起始位点上游1.5 kb开始分析Ta6PGDH和lncRNA1808的顺式作用元件,分析结果见表4和5。发现两个目的基因共同含有的顺式作用元件包括:核心启动子元件(CAAT-box、TATA-box)、响应环境因子元件(ARE、MBS)、光响应元件(Box-4)和植物激素响应元件(ABRE、AuxRR-core)。其中,CAAT-box和TATA-box是转录真核基因启动子序列中转录因子的结合位点,CAAT-box是参与转录RNA基因的转录因子结合位点,参与RNA转录水平的调控;在调节胭脂碱合酶启动子中起重要作用;TATA-box是参与转录组蛋白或转录因子基因的转录因子结合位点。Ta6PGDH和lncRNA1808序列中均预测出这些元件,说明它们的表达在转录水平被调控。ABRE是ABA响应元件,AuxRR-core是AUX响应元件,可见Ta6PGDH和lncRNA1808的表达被ABA和AUX信号通路调控。Box-4是光响应元件,可见Ta6PGDH和lncRNA1808不但受温度的调控也受到光的调控。Dn1的Ta6PGDH和lncRNA1808应答寒胁迫的过程是细胞内激素、光照、温度、水分等综合因素调控的过程,具体调控机制有待进一步探究。
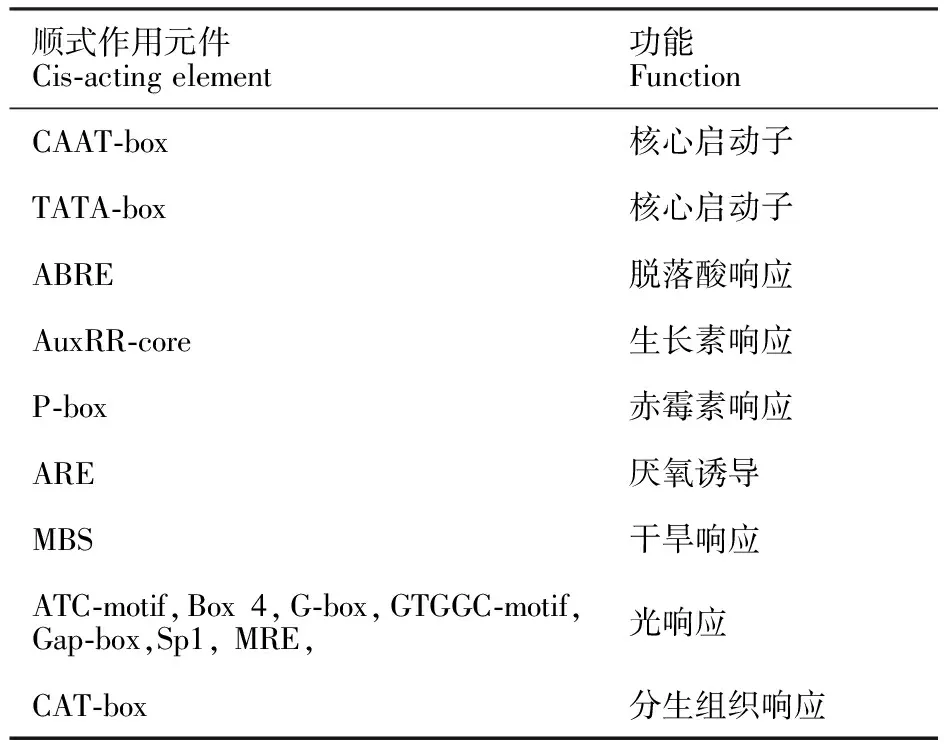
表4 Ta6PGDH基因启动子元件
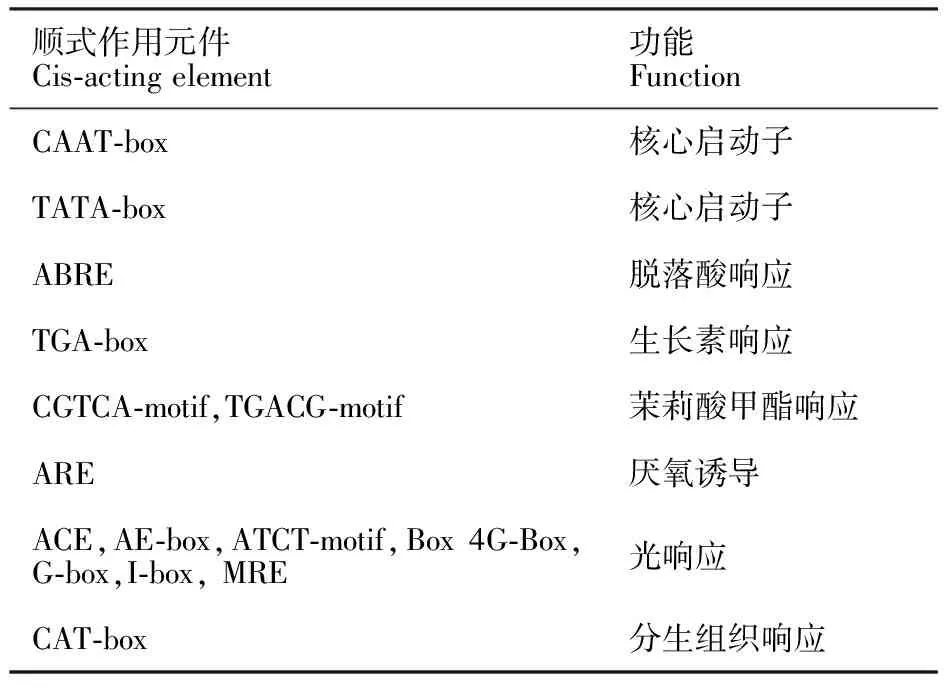
表5 lncRNA1808启动子元件
2.2 Ta6PGDH的理化性质、蛋白结构及亲疏水性预测
小麦的CDS长592 bp,编码178个氨基酸(图5)。采用ProtParam在线网站分析其理化性质表明,Ta6PGDH蛋白半衰期30 h;脂肪族指数89.89;有18个负电荷的氨基酸残基,包含8个天冬氨酸(Asp)和10个谷氨酸(Glu);有28个正电荷氨基酸残基,包含19个精氨酸(Arg)和9个赖氨酸(Lys);不稳定指数(II)24.52,是一种稳定蛋白,稳定性相对较好;平均亲水系数-0.278,为亲水蛋白;等电点9.67,为碱性蛋白;相对分子质量为20 351.52 Da,氨基酸化学式是CHNOS。氨基酸组成中含量最高的是精氨酸(Arg),占10.7%,含量最低的是组氨酸(His),占1.1%。

图5 Ta6PGDH的氨基酸序列
借助HNN方法分析的二级结构,结果显示,共含有105个α-螺旋(58.99%)、11个延伸链(6.18%)、9个 β-转角(5.06%)、53个无规卷曲(29.78%),证明其二级结构为混合型(图6)。采用SWISS-MODEL进行同源建模(PyMOL视图),得到的三级结构模型如图7,其中螺旋部位代表螺旋,箭头部位代表折叠,线型部位代表无规则卷曲,从图7可以看出,α-螺旋、无规则卷曲为主要的结构原件,占据了很大一部分空间。ProtScale分析(图8)表明,小麦6PGDH氨基酸残基整体表现为亲水性,与理化性质分析结果一致,因此推测其为亲水性蛋白。
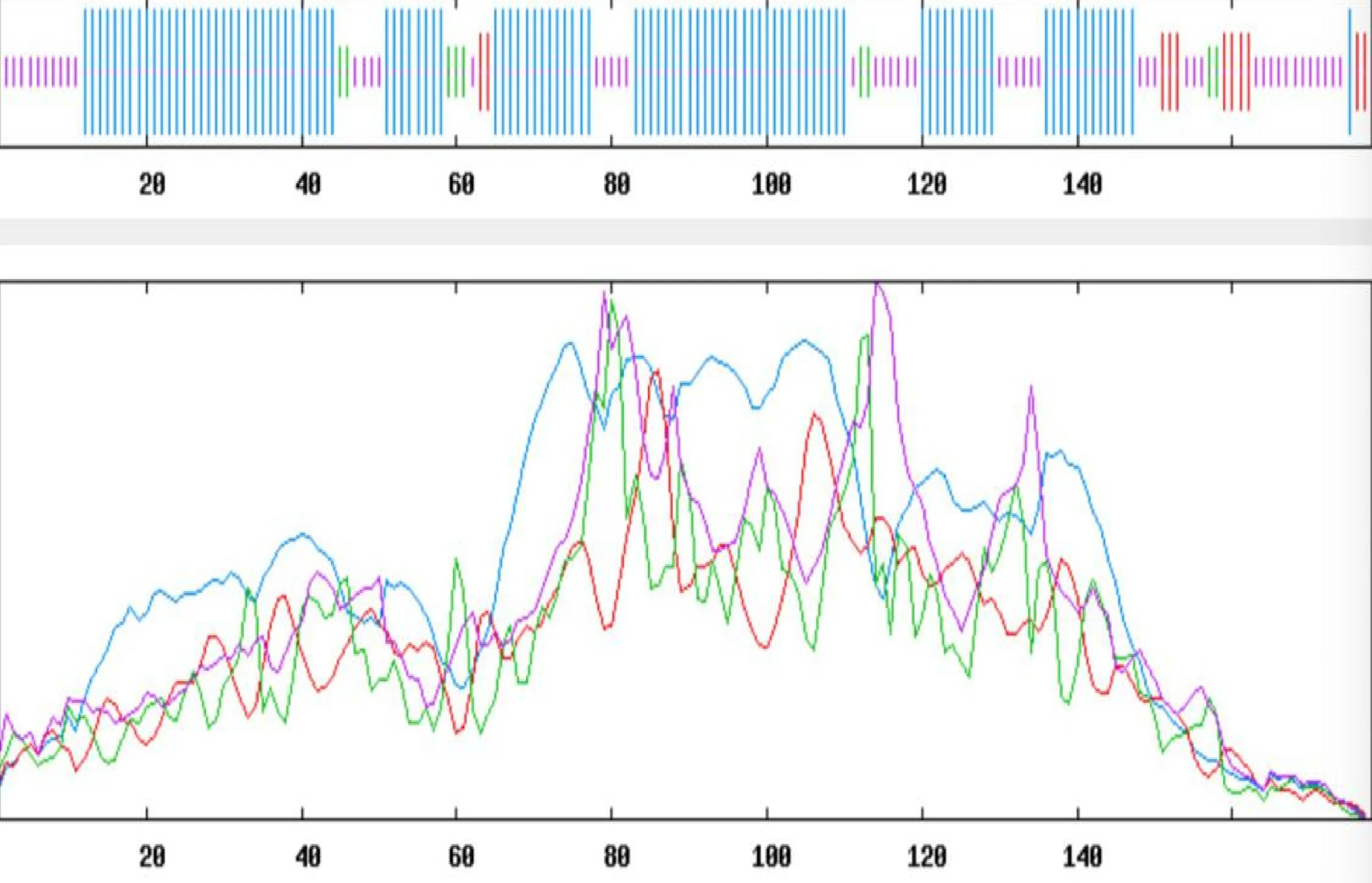
Ta6PGDH蛋白二级结构分析。蓝线为α-螺旋,红线为延伸链,绿线为 β-转角,粉线为无规卷曲。
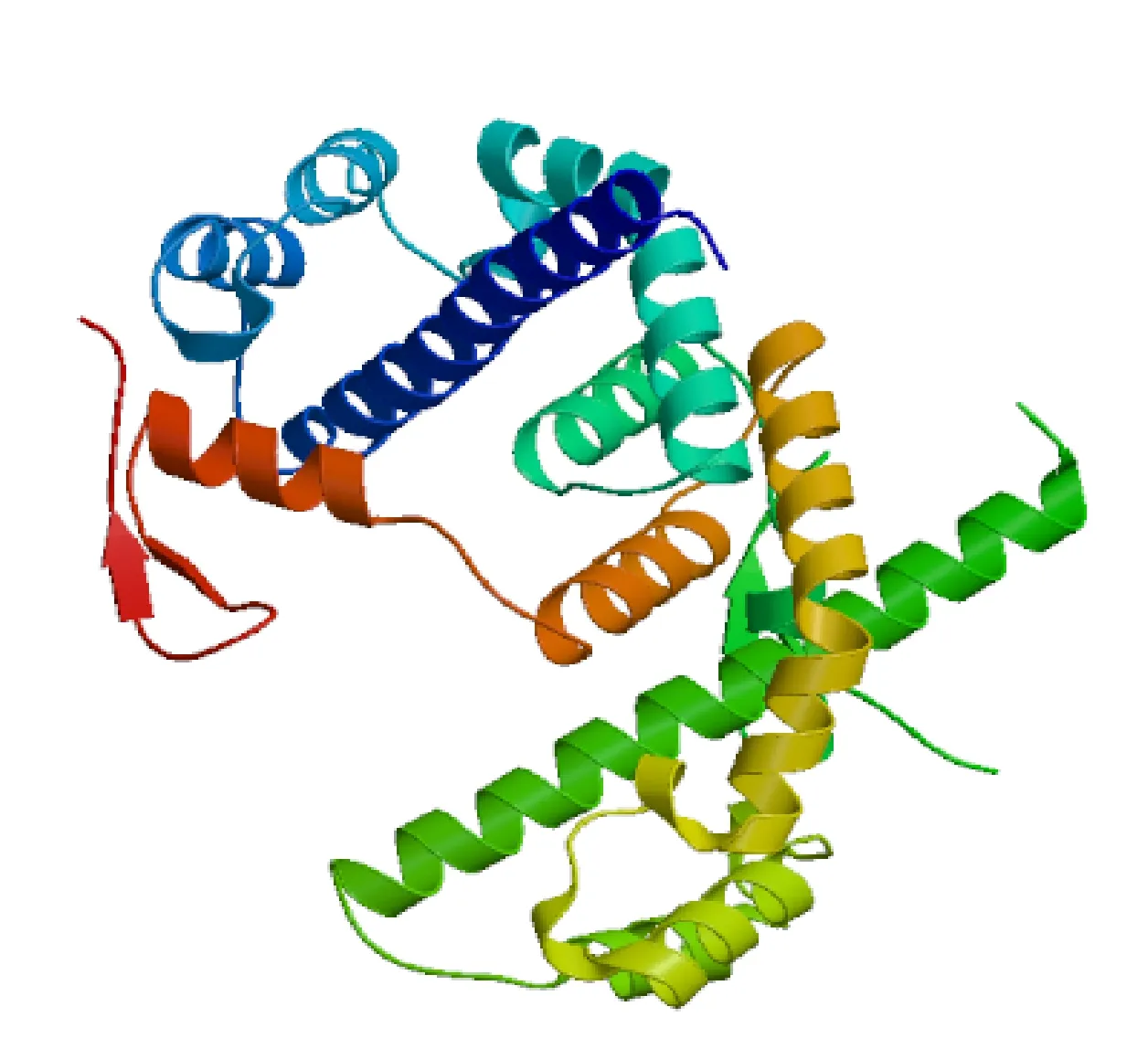
图7 Ta6PGDH的三级结构
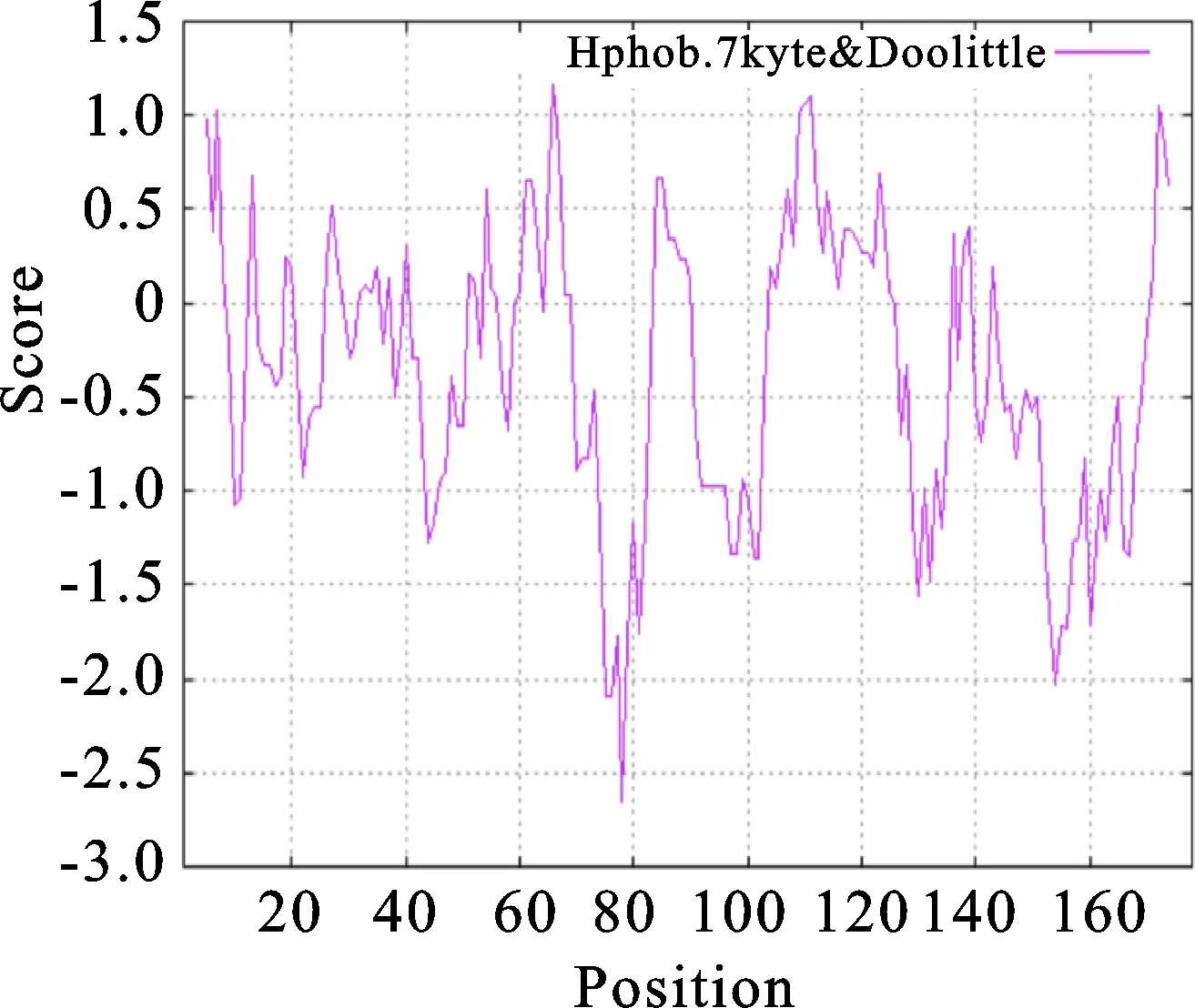
分数的正、负分别代表疏、亲水性。
2.3 lncRNA1808-mRNA(Ta6PGDH)表达谱
由图9可见,在分蘖节中,随着温度降低,lncRNA1808的表达量呈先降低后升高的变化规律,0 ℃时相对表达量最低,而后显著升高,-25 ℃时达到峰值。lncRNA1808的靶基因的相对表达量也随温度降低而呈先降低后升高的变化规律,-10 ℃时相对表达量最低,-25 ℃时达到峰值。说明lncRNA1808对靶基因为正向调控。

图柱上不同字母表示差异显著(P<0.05)。图10同。
由图10可见,在叶片中,从整体上看lncRNA1808的相对表达量随着温度的降低呈持续降低的趋势,-25 ℃时降到最低,但各温度间差异不显著。靶基因的表达量在0 ℃时达到峰值,随后显著下降,-25 ℃时表达量趋近于0。推测PPP中lncRNA1808正向调控靶基因主要在分蘖节中发挥抗寒作用。
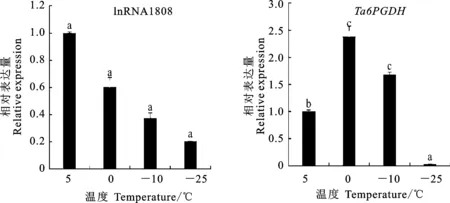
图10 Dn1叶片中lncRNA1808和 Ta6PGDH不同温度下的相对表达量
2.4 lncRNA1808全长克隆及过表达载体构建
用lncRNA1808-F/lncRNA1808-R(表1)进行PCR,扩增lncRNA1808,产物经琼脂糖凝胶电泳检测得到约495 bp的特异性条带(图11),与预期目的条带大小一致。目的条带回收后进行载体连接(图12),转入大肠杆菌DH5α,阳性菌株(pClone 007-lncRNA1808),送测序(睿博兴科)并与小麦数据库中基因序列比对后,确定获得lncRNA1808全长(图13)。
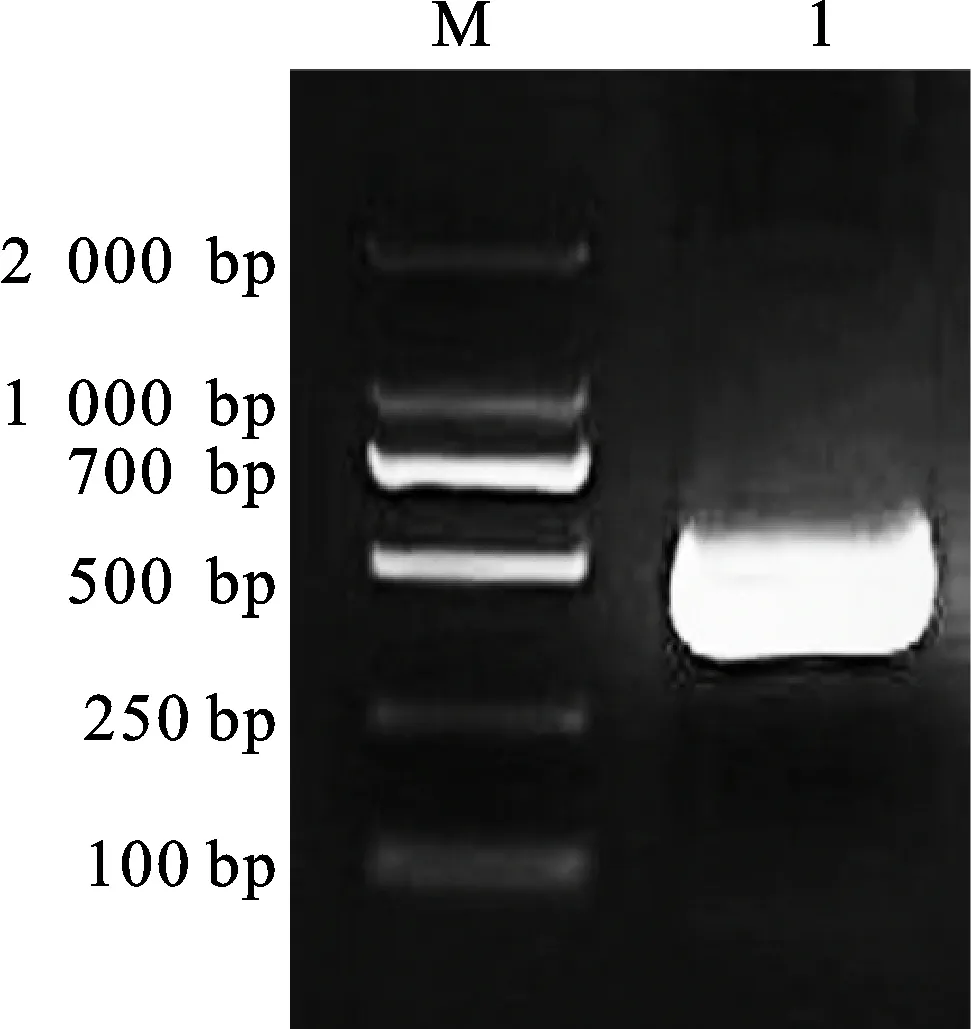
M:2 000 bp DNA marker; 1:PCR扩增产物。
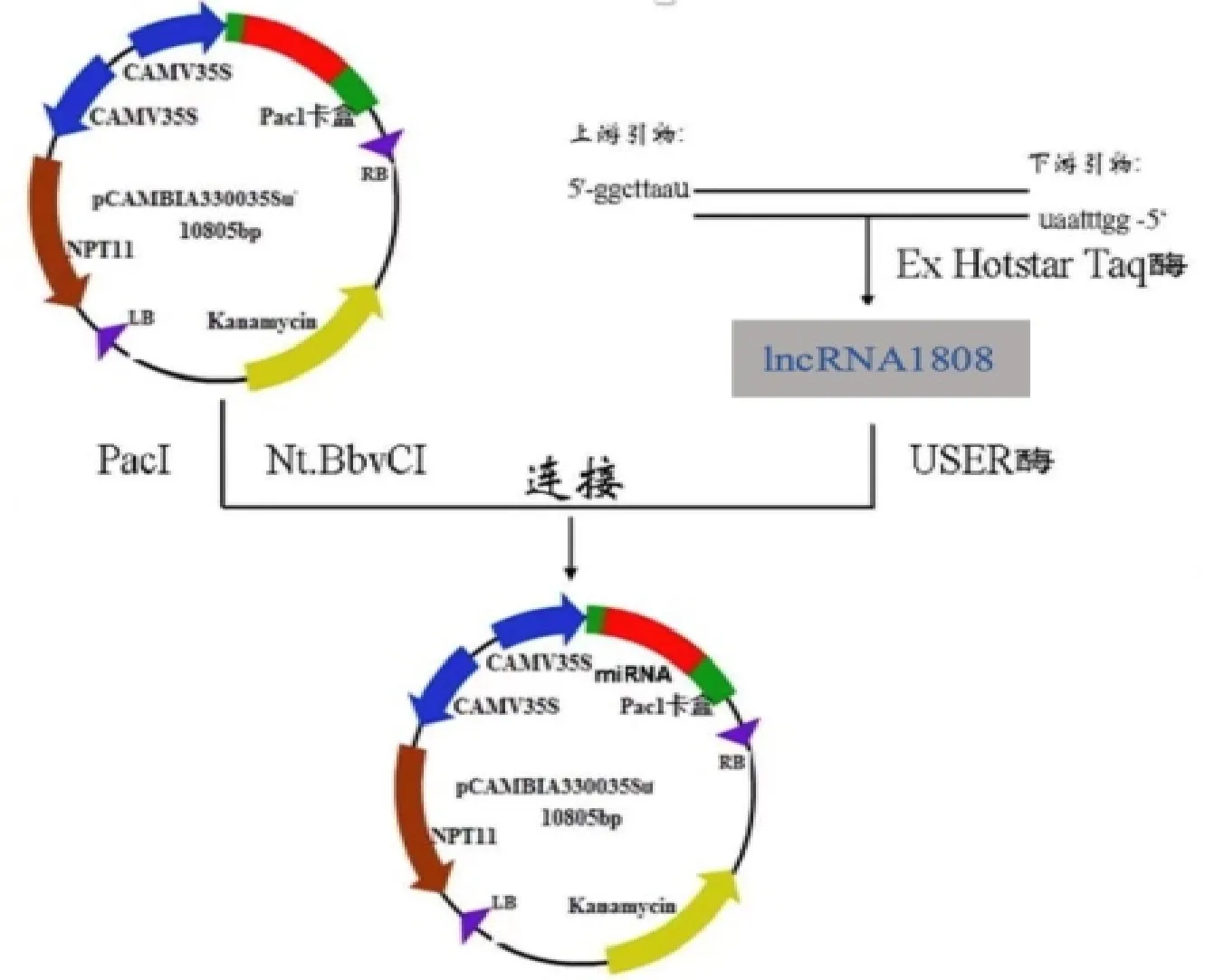
图12 lncRNA1808重组质粒示意图

图13 特异性片段序列与小麦基因组比对
3 讨 论
近些年,糖代谢途径在植物低温胁迫中的反应备受关注。相关研究表明,植物的生长发育和各种非生物胁迫都与PPP有紧密的联系,在寒胁迫下植物中的可溶性糖含量发生变化,其糖代谢相关酶的活性同时受到影响;植物幼苗受低温驯化时PPP效率提高,能增强植物的抗性。目前,对于PPP功能的研究主要是围绕6-磷酸葡萄糖酸脱氢酶(6-phosphate dehydrogenase,6PGDH,EC1.1.1.44)、6-磷酸葡萄糖内酯酶(6-phosphogluconolactonase,PGL,EC:3.1.1.31)和葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH/G6PD,EC:1.1.1.49)等有关酶展开。
从PPP代谢途径相关的酶入手,通过KEGG分析筛选出能够调控PPP关键酶基因表达的lncRNA,经多种网络途径比对,筛选出共同作用的酶有:果糖-二磷酸醛缩酶、6-磷酸果糖激酶(PFK)、葡萄糖-6磷酸异构酶(G6PI)和6-磷酸葡萄糖脱氢酶(6PGDH)。6PGDH是PPP的与第二个脱氢酶,因为它在大多数生物中是单向的,被认为是氧化戊糖磷酸途径中的关键步骤之一。近几年已分别从水稻、拟南芥、金针菇等生物中克隆到该基因并进行了功能研究。例如:在盐胁迫下,水稻中的6PGDH在芽中上调,其有可能在盐胁迫中起重要作用;6PGDH在苹果果肉中表达量较高,且有助于愈伤组织的生长。本研究结果表明,对Dn1分蘖节抗寒有着重要作用,5 ℃、0 ℃和-10 ℃时,其分蘖节中的表达量逐渐降低;-25 ℃时,相对表达量急速升高,推测会使PPP增强,为植物生物合成提供原料和专一性供体,确保ATP的生成和利用。其代谢终产物6-磷酸葡萄糖的积累也会增强细胞渗透压,并增强细胞抵御寒胁迫的伤害。
lncRNA在植物生长和胁迫响应中起关键的调控作用,如花椒的干旱胁迫、大麦的低氮胁迫和木薯的低温胁迫。相关研究表明,lncRNA响应干旱胁迫,参与线粒体和叶绿体膜稳定性的调节,有助于维持光合作用和呼吸的正常运行。本研究从Dn1寒胁迫相关的lncRNA1808入手,以PPP为背景,通过生物信息学分析确定lncRNA1808的ORF具有不完整性,不具备编码能力,属于非编码RNA。共表达分析发现,经blast比对与RNAplex计算,确定结合自由能小于-30的lncRNA1808和lncRNA9332是PPP的正向调控因子,而lncRNA1808对调控限速酶Ta6PGDH发挥着至关重要的作用。当Dn1受到低温胁迫时,叶片中的lncRNA1808的相对表达量在各温度间差异不显著,且与不存在正向调控关系,说明调控模式关系有组织差异性,推测其与启动子顺式作用元件中包含分生组织表达的CAT-box元件有关。分蘖节中的lncRNA1808因响应低温环境表达量呈先降后升趋势,它的升高增加了靶基因的表达量,同时增强PPP代谢途径,从而为Dn1提供能量及代谢产物,增强其抗寒性。
综上,低温下Dn1的lncRNA1808可能正向调控其靶基因,进而介导PPP代谢途径响应低温胁迫。目前lncRNA1808介导Dn1抗寒的分子机制尚不清楚,但本研究成功克隆lncRNA1808并构建过表达载体,随后将进一步通过分析转基因株系在低温胁迫下的抗寒表型以及低温胁迫前后各项生理指标的变化初步确定了lncRNA1808的生物学功能,为从分子水平深入解析lncRNA调控冬小麦的抗寒应答机制提供研究材料和思路。
