牦牛角对LPS诱导发热大鼠模型的解热活性评价及机制研究
2022-10-18赵晶晶武文星朱昭颖刘睿宿树兰郭盛段金廒
赵晶晶,武文星,朱昭颖,刘睿,宿树兰,郭盛,段金廒
(南京中医药大学/江苏省中药资源产业化过程协同创新中心/中药资源产业化与方剂创新药物国家地方联合工程研究中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023)
发热是机体面对病原体入侵时产生的一种复杂的防御性反应,通常为在激活物的直接或间接作用下,通过中枢介质作用于体温调节中枢,在外周免疫系统和中枢共同作用下使机体产热增加,散热减少,调定点上移而引起调节性体温升高,并伴有功能和代谢改变的一种病理过程[1]。现代临床常用的解热药为对乙酰氨基酚、阿司匹林、布洛芬、安乃近等,解热药作为急诊常用药物,使用不当常会出现过敏反应、胃肠道出血、变性血红蛋白水平增加甚至损害肝肾功能等不良反应[2-4]。因此,有必要通过本草典籍等途径寻找更安全、有效且毒副作用小的退热药物。
《本草纲目》记载“牦牛角味酸、咸、凉,无毒;主治惊痫热毒,诸血病。”[5]藏医在临床用药方面常将牦牛角锉成粉配方用或单用块磨汁单服,治疗小孩与成人高热[6]。《高原中医药》则记载犀角地黄汤原方使用时牦牛角可替代犀角发挥清热凉血,定惊解毒之功[7]。由此可见牦牛角具有确切的解热活性,但牦牛角药材尚缺乏较为深入的功效学验证及作用机制研究。因此,本研究通过脂多糖(LPS)致发热大鼠的肛温变化以评价牦牛角解热活性,采用细胞因子表达及非靶向血浆代谢组探究其潜在的解热机制,以期阐明牦牛角解热的科学内涵,为牦牛角新资源药材开发提供证据。
1 材料
1.1 实验动物
SPF级SD雄性大鼠,体质量150~200 g。购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0011,饲养于南京中医药大学实验动物中心,室温保持在20~24 ℃,相对湿度为58%~62%,光照周期为12 h,自由进食饮水。所有动物实验方案均经南京中医药大学动物实验伦理委员会审查批准(许可号:202112A065)。
1.2 药材与试剂
牦牛角购自西藏市那曲镇罗布热地市场,经南京中医药大学段金廒教授鉴定为牛科动物牦牛BosgrunniensLinnaeus.的角。羚羊角粉购自南京同仁堂药业有限责任公司,批号:011201;阿司匹林肠溶片购自德国Bayer公司,批号:BJ56442;LPS购自Sigma公司,批号12190801;乌来糖购自上海源叶生物科技有限公司,批号:S11036;氯化钠注射液购自辰欣药业股份有限公司,批号:2101080725;羧甲基纤维素钠购自国药集团化学试剂有限公司,批号:20191203;肿瘤坏死因子-α(TNF-α)试剂盒、白介素-1β(IL-1β)试剂盒、环磷酸腺苷(cAMP)试剂盒与前列腺素E2(PGE2)试剂盒均购自南京建成生物工程研究所,批号:20220510;乙腈、甲醇(色谱纯)购自德国Merk公司;甲酸(色谱纯)购自美国ACS公司,批号:C11901830;亮氨酸脑啡肽购自美国Waters公司。
1.3 仪器
Waters ACQUITY UHPLC系统(包括四元泵溶剂系统,在线脱气机和自动进样器,英国Waters)、Waters SYNAPT G2-Si质谱仪(英国Waters)、MassLynx质谱工作站(英国Waters)、Milli-Q Advantage超纯水系统(美国Millipore)、ML204精密分析天平(瑞士Mettler Toledo)、Tissuelyser-48全自动样品快速研磨仪、Microfuge 22R高速冷冻离心机(美国Beckman Coulter)、EnSpire多功能酶标仪(美国PerkinElmer)、ST60-4微孔板恒温振荡器(杭州米欧)、MV-100涡旋混匀仪(武汉塞维尔)、YT308医用电子体温计(江苏鱼跃)。
2 方法
2.1 药液制备
牦牛角去除骨塞后,经南京理工大学国家特种超细粉体工程技术研究中心加工粉碎为400目超微粉。临用前用0.2%CMC-Na溶液配成一定浓度的混悬液。羚羊角粉与阿司匹林肠溶片供试品药液制备方法同上。
2.2 实验动物造模、分组及给药
实验动物适应性喂养3 d,实验前3天每日早晚各1次对大鼠进行适应测体温操作,实验前10 h禁食不禁水,实验当日致热前连续测体温3次,以其平均值作为基础体温,淘汰基础体温>38 ℃且体温波动>0.5 ℃的大鼠。取8只体温合格大鼠腹腔注射(10 mL·kg-1)0.9%氯化钠注射液,作为空白组;其余大鼠均等体积腹腔注射由0.9%氯化钠注射液现配的LPS溶液(80 μg·kg-1)建立发热模型。造模大鼠于造模6 h后重新测量体温,筛选40只发热幅度在0.7~1.7 ℃之间的大鼠,按照分层分组方法随机分为5组,每组8只,分别为模型组、阿司匹林组、羚羊角组、牦牛角低剂量组、牦牛角高剂量组,分组后立即灌胃给药。阿司匹林组按80 mg·kg-1剂量给予阿司匹林肠溶片混悬液灌胃(按人每日临床剂量0.016 g·kg-1折算),羚羊角组按0.05 g·kg-1剂量给予羚羊角粉混悬液(按人每日临床剂量0.01 g·kg-1折算),牦牛角低剂量组按0.625 g·kg-1剂量给予牦牛角粉混悬液(按人每日临床剂量0.125 g·kg-1折算),牦牛角高剂量组按1.25 g·kg-1剂量给予牦牛角粉混悬液(按人每日临床剂量0.25 g·kg-1折算),空白组与模型组同时灌胃等体积0.2%CMC-Na溶液。随后每隔30 min测量记录1次体温,连续监测4 h,计算各组大鼠在各监测点的体温增减值(ΔT,实测体温值-基础体温值)及体温反应指数(TRI,平均体温反应曲线与基线之间的面积),绘制体温反应曲线并分析解热效果[8]。
2.3 血清、血浆及下丘脑样本的采集
各组大鼠于最后一次测肛温后,腹腔注射20%乌来糖(8 mL·kg-1)进行麻醉,经腹主动脉取血,采用真空采血管及肝素钠采血管进行血液收集,全血放置2 h后,于4 ℃ 1 500×g离心15 min,吸取上清液于-80 ℃下冷冻保存。随后迅速取出全脑,预冷生理盐水溶液漂洗2~3次洗去血迹,冰上操作于视交叉与灰结节之间取下丘脑组织进行液氮速冻,后转移至-80 ℃冰箱保存待测[9]。
2.4 血清及下丘脑细胞因子测定
将下丘脑组织置于冰上解冻,准确称取组织质量。按质量体积比1 g∶9 mL的比例加入磷酸盐缓冲液(pH 7.2),用组织匀浆机将其匀浆充分,冰上静置30 min后,4 ℃ 1 000×g离心20 min,取上清,采用ELISA试剂盒按照说明书要求测定血清中TNF-α与IL-1β水平及下丘脑组织中cAMP与PGE2水平[9]。
2.5 血浆样品的代谢组学分析
2.5.1 样本处理 将冻存的血浆样本置于冰上解冻,各组分别取100 μL加入300 μL冷乙腈沉淀蛋白,涡旋混匀1 min,于4 ℃冰箱静置30 min后,以4 ℃ 19 000×g离心15 min,取上清,备用[10]。
将所有待测样本各取10 μL混合作为质控样本(QC)样本。进样前后及各组样品间均进1针QC样本,用于评估UPLC-Q-TOF-MS系统稳定性。
2.5.2 LC-MS条件 ACQUITY UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),流动相为0.1%甲酸水(A)-乙腈(B)。梯度洗脱条件:0~6 min,95%~55%A;6~13 min,55%~5%A;13~14 min,5%A。柱温40 ℃,流速0.4 mL·min-1,进样量2 μL[11]。
采用ESI离子源正、负离子模式(ESI+/ESl-),质量扫描范围m/z100~1 000;毛细管电压、锥孔电压分别为3.0 kV和30 V;萃取电压:2.0 V;离子源温度120 ℃,脱溶剂气温度为350 ℃;锥孔气流量:50 L·h-1;碰撞能量:20~50 eV,准确质量测定采用亮氨酸-脑啡肽(ESI+:m/z556.277 1,ESI-:m/z554.261 5)溶液为锁定质量溶液。
2.5.3 数据处理和多元分析 采用Progenesis QI(V2.4)进行峰对比、拾取、噪声去除、重叠峰解析、标准化、归一化等处理,分别输出正、负离子模式下由保留时间、质荷比值(m/z)和每个峰值区域的归一化峰面积的数据列表,导入SIMCA-P 14.1进行无监督主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),通过OPLS-DA中R2Y(Y的累积模型变化)和Q2(累积的预测变化)2个关键参数评价鲁棒模型的可靠性,当参数越接近1.0时,则模型预测可靠性越高。Q2大于0.5表示可接受,通过200次置换检验验证模型是否过拟合[12]。选取VIP>1与S-plot≥0.05的交集变量作为潜在差异代谢物。采用SPSS22.0软件对数据进行统计分析,利用t检验与非参数检验等分析方法检验两组间生物标志物的相对峰面积是否具有显著性差异,以P<0.05具有统计学意义筛选得到差异代谢物。使用HMDB(https://hmdb.ca/)数据库及Metabo Analyst(https://www.metaboanalyst.ca/)进行生物标志物鉴定和代谢通路分析[13]。
2.6 统计分析
3 结果
3.1 解热效应
各给药组干预发热大鼠在不同时间点的体温变化如表1、图1所示,体温反应指数变化见表2。结果表明,与空白组比较,造模后6 h模型组与各给药组大鼠体温明显上升,差异有统计学意义(P<0.001);与模型组比较,牦牛角低剂量组在给药后2、3 h体温明显下降,差异有统计学意义(P<0.05),且与羚羊角解热效应相当。与模型组比较,牦牛角高剂量组给药后1 h(TRI6~7 h)体温反应指数明显下降,差异有统计学意义(P<0.05)。
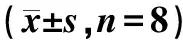
表1 各组大鼠肛温变化
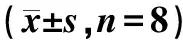
表2 不同时间监测点下各组体温反应指数变化
3.2 细胞因子表达水平
结果见图2,与空白组比较,模型组血清TNF-α水平及下丘脑组织中cAMP与PGE2水平均显著升高,差异有统计学意义(P<0.05,P<0.001),血清IL-1β水平也有上升趋势,但差异无统计学意义;与模型组比较,牦牛角低剂量组TNF-α及cAMP水平均显著降低,差异有统计学意义(P<0.01),牦牛角高剂量组cAMP水平显著降低,差异有统计学意义(P<0.01),牦牛角给药组均有降低IL-1β与PGE2水平的趋势。
3.3 代谢组学样品的质量控制评估
通过UHPLC-MS/MS采集大鼠血浆样本正、负离子流色谱图。采用PCA分析对QC样本进行聚类分析来考察仪器系统的稳定性。结果如图3所示,在正、负离子模式下,QC样品均紧密聚集,表明所建立的代谢组学分析方法稳定可靠,符合大批量进样的分析条件。
3.4 UPLC-Q-TOF-MS数据的多元统计分析
为进一步寻找牦牛角发挥解热药效的潜在生物标志物,对模型组与空白组进行OPLS-DA分析,结果如图3所示,在OPLS-DA评分结果中空白组与模型组明显分离,在正离子模式下,R2Y=0.996,Q2=0.911;在负离子模式下,R2Y=0.96,Q2=0.832;200次置换结果Q2均小于0,表示模型均未过拟合且具有良好的预测能力。在S-plots图中,提取VIP>1和|P|≥0.05变异变量作为潜在候选标志物,进一步采用t检验选出具有显著性差异(P<0.05)的化合物导入HMDB数据库进行检索,如图3所示(其中红色标记为已鉴定得到的15个差异代谢物,黄色标记为符合筛选要求但未鉴定出的生物标志物,蓝色标记为满足VIP和|P|值要求,但经t检验未见显著性差异的化合物),详细信息如表3所示。
3.5 血浆中差异代谢产物鉴定
根据血浆代谢物的质荷比、分子式、二级碎片离子、保留时间,并结合在线数据库对空白组与模型组之间显著变化的代谢物进行鉴定,共指认出15个差异代谢物,详细信息见表3、图4。牦牛角高剂量给药后可显著回调其中11个代谢物,主要包括磷脂酰乙醇胺、鞘磷脂、腺嘌呤、琥珀酸、L-苏氨酸、4-羟脯氨酸、磷脂酰胆碱、溶血性磷脂酰乙醇胺等。
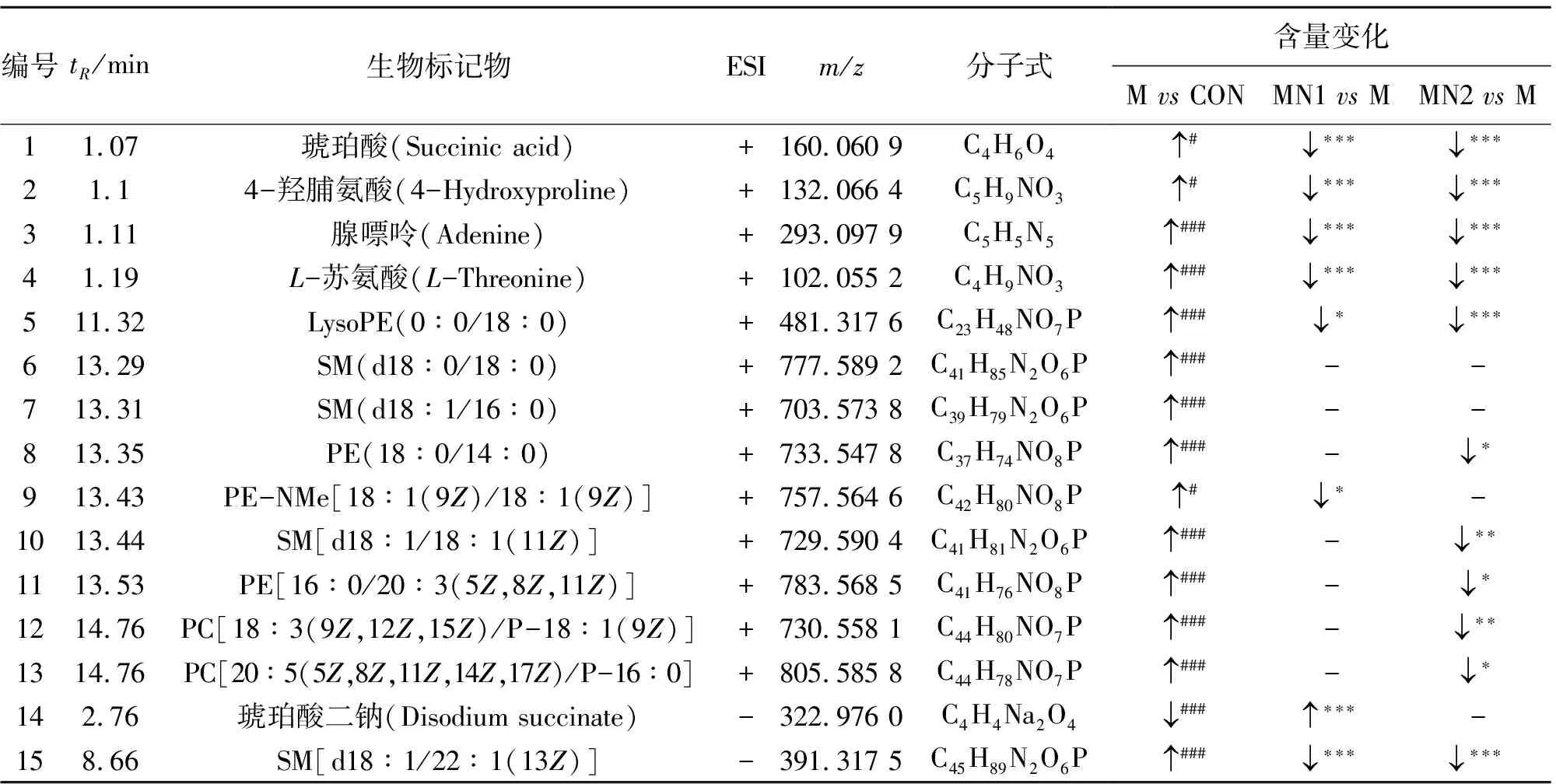
表3 潜在差异代谢物
3.6 代谢通路分析
将差异代谢物导入Metaboanalyst5.0数据库中进行代谢通路分析。代谢通路影响值>0.1的通路被视为贡献值最大的代谢通路。分别筛选得到与发热相关的代谢通路共13条以及牦牛角发挥解热作用的代谢通路共7条,结果见图5,结果表明发热主要涉及通路及牦牛角解热主要涉及通路均为甘油磷脂代谢通路。
4 讨论
LPS为革兰氏阴性菌细胞壁的主要成分,通过内毒素作用于免疫细胞产生内源性致热原,通过中枢介质作用于体温调节中枢引起发热。LPS所致发热模型动物升温过程出现的症状与临床感染性炎症所致发热相似,常用于筛选解热药物并探讨炎性发热机制[14]。体温反应指数为发热机理实验中直观定量指标,能一定程度概括发热高度、热程和持续波动变化三个要素[15]。研究结果发现,牦牛角高剂量组在给药后1 h体温反应指数明显下降(P<0.05),牦牛角低剂量组在给药后2、3 h体温明显下降(P<0.05),且与羚羊角解热效应相当,提示牦牛角给药组具有较好的解热作用,与西药阿司匹林退热快速但易反弹特点相比,牦牛角呈现出持久退热的作用趋势。
cAMP是接近体温中枢终端的正调节介质,是脑内多种介质的第二信使,是多种致热原引起发热的共同中介环节;PGE2为引起发热的主要介质,内生致热源通过作用于下丘脑视前区来刺激下丘脑中PGE2释放,进而改变体温调节神经元的放电频率,致使体温调定点上调引起发热[16-17]。TNF-α与IL-1β为外周致热细胞因子,两者协同介导发热进程。TNF是内生致热源刺激巨噬细胞、淋巴细胞等产生的一种蛋白质,包括TNF-α和TNF-β,二者生物效应相似,其中TNF-α是参与发热过程的主要细胞因子,可以直接刺激PGE2或IL-6的生成。IL-1β是LPS致热所必需的介导物质之一,主要作用于体温调节中枢。IL-1β可直接通过终板血管器的毛细血管或经过毛细血管壁到达血管外间隙(血脑屏障外侧)的干细胞处,血液中IL-1β可激活毛细血管的内皮细胞,通过内皮细胞间接分泌到脑中进而传输致热信号[18-20]。本研究表明模型组血清TNF-α水平及下丘脑组织中cAMP与PGE2水平均显著升高(P<0.05,P<0.001),血清IL-1β水平也有上升趋势,牦牛角给药组能显著下调TNF-α及cAMP水平(P<0.01),且有降低IL-1β与PGE2水平的趋势,提示牦牛角可通过抑制内源性致热源和中枢体温正性调节介质的释放来发挥解热作用。
非靶向血浆代谢组学研究结果发现,与发热相关的差异代谢物有15个,主要涉及的信号通路为甘油磷脂代谢通路。牦牛角给药后可显著回调其中11个代谢物,包括磷脂酰乙醇胺PE[16∶0/20∶3(5Z,8Z,11Z)]与PE(18∶0/14∶0)、鞘磷脂SM[d18∶1/18∶1(11Z)]与SM[d18∶1/22∶1(13Z)]、腺嘌呤、琥珀酸、L-苏氨酸、4-羟脯氨酸、磷脂酰胆碱PC[18∶3(9Z,12Z,15Z)/P-18∶1(9Z)]与PC[20∶5(5Z,8Z,11Z,14Z,17Z)/P-16∶0]、溶血性磷脂酰乙醇胺LysoPE(0∶0/18∶0)。磷脂作为细胞膜的重要组成成分可分为甘油磷脂与鞘磷脂两大类,其中PE与PC是细胞膜中含量最丰富的磷脂,在细胞信号传导、膜锚定和底物转运中起主要作用,其合成增加与炎症的发生密切相关[21];腺嘌呤主要参与能量代谢与白细胞生成[22];琥珀酸作为柠檬酸或柠檬酸循环的一个重要组成部分,能向电子转移链提供电子,主要参与能量代谢[23];有研究表明机体每升高1 ℃需增强10%~12.5%的代谢速度[24],因此人体在发热情况下机体能量代谢水平相应升高,进而影响腺嘌呤与琥珀酸代谢;4-羟脯氨酸是胶原蛋白的主要成分,随着发热机体能量代谢异常进而使活性氧增加,加速胶原蛋白降解[25],使得4-羟脯氨酸水平升高。进一步进行通路富集分析,结果表明牦牛角给药组主要涉及甘油磷脂代谢通路,提示牦牛角能通过调节脂质紊乱而抑制感染性发热。
综上所述,本研究从细胞因子水平与血浆代谢网络调控角度探究了牦牛角发挥解热功效的作用机制,牦牛角可通过调节中枢和外周的致热细胞因子水平,调节脂质类成分,从而影响脂质代谢等途径发挥解热作用,起效快且持久,疗效显著,与名贵中药羚羊角解热效应相当。本研究为牦牛角临床应用及开发成为替代珍稀角类药材的类效资源提供了重要支撑。
