诺如病毒和轮状病毒三重荧光定量PCR检测方法的建立
2022-10-18车颖欣陈世界
安 微 , 郑 晶 , 车颖欣 , 陈世界 , 张 婧 , 杨 苗 , 谢 礼 , 林 华
(1.成都海关技术中心 , 四川 成都 610041 ; 2. 食品安全检测四川省重点实验室 , 四川 成都 610041)
由病毒污染食物所引起的食源性病毒疾病成为目前愈发受到关注的问题。据有关报道显示,在世界范围内,有超过50%的食源性病毒疾病在临床上表现为非细菌性急性胃肠炎症状。非细菌性急性胃肠炎可以由多种病原体引起,已经证实的病原体有诺如病毒(Norovirus,NV)、轮状病毒(Rotavirus,RV)、星状病毒(Astrovirus,AstV)、札如病毒(Sapovirus,SaV)和肠道腺病毒(Adenovirus,AdV)[1]。其中,大于90%的非细菌性急性胃肠炎是由NV和RV所造成的[2]。近年来,我国因NV引起的非细菌性胃肠炎的报道呈现逐年增多的趋势,国内开展的流行病学研究显示,在我国成人感染NV的比例高达90%,可谓形势不容乐观[3]。RV是引起5岁以下婴幼儿非细菌性胃肠炎的最常见的病原体,尽管目前针对RV已经有了相应的疫苗,但是每年在全世界范围内仍然有超过数百万人因为食用被RV污染的食物和水而导致住院,死亡病例达到20万之多[4]。
随着NV和RV引起的食品污染问题越来越严重,加强检测是预防疾病的一种有效方法。目前,针对NV和RV的检测多以单一荧光定量PCR为主,三重荧光定量PCR同时检测这3种病毒的报道较少。因此,本试验开展了三重荧光定量PCR同时检测GⅠ型诺如病毒(Genogroup I Norovirus,GI-NV)、GII型诺如病毒(Genogroup II Norovirus,GII-NV)和A群轮状病毒(Group A Rotaviruses,A-RV)的方法学研究,旨在建立同时、快速、准确检测这3种流行性较广的病原体,给检测和预防NV和RV提供更多的技术参考。
1 材料与方法
1.1 阳性模板与毒株 根据GI-NV、GII-NV的开放阅读框1(Open reading frame 1,Orf1)和开放阅读框2(Open reading frame 2,Orf2)之间的保守基因序列、A-RV的非结构蛋白3(Non-structural protein 3,Nsp3)的保守基因序列作为检测扩增的靶标。人工合成GI-NVOrf1和Orf2基因之间的序列,片段大小为290 bp (GenBank登录号:M87661;合成区间:5 191~5 480 bp);人工合成GII-NVOrf1和Orf2基因之间的序列,片段大小为280 bp (GenBank登录号:X86557;合成区间:4 921~5 200 bp);人工合成A-RVNsp3基因序列,片段大小为270 bp(GenBank登录号:EU868888;合成区间:4 921~5 190 bp)。人工合成的基因片段连接到PMV质粒上,构建阳性质粒。基因由北京六合华大基因科技有限公司合成。用于特异性试验检测的AstV、肠道AdV、SaV等引起非细菌性胃肠炎的常见病原体的阳性质粒标准品为本实验室保存。
动物源食品样本包括牛肉36份、猪肉18份、鸡肉20份、海鲜35份(其中虾15份、牡蛎20份),共计109份,为2019年5—12月送检的动物源食品样本,样本按照常规方法处理后分装编号,置于-80 ℃保存备用。
1.2 主要试剂 普通PCR试剂盒、DNA片段胶回收试剂盒、荧光定量试剂盒和质粒小提试剂盒,均购自上海近岸科技有限公司;GI-NV、GII-NV和A-RV核酸检测试剂盒,均购自江苏硕世生物科技股份有限公司;RNA提取试剂盒、cDNA第一链合成试剂盒,均购自南京诺唯赞生物科技股份有限公司。
1.3 引物与探针的设计 Kageyama等[5]针对GI-NV、GII-NV的Orf1-Orf2连接处的高度保守序列设计引物和探针,以及Jothikumar等[6]针对A-RVNsp3基因高度保守序列设计引物和探针,是目前检测NV和RV的最理想引物探针。因此,本试验参照参考文献[5-6]建立三重荧光定量PCR方法,引物和探针由生工生物工程(上海)股份有限公司合成,引物和探针序列见表1。
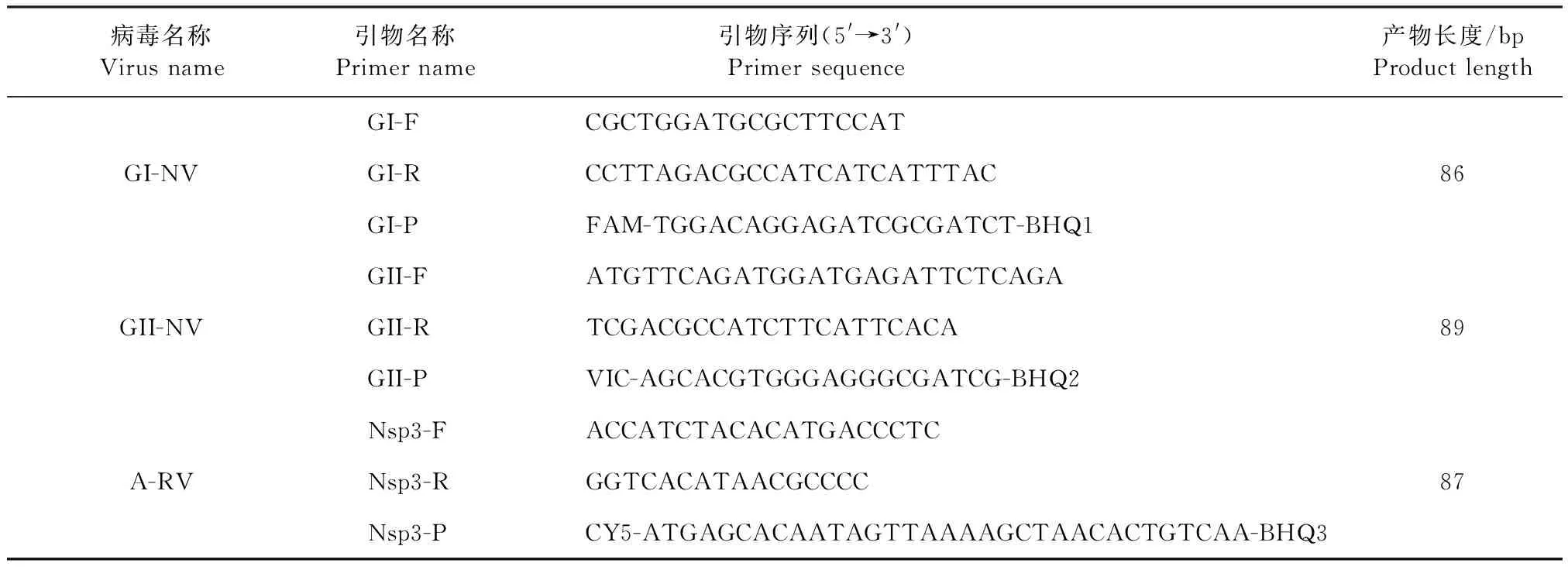
表1 荧光定量PCR引物和探针序列Table 1 Primer and probe sequences of fluorescent quantitative PCR
1.4 质粒标准品的制备 以人工合成的含有GI-NV、GII-NV、A-RV目的基因片段的质粒核酸为模板,使用PMV质粒载体的通用测序引物M13F(5′-TGTAAAACGACGGCCAG-3′)和M13R(5′-CAGGAAACAGCTATGACC-3′)进行扩增,扩增长度分别为392 bp(GI-NV)、384 bp(GII-NV)和373 bp(A-RV)。PCR反应体系和反应条件参照试剂盒说明书。将扩增产物连接克隆载体,制备成重组质粒,然后进行测序。测序结果在NCBI上进行比对,将测序结果正确的阳性重组质粒作为GI-NV、GII-NV、A-RV的标准品。增菌培养含有重组质粒的阳性菌株,运用质粒小提试剂盒提取重组质粒,NanoDrop 2000超微量分光光度计测定重组质粒浓度,按照公式计算重组质粒拷贝数:重组质粒拷贝数(copies/μL)=(质粒浓度×10-9×6.02×1023)/(660道尔顿/碱基×碱基数)。用无菌水将质粒标准品进行10倍梯度稀释,-20 ℃保存备用。
1.5 三重荧光定量PCR反应条件的优化 用质粒标准品作为模板,进行荧光定量PCR扩增。参照荧光定量试剂盒说明书所提供的反应条件,优化引物浓度、探针浓度和退火温度。所有三重荧光定量PCR优化反应均采用GI-NV、GII-NV、A-RV相同浓度的质粒标准品,约108copies/μL。
1.6 三重荧光定量PCR标准曲线的建立 按照已经优化好的三重荧光定量PCR反应条件,将3个重组质粒标准品(浓度为1×1010copies/μL)等体积、等浓度均匀混合,然后再用稀释液依次进行10倍梯度稀释直至1×100copies/μL,-20 ℃保存备用。以7个10倍梯度稀释浓度(1×108~1×102copies/μL)的新混合标准品质粒作为模板,进行三重荧光定量PCR扩增,建立标准曲线,计算相关系数。
1.7 三重荧光定量PCR特异性试验 采用优化好的三重荧光定量PCR反应条件和反应体系,以GI-NV、GII-NV、A-RV、AstV、AdV、SaV的核酸为混合模板进行多重荧光定量PCR扩增,以检验反应体系的特异性。
1.8 三重荧光定量PCR灵敏性试验 将3个重组质粒标准品(浓度为1×1010copies/μL)等体积、等浓度均匀混合,用稀释液将重组质粒标准品混合物稀释成1×108~1×100copies/μL,作为模板,同时设阴性对照,进行多重荧光定量PCR扩增反应,用来确定该方法的灵敏性。
1.9 三重荧光定量PCR重复性试验 选择106、105copies/μL和104copies/μL 3个浓度的重组质粒标准品进行检测,每个浓度重复5次。组内重复性试验:取3个浓度的重组质粒标准品,每个浓度重复5次,计算变异系数CV(%);组间重复性试验:取3个浓度的重组质粒标准品,每个浓度重复5次,在相同条件下每隔7 d进行1次检测,共检测5次,计算变异系数CV(%)。
1.10 动物源食品样品的检测 运用本试验建立的三重荧光定量PCR方法对109份动物源食品样品进行检测,同时采用商品化的GI-NV、GII-NV和A-RV核酸检测试剂盒进行对比检测。
2 结果
2.1 质粒标准品的制备 以人工合成的阳性质粒核酸为模板,使用通用测序引物M13F和M13R进行扩增,PCR结果如图1所示。PCR产物测序结果显示,合成的基因与NCBI上的完全一致,没有出现突变,可以作为质粒标准品。测定重组质粒的拷贝数:GI-NV为3.81×1010copies/μL,GII-NV为2.74×1010copies/μL,A-RV为3.35×1010copies/μL。将制备的3种重组质粒用稀释液稀释成1×1010copies/μL,作为质粒标准品-20 ℃保存备用。同时用无菌水将质粒标准品进行10倍梯度稀释,稀释度为1×108~1×100copies/μL,-20 ℃保存备用。

图1 重组质粒的PCR鉴定Fig.1 PCR identification of recombinant plasmidM:DL2 000 DNA Marker;N:阴性对照(Negative control);1:GI-NV(392 bp);2:GII-NV(384 bp);3:A-RV(373 bp)
2.2 三重荧光定量PCR反应条件 经过对三重荧光定量PCR反应条件的多次试验,最后确定三重荧光定量PCR检测GI-NV、GII-NV、A-RV的最佳反应体系:2×NovoStart®Probe qPCR SuperMix 25 μL,GI-F 0.5 μL,GII-F 0.5 μL,Nsp3-F 0.5 μL,GI-R 0.5 μL,GII-R 0.5 μL,Nsp3-R 0.5 μL,GI-P 1.2 μL,GII-P 1.2 μL,Nsp3-P 1.2 μL,GI-NV模板2 μL,GII-NV模板2 μL,A-RV模板 2 μL,RNase Free Water 12.4 μL,共计50 μL。反应程序:94 ℃预变性5 min,94 ℃ 15 s,58 ℃ 1 min(收集荧光),共40个循环。
2.3 三重荧光定量PCR标准曲线 利用优化好的三重荧光定量PCR反应条件,将3个重组质粒标准品用稀释液进行10倍梯度稀释(1×108~1×102copies/μL)作为模板,进行三重荧光定量PCR的标准曲线绘制,结果显示,GI-NV、GII-NV和A-RV在3个对应的荧光通道都有较好的线性关系。其中,GI-NV的相关系数R2=0.998 1,GII-NV的相关系数R2=0.996 7;A-RV的相关系数R2=0.995 1。质粒标准品拷贝数与Ct值的线性关系见图2。

图2 三重荧光定量PCR标准曲线Fig.2 Standard curve of triple fluorescence quantitative PCRA:GI-NV; B:GII-NV; C:A-RV
2.4 三重荧光定量PCR特异性试验 特异性试验结果显示,本试验建立的三重荧光定量检测方法只能特异性的检测到GI-NV、GII-NV和A-RV,其他病毒样本均为阴性,表明该方法具有很好的特异性,结果见图3。

图3 三重荧光定量PCR特异性试验Fig.3 Specificity test of triple fluorescent quantitative PCRA:GII-NV; B:GI-NV; C:A-RV; D:阴性对照(Negative control)
2.5 三重荧光定量PCR灵敏性试验 将GI-NV、GII-NV、A-RV三种重组质粒标准品混合后10倍系列稀释,作为检测模板,经过检测,当设定Ct值≤35时,确定多重荧光定量PCR对GI-NV、GII-NV、A-RV最低检出限均为1×102copies/μL,表明该方法灵敏度较高,结果见图4。
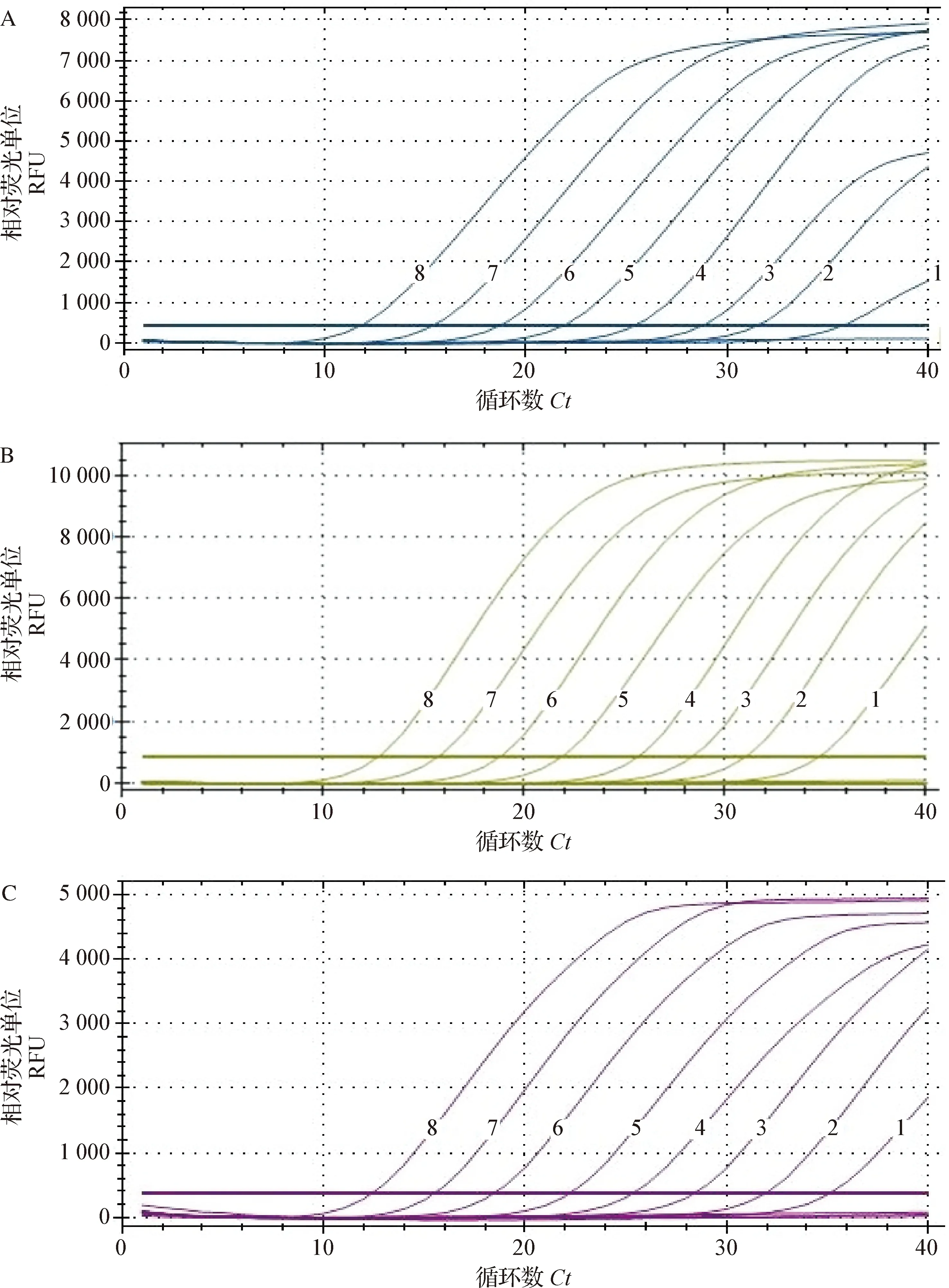
图4 三重荧光定量PCR灵敏性试验Fig.4 Sensitivity test of triple fluorescent quantitative PCRA:GI-NV; B:GII-NV; C:A-RV
2.6 三重荧光定量PCR重复性试验 三重荧光定量PCR组内和组间重复性试验所用模板为106、105copies/μL和104copies/μL 3个浓度的重组质粒标准品,每个试验重复进行5次,结果见表2和表3。NV和RV的检测结果在组内和组间的变异系数均小于5%,说明建立的三重荧光定量PCR检测方法的重复性较好。

表2 三重荧光定量PCR重复性试验组内结果Table 2 Within group results of triple fluorescence quantitative PCR repeatability test

表3 三重荧光定量PCR重复性试验组间结果Table 3 Inter group results of triple fluorescence quantitative PCR repeatability test
2.7 动物源食品样品检测 利用本试验建立的GI-NV、GII-NV、A-RV三重荧光定量PCR检测方法对收集的109份动物源食品进行检测,同时使用商品化的试剂盒进行比对,结果显示,2种检测方法的符合率达到100%,结果见表4。

表4 样品检测结果Table 4 Sample test results
在36份牛肉、18份猪肉、20份鸡肉和35份海鲜(其中虾15份、牡蛎20份)共计109份动物源食品样品中,共检测出8份样品中含有GI-NV、GII-NV、A-RV中的1种或者2种。具体结果:2份牛肉中检出GII-NV;1份猪肉中检出A-RV;鸡肉中无检出;1份虾中同时检出GI-NV和GII-NV;1份牡蛎中检出GI-NV、1份牡蛎中检测GII-NV、2份牡蛎中同时检出GII-NV和A-RV。
3 讨论
由诺如病毒和轮状病毒污染食物所引起的非细菌性急性胃肠炎病越来越多,并且混合感染和继发感染也较为普遍,给临床诊断带来很多困难[7-8]。荧光定量PCR检测方法是近年来应用较广的新型核酸定量检测技术,其具有灵敏度高、重复性好、特异性强、污染少、节约时间等优点,被广泛应用于临床医学检测、基因表达研究、细菌和病毒检测等方面。王毅谦等[9]建立了基于Allglo探针技术同时检测GI-NV和GII-NV的双重荧光定量PCR方法;周冬梅等[10]建立了基于TaqMan探针技术同时检测GI-NV和GII-NV的双重荧光定量PCR方法;李凡[11]、陈峰等[12]建立了RV的荧光定量PCR检测方法。但是针对NV和RV同时检测的荧光定量PCR方法还很少见。本试验通过人工合成GI-NV、GII-NV、A-RV的保守序列,并通过PCR扩增、DNA片段连接克隆载体,从而构建了含有GI-NV、GII-NV、A-RV的保守序列的重组质粒标准品,在重组质粒标准品的基础上建立了同时检测GI-NV、GII-NV、A-RV的多重荧光定量PCR方法。本试验之所以采用质粒标准品作为模板进行研究,主要有以下原因:质粒标准品相对于病毒基因组而言长度较小,进行PCR扩增操作比较简便快捷,同时PCR扩增过程不容易断裂,而病毒基因组为RNA,具有容易降解的特性。在优化多重荧光定量PCR反应条件时,采用质粒标准品能保证操作过程的稳定性,同时还避免了每次试验都要进行RNA提取、反转录等过程带给试验的误差。本试验建立的三重荧光定量PCR检测GI-NV、GII-NV、A-RV方法实现了一管三重检测,3种病毒质粒标准品的检测灵敏度均为100 copies/μL,并且具有良好的特异性和重复性。本试验建立的三重荧光定量PCR方法能够对诺如病毒和轮状病毒进行快速鉴别,并对诺如病毒和轮状病毒的流行病学调查提供了有效的技术手段。
