一步法构建鸡传染性贫血病毒感染性克隆
2022-10-18陈俊成马子月李晓齐王永强郑世军
陈俊成 , 袁 栩 , 马子月 , 李晓齐 , 曹 红 , 王永强 , 郑世军 , 高 丽
(中国农业大学动物医学院农业农村部动物流行病学重点实验室 , 北京 海淀 100193)
鸡传染性贫血(Chicken infectious anemia,CIA)是由鸡传染性贫血病毒(Chicken infectious anemia virus,CIAV)引起的一种禽免疫抑制病[1]。雏鸡感染CIAV后胸腺细胞和骨髓中成红细胞被破坏,造成严重的免疫抑制和贫血[2-3],这不仅会降低疫苗对雏鸡的保护作用,导致雏鸡死亡率增高,还会降低饲料转化率以及肉鸡的生产性能,对家禽产业产生巨大的经济影响[4-5]。CIAV属于指环病毒科 (Anelloviridae) 环病毒属 (Gyrovirus),病毒基因组为环状单链DNA,编码3种病毒蛋白:VP1、VP2和VP3。VP1是唯一的结构蛋白,可结合病毒中的ssDNA[6]; VP2是一种双特异性蛋白质磷酸酶,在病毒粒子组装过程中主要起到脚手架蛋白的作用[7]; VP3又称凋亡素,可诱导淋巴细胞与骨髓造血母细胞凋亡,最终导致鸡出现贫血和免疫抑制[8]。
反向遗传技术已广泛应用于各种DNA病毒,该技术通过将DNA病毒的全长基因组克隆入质粒载体从而获得感染性克隆,然后将感染性克隆转染细胞拯救获得重组病毒[9-10]。由于CIAV是环状病毒,直接将全基因组DNA插入质粒后转染细胞并不能得到重组病毒。目前多先通过分段获得CIAV基因组,连接得到线性全长基因组后,继而连接载体并通过酶切环化得到病毒环状基因组[11]; 此外,还可在载体中加入重复的两端CIAV基因组[12]。但上述方法需要进行多次酶切、连接、单克隆鉴定、测序等复杂程序,耗时较长。本试验通过优化PCR反应条件,一次性扩增出CIAV全基因组,并通过引物设计使CIAV基因组两端带有与载体相同酶切位点的同源臂,使用同源重组技术将病毒基因组嵌合入载体中,提高了CIAV感染性克隆构建的效率,为进一步研究CIAV的致病机制和研发新型疫苗提供了试验基础。
1 材料与方法
1.1 毒株、菌株和质粒 CIAV Cux-1毒株,由北京市农林科学院畜牧兽医研究所杨兵研究员馈赠;质粒pcDNA3.1,由本实验室保存;鸡淋巴瘤细胞MDCC-MSB1,购自美国菌种保藏中心(American Type Culture Collection,ATCC);大肠杆菌感受态菌株Trans-T1,购自北京擎科生物科技有限公司。
1.2 主要试剂 DNA 凝胶回收试剂盒和无内毒素质粒小提试剂盒,均购自广州美基生物科技有限公司;病毒基因组DNA/RNA快速提取试剂盒,购自北京艾德莱生物科技有限公司;LATaq酶、限制性内切酶和Solution I连接酶,均购自日本 TaKaRa公司;2×Basic Assembly Mix(同源重组酶),购自北京全式金生物技术有限公司;琼脂糖,购自北京盛旭百川生物科技有限公司;100×非必需氨基酸和胎牛血清,均购自美国 Gibco 公司;低熔点琼脂,购自北京博奥拓达科技有限公司;核酸分子量标准(DNA Marker),购自北京中科瑞泰生物科技有限公司;核酸染料 Gold View、HRP标记山羊抗小鼠IgG、FITC 标记山羊抗鼠 IgG,均购自北京鼎国生物技术有限责任公司;CIAV VP2 3D7株单克隆抗体,由本实验室制备。
1.3 主要仪器 电泳成套设备,北京东方瑞利科技有限公司;台式电子天平,德国Sartorius公司;高压蒸气自动灭菌器,日本电气公司;-80 ℃超低温冰箱,美国Forma Scientific公司;低温冷冻高速离心机,德国Eppendorf 公司;凝胶成像分析系统,美国Alpha公司;超净工作台,中国苏州净化设备厂;透射电子显微镜,日本Hitachi 公司;CO2培养箱,美国Thermo公司;倒置显微镜,中国重光公司;Bio-Rad电穿孔仪,美国伯乐公司。
1.4 试验方法
1.4.1 DNA提取 将CIAV Cux-1株病毒接种MDCC-MSB1细胞,用含有2%胎牛血清的RPMI 1640培养基维持培养24 h,收取细胞与细胞上清并反复冻融3次,经3 000 g离心2 min后取上清,用病毒基因组DNA/RNA快速提取试剂盒提取DNA。
1.4.2 CIAV全长基因组的克隆 根据CIAV Cux-1株基因序列 (GenBank登录号:M55918.1)及 pcDNA3.1质粒多克隆位点设计带有同源臂和酶切位点的引物(表1),并由北京擎科生物科技有限公司合成。以病毒基因组DNA为模板,以CIAV-AflⅡ-F/R为引物,用LATaq酶进行PCR扩增。PCR反应体系:2×High Fidelity Master Mix 25 μL,模板 5 μL,上、下游引物各 2 μL,ddH2O 13.5 μL,DMSO 2.5 μL;PCR反应条件:98 ℃预变性2 min;98 ℃变性10 s,58 ℃退火15 s,72 ℃延伸30 s,共33个循环;72 ℃终延伸5 min。用DNA 凝胶回收试剂盒对PCR产物回收和纯化。
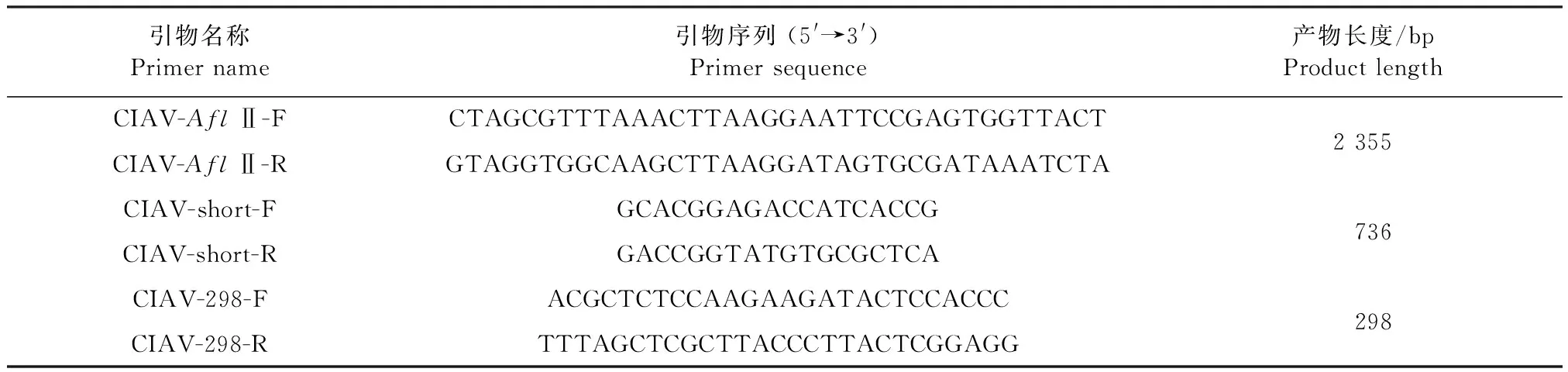
表1 病毒基因组扩增引物(基于Cux-1毒株)Table 1 Primers for viral genome amplification (based on Cux-1 strain)
1.4.3 嵌合CIAV Cux-1株全长基因组重组质粒的构建 用AflII内切酶酶切pcDNA3.1载体,回收纯化酶切后产物。应用同源重组酶将病毒基因组DNA与线性化pcDNA3.1载体同源重组,从而将病毒基因组DNA全长嵌合入载体中。同源重组体系:2×Basic Assembly Mix 5 μL,目的基因 3.5 μL,线性化载体 1.5 μL;反应条件:50 ℃ 30 min,4 ℃保存。同源重组产物转化感受态细胞Trans-T1,进一步通过菌落PCR筛选阳性克隆并进行测序鉴定,将测序正确的质粒命名为pcDNA3.1-Cux-1。
1.4.4 CIAV全长基因组的环化 对重组质粒pcDNA3.1-Cux-1 进行AflⅡ单酶切,酶切体系:AflⅡ限制性内切酶 1 μL,10×buffer 5 μL,重组质粒 2 μg,ddH2O补充至50 μL。得到线性化CIAV Cux-1株全基因组,其两端携带有互补的黏性末端。酶切产物经回收和纯化后,通过SolutionⅠ连接酶连接得到 CIAV Cux-1 环状DNA。
1.4.5 重组病毒rCux-1的拯救 为区分重组病毒与亲本病毒,将重组病毒命名为rCux-1。CIAV Cux-1环状DNA电转染 (220 V,10 ms)导入MDCC-MSB1细胞。转染后细胞置于含10%胎牛血清、无抗生素的RPMI 1640培养基中,48 h后对细胞反复冻融3次,离心收获上清液并通过0.45 μm滤器过滤,将滤液按1∶10接种MDCC-MSB1细胞进行连续传代。
1.4.6 重组病毒rCux-1的鉴定
1.4.6.1 PCR鉴定 当病毒连续传代至第3、4、5代时,通过病毒基因组DNA/RNA快速提取试剂盒提取病毒DNA,使用CIAV-298-F/R引物进行PCR扩增CIAVvp2保守区。
1.4.6.2 Western blot检测VP2蛋白 当病毒连续传代至第8代时,用RIPA裂解液裂解细胞收获细胞总蛋白,经12% SDS-PAGE后转印至PVDF膜,以CIAV VP2 3D7株单抗为一抗(1∶1 000),以HRP标记山羊抗小鼠IgG为二抗(1∶10 000);使用化学发光法进行曝光。
1.4.6.3 间接免疫荧光检测VP2蛋白 当病毒连续传代至第8代时,离心收集MDCC-MSB1细胞,并用0.01 mol/L PBS (pH 7.4)洗涤2次,每次1 min;以适量PBS重悬细胞,将细胞涂于载玻片,室温干燥;用丙酮-乙醇(体积比为1∶1)4 ℃固定15 min;37 ℃、1% BSA封闭2 h;向细胞涂片滴加CIAV VP2 3D7株单抗稀释液(1∶100),37 ℃孵育1 h;用PBS室温洗涤3次,每次5 min;向细胞涂片滴加 FITC 标记山羊抗小鼠 IgG(1∶100),37 ℃孵育30 min;用PBS室温洗涤3次,每次5 min;室温干燥后在荧光显微镜下观察。
1.4.7 重组病毒遗传标志鉴定 将第9代病毒液根据病毒基因组DNA/RNA快速提取试剂盒说明书提取病毒DNA,通过CIAV-short-F/R引物进行PCR扩增,得到的产物进行AflⅡ酶切鉴定。
1.4.8 建立病毒拷贝数定量PCR(qPCR)标准曲线 计算包含CIAVvp2保守区的重组质粒摩尔浓度,以10倍浓度梯度稀释的质粒作为模板,使用CIAV-298-F/R引物进行qPCR扩增,以Ct值对应质粒拷贝数作标准曲线。其公式为LogYCt=LogX+Ct×Log(1+E),其中YCt为第Ct个循环后扩增产物的量,X为原模板数,E为扩增效率,Ct为扩增循环数。
1.4.9 CIAV复制曲线的测定 将重组病毒与亲本病毒按照感染复数(MOI)为1分别感染处于对数生长期的MDCC-MSB1细胞,在感染后的0、6、12、24 h 和48 h反复冻融裂解细胞,并离心收获上清液,保存于-80 ℃。提取病毒DNA,进行qPCR扩增,通过1.4.8建立的标准曲线计算CIAV拷贝数,绘制病毒生长动力学曲线。qPCR反应体系:2×M5 HiPer SYBR Premix 10 μL,模板 2 μL,上游引物0.4 μL,下游引物0.4 μL,ddH2O 7.2 μL;qPCR反应条件:98 ℃预变性30 s;95 ℃变性10 s,60 ℃退火20 s,共40个循环;熔解曲线:95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s;50 ℃降温30 s。
1.5 CIAV感染性克隆构建流程 CIAV感染性克隆构建流程如图1所示。
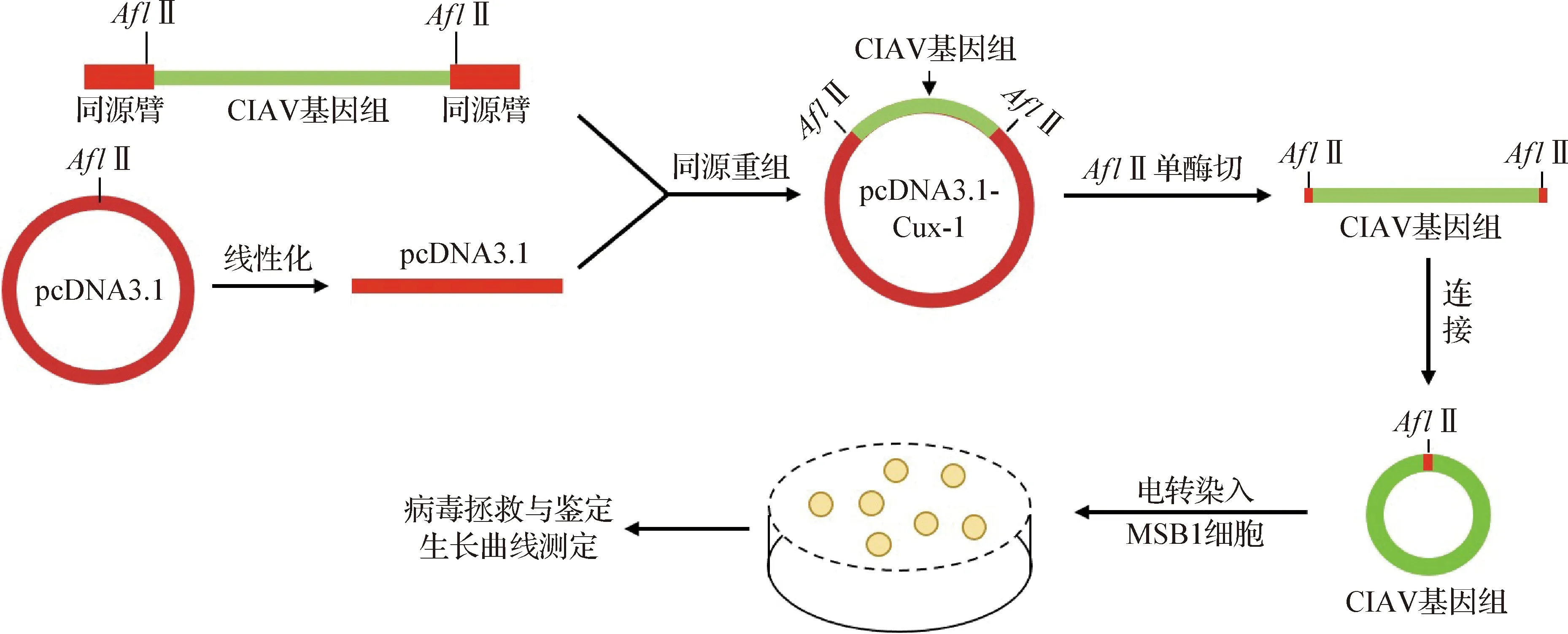
图1 感染性克隆构建流程Fig.1 Flow chart of infectious clone construction
2 结果
2.1 CIAV全长基因组的克隆 以CIAV Cux-1毒株感染MDCC-MSB1后提取的DNA为模板,采用同源臂扩增引物CIAV-AflⅡ-F/R经PCR扩增获得两端带有同源臂的CIAV基因组,片段大小为2 355 bp,与预期大小一致(图2A)。
2.2 pcDNA3.1-Cux-1重组质粒的构建与鉴定 pcDNA3.1载体经AflⅡ限制性内切酶单酶切后线性化(图2B),与带有同源臂的CIAV基因组进行同源重组,转化后挑取测序正确的质粒,命名为pcDNA3.1-Cux-1。测序结果显示,除两端带AflII酶切位点外,质粒pcDNA3.1-Cux-1中插入的CIAV基因序列与亲本病毒完全相同。
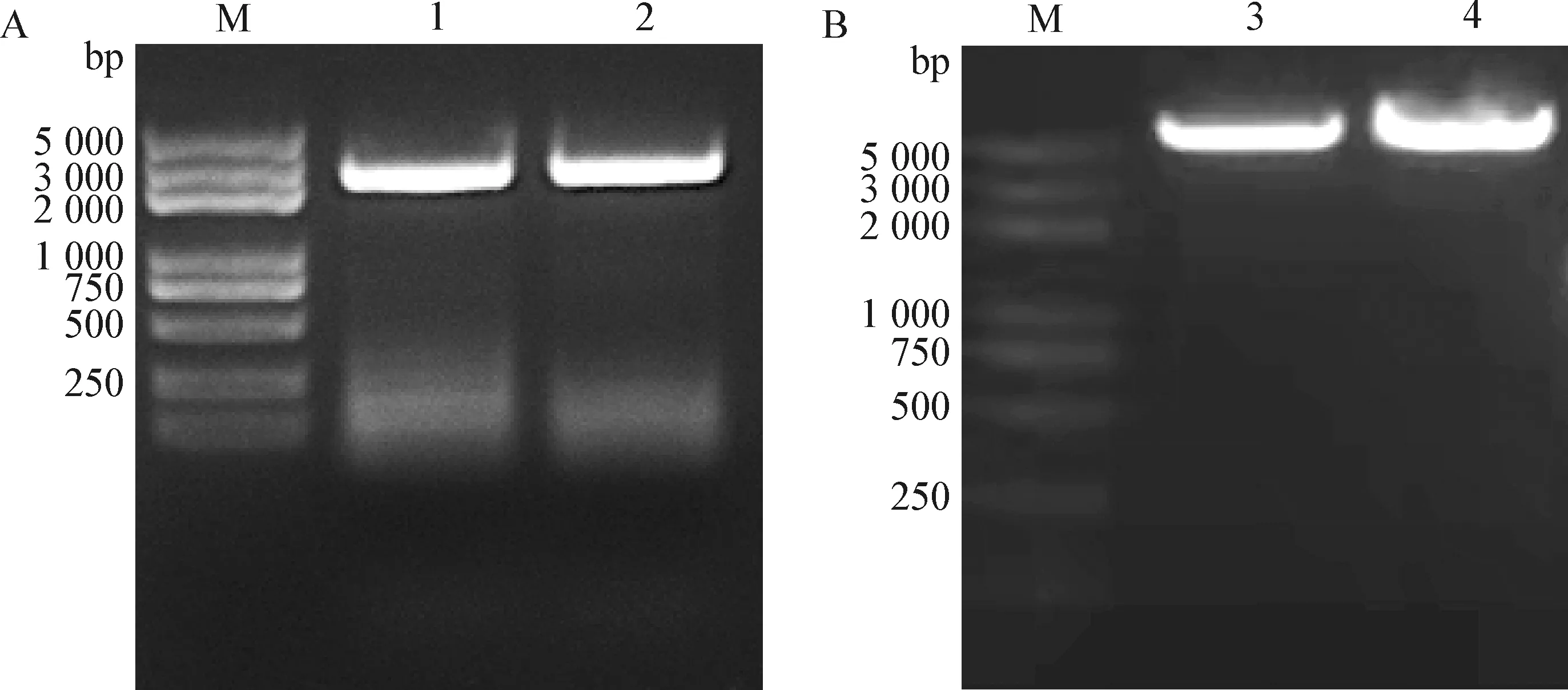
图2 CIAV Cux-1全长基因组PCR扩增(A)与pcDNA3.1载体线性化(B)Fig.2 PCR amplification of CIAV Cux-1 full-length genome (A) and linearization of pcDNA3.1 vector (B)M:DNA标志物(DL2 000 plus); 1~2:Cux-1毒株样品; 3~4:pcDNA3.1载体经Afl Ⅱ限制性内切酶酶切产物M:DL2 000 plus DNA Marker; 1-2:Cux-1 strain samples; 3-4:pcDNA3.1 vector digested by Afl Ⅱ restriction endonuclease
2.3 CIAV环状全长基因组的构建 利用AflⅡ限制性核酸内切酶位点将CIAV全长基因组从pcDNA3.1-Cux-1质粒上切割下来,电泳条带分别为2 350 bp和5 500 bp左右(图3),与预期大小一致。回收并纯化2 350 bp左右的条带,通过Solution Ⅰ 连接酶将线性DNA环化,得到CIAV Cux-1环状基因组。
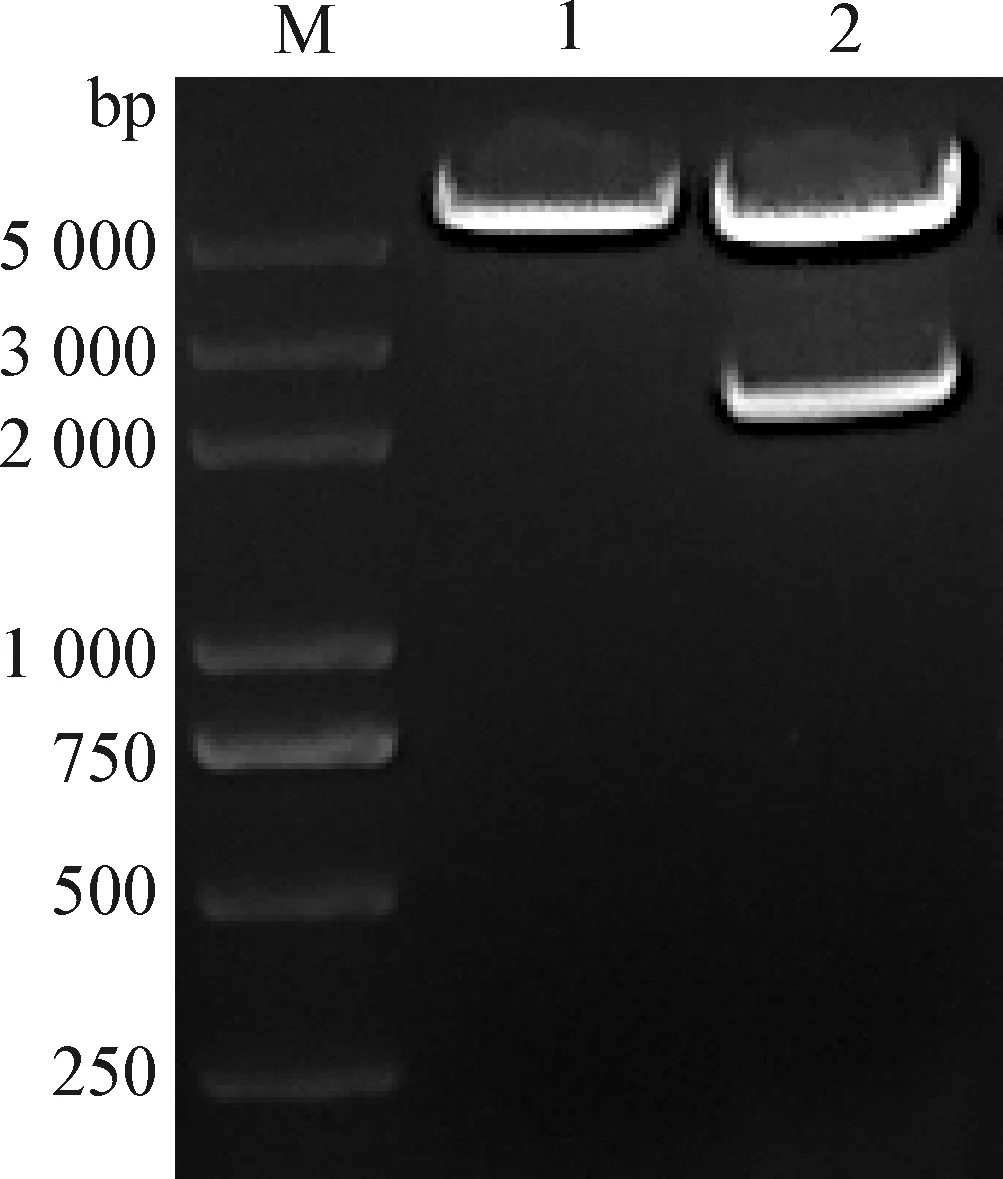
图3 CIAV全长基因组的环化Fig.3 Cyclization of full-length CIAV genomeM:DNA标志物(DL2 000 plus); 1:质粒pcDNA3.1酶切后样品; 2:质粒pcDNA3.1-Cux-1酶切后样品M:DL2 000 plus DNA Marker; 1:Plasmid pcDNA3.1 samples after enzyme digestion; 2:Plasmid pcDNA3.1-Cux-1 samples after enzyme digestion
2.4 重组病毒rCux-1的鉴定 将CIAV Cux-1环状基因组通过电转染方式导入MDCC-MSB1细胞,并进行连续传代。通过PCR检测第3、4、5代细胞,结果如图4所示,病毒DNA均能被检测到,表明病毒可进行传代。将rCux-1传至第8代时,Western blot检测结果显示,CIAV感染MDCC-MSB1细胞24 h后,亲本病毒和重组病毒均能检测到VP2蛋白,而对照细胞无法检测到VP2蛋白(图5),表明重组病毒rCux-1能够正常表达蛋白。同时应用间接免疫荧光检测细胞内VP2蛋白,结果显示,亲本病毒和重组病毒均可检测到特异性的绿色荧光,而对照细胞无法检测到特异性的绿色荧光(图6)。
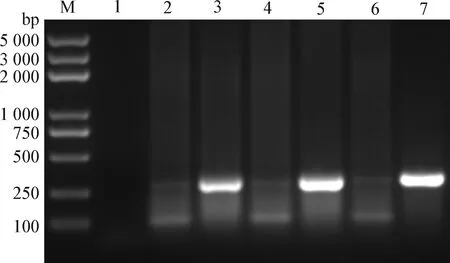
图4 重组病毒的PCR鉴定Fig.4 PCR identification of the recombinant virusM:DNA标志物(DL2 000 plus); 1:空白对照; 2:阴性对照; 3:第3代重组病毒rCux-1; 4:阴性对照; 5:第4代重组病毒rCux-1; 6:阴性对照; 7:第5代重组病毒rCux-1M:DL2 000 plus DNA Marker; 1:Blank control; 2:Negative control; 3:3rd recombinant virus rCux-1; 4:Negative control; 5:4th recombinant virus rCux-1; 6:Negative control; 7:5th recombinant virus rCux-1

图5 免疫印迹检测病毒VP2蛋白Fig.5 Immunoblot detection of viral VP2 protein1:阴性对照; 2:亲本病毒Cux-1; 3:重组病毒rCux-11:Negative control; 2:Parental virus Cux-1; 3:Recombinant virus rCux-1
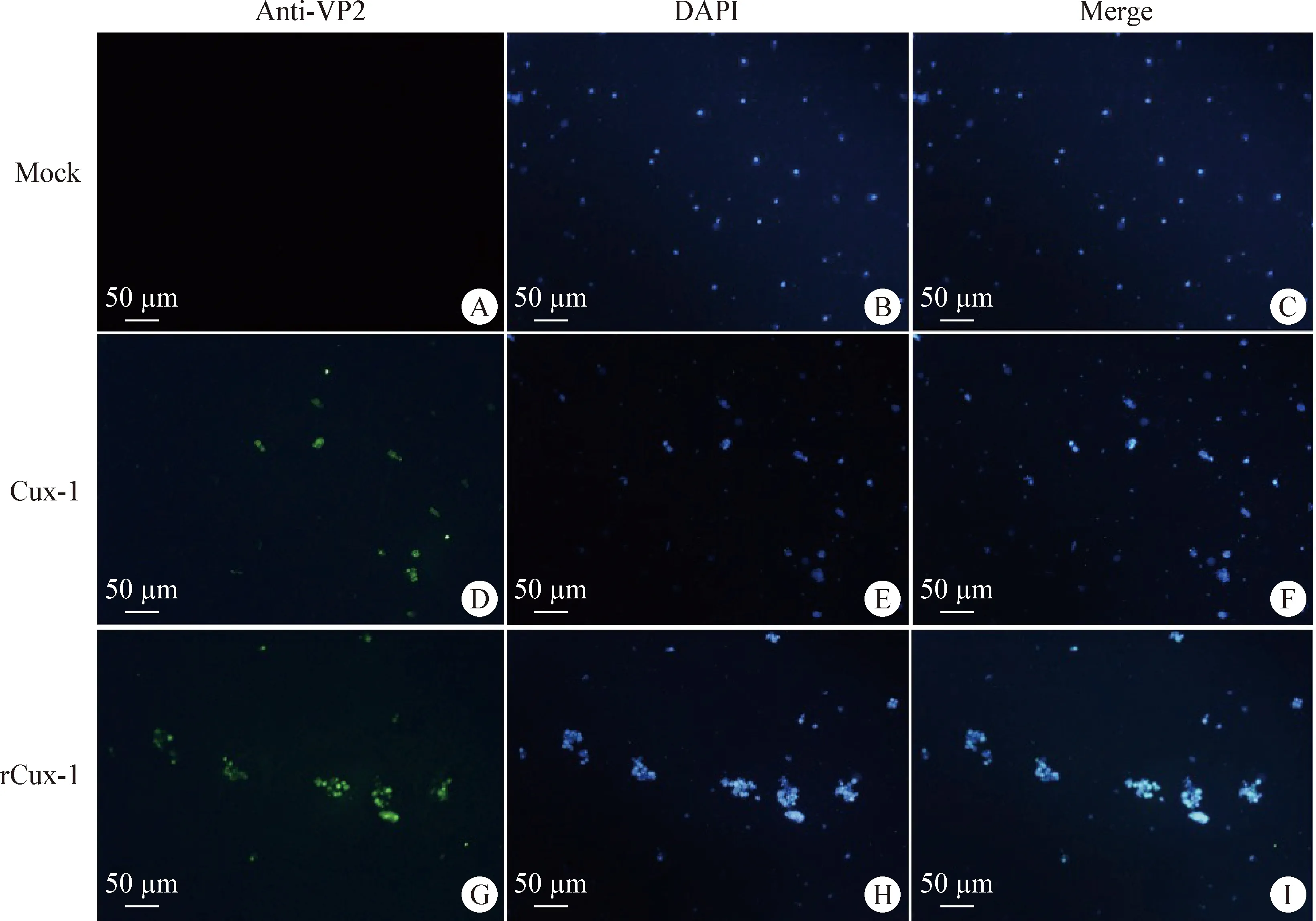
图6 间接免疫荧光检测细胞内VP2蛋白Fig.6 Indirect immunofluorescence detection of intracellular VP2 proteinA~C:阴性对照; D~F:亲本病毒Cux-1; G~I:重组病毒rCux-1A-C:Negative control; D-F:Parental virus Cux-1; G-I:Recombinant virus rCux-1
2.5 重组病毒遗传标志的鉴定 将rCux-1传至第9代,应用PCR技术扩增带有AflⅡ酶切位点遗传标记的序列,电泳结果显示,目的条带大小为736 bp,与预期大小一致(图7)。用限制性内切酶AflⅡ对目标序列进行单酶切,电泳结果显示,亲本毒株Cux-1 PCR产物未被切开,而重组毒株rCux-1 PCR产物切开后得到2条大小为360 bp左右的条带(图8),表明获得的重组病毒rCux-1带有特定遗传标记,为感染性克隆构建所得重组病毒。
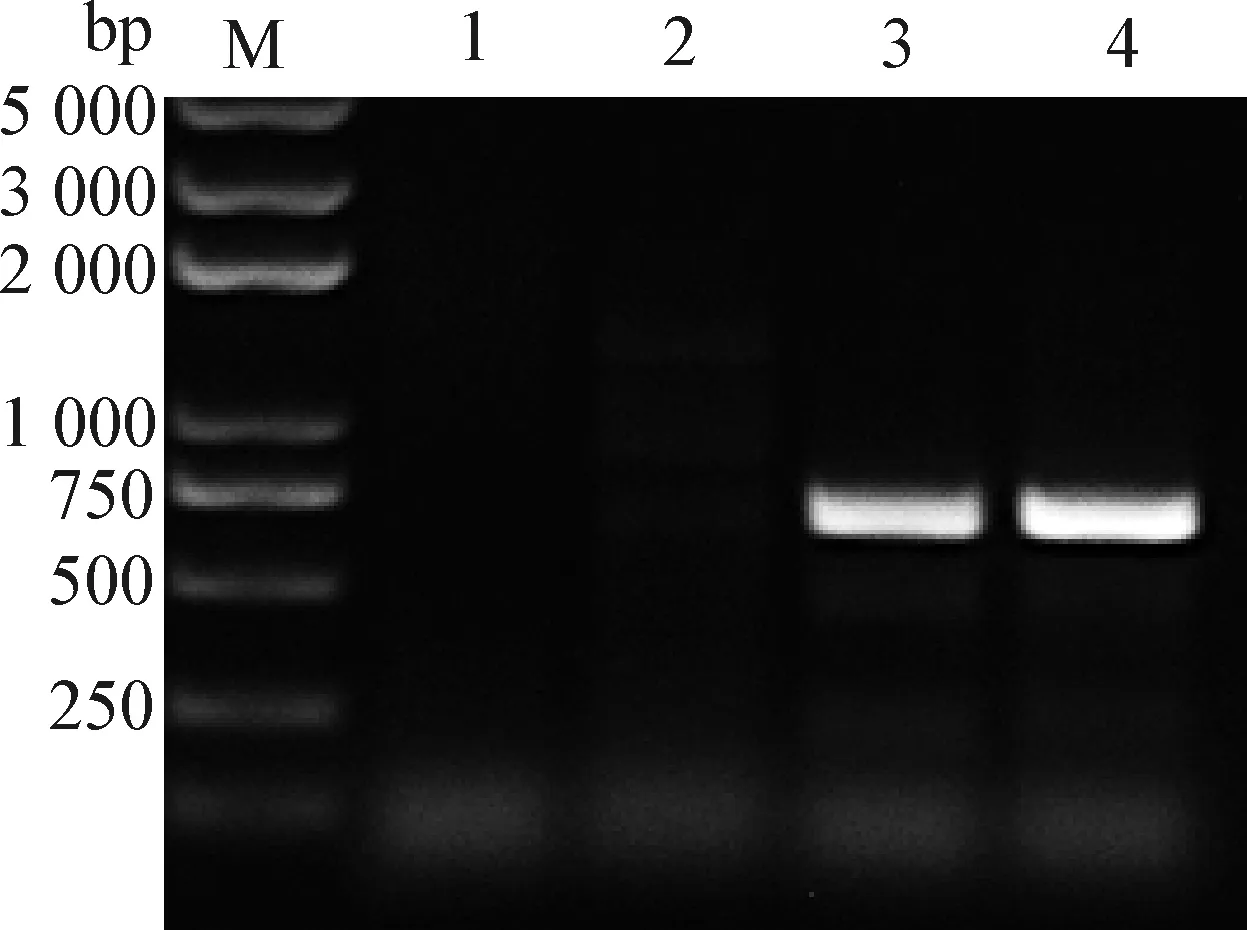
图7 重组病毒的PCR鉴定Fig.7 PCR identification of the recombinant virusM:DNA标志物(DL2 000 plus); 1:空白对照; 2:阴性对照; 3:亲本病毒Cux-1; 4:重组病毒rCux-1M:DL2 000 plus DNA Marker; 1:Blank control; 2:Negative control; 3:Parental virus Cux-1; 4:Recombinant virus rCux-1
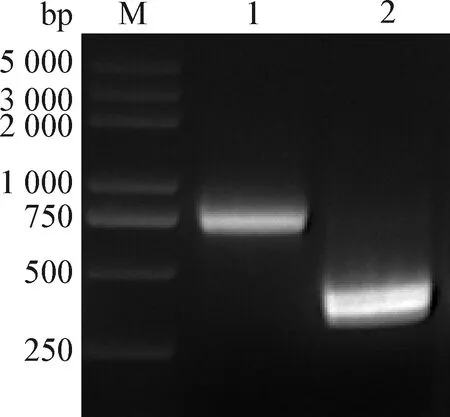
图8 亲本病毒和重组病毒PCR产物的酶切鉴定Fig.8 Identification of PCR products of the parental and recombinant virus by enzymatic digestionM:DNA标志物(DL2 000 plus); 1:亲本病毒 PCR产物酶切后样品; 2:重组病毒PCR产物酶切后样品M:DL2 000 plus DNA Marker; 1:Sample of parental virus PCR product after enzymatic digestion; 2:Sample of recombinant virus PCR product after enzymatic digestion
2.6 病毒复制曲线分析 为比较重组病毒rCux-1与亲本病毒的复制能力和增殖特性是否发生变化,将rCux-1传至第9代后检测病毒感染MDCC-MSB1细胞后不同时间点的病毒拷贝数并绘制病毒生长曲线,发现二者生长趋势一致(图9),表明重组病毒复制能力和增殖特性与亲本Cux-1株基本相同,可用于后续研究。

图9 亲本病毒Cux-1和重组病毒rCux-1的生长曲线Fig.9 Growth curves of parental virus Cux-1 and recombinant virus rCux-1
3 讨论
CIAV是一种重要的禽类免疫抑制病病毒,该病毒于1979年由Yuasa等学者首次报道[3]。随后发现CIAV在世界各地的家禽场中普遍存在,我国于1992年在黑龙江省首次分离到该病毒[13-15]。目前,CIAV在我国广泛流行[15],严重危害养禽业发展,但目前尚没有有效的疫苗防控该病,针对CIAV的减毒活疫苗免疫后诱导的抗体效价较低,仅能提供中等保护[16],因此深入研究CIAV致病机制对于制备新型的亚单位疫苗或DNA疫苗具有重要意义。
反向遗传操作是病毒研究的重要方法,为深入研究病毒致病分子机制以及研制疫苗奠定了基础[17]。为快速构建CIAV反向遗传平台,本试验采用一步法扩增CIAV全基因组,在同源重组酶的作用下连接病毒基因和线性化的质粒,得到重组质粒。重组质粒中CIAV全基因组两端的同源臂上具有相同的酶切位点,单酶切后可在体外使用T4 DNA连接酶将其环化,得到环状的CIAV全基因组。
将环状的CIAV基因组电转染入MDCC-MSB1细胞中,盲传3代后开始提取病毒DNA,连续检测第3~5代病毒DNA,发现在连续传代后仍能够检测到病毒,初步表明病毒拯救成功。本试验在病毒传至第8代时收取了细胞与蛋白,使用VP2单克隆抗体,分别通过间接免疫荧光和Western blot进行鉴定,发现均能检测到VP2蛋白。为进一步探究重组病毒与亲本病毒的复制能力和增殖特性,比较重组病毒第9代rCux-1与亲本病毒第9代Cux-1的生长动力曲线,结果表明重组毒株与亲本毒株增殖能力基本一致。最后,以第9代病毒的DNA为模板,通过PCR扩增其遗传标记,经酶切鉴定为阳性,表明一步法构建CIAV感染性克隆平台准确有效。
本试验感染性克隆构建的关键在于得到病毒环状DNA,CIAV基因组的长度较短(约2.3 kb),为共价闭合环状单股负链DNA。相比于其他方式如分段扩增等[11-12],本试验在高保真DNA聚合酶作用下一步得到病毒全基因组,缩短了构建时间,并且是非载体依赖的分子克隆,更易于转染入细胞得到病毒。
综上所述,本试验成功构建了CIAV感染性克隆,为今后对CIAV进行致病机制研究提供了试验基础,也将为开展基因工程疫苗研究提供平台。
