Mn(Ⅲ)氧化破坏草酸反应动力学及机理
2022-10-18李先俊郝帅张晓腾蒋冬梅夏良树
李先俊,郝帅,张晓腾,蒋冬梅,夏良树,*
(1.南华大学 核科学技术学院,湖南 衡阳,421001;2.南华大学 创新创业学院,湖南 衡阳,421001)
国内目前主要采用的乏燃料处理方式是闭式循环模式[1],即将乏燃料进行后处理,分离和回收铀、钚等有用核素。在闭式循环模式中主要有两种处理方式,即干法后处理和湿法后处理,目前前者还没有得到普遍的应用,而湿法后处理应用较为广泛,其中的Purex 流程在整个乏燃料后处理体系中早已实现了工业化[2]。
在Purex 流程中,钚的沉淀流程为先调节钚的价态实现铀钚分离,使钚进入水相中,再采用沉淀剂草酸将水相的钚进行沉淀。一般将草酸钚沉淀后产生的滤液称为草酸钚沉淀母液,为了达到尽可能回收母液中的钚的目的,往往会将母液浓缩后返回纯化阶段再次进行萃取。而在沉淀过程中加入的过量草酸不仅会降低钚的萃取效率,还会与混合液中的钚再次进行沉淀,可能会引起管道的堵塞,所以必须在再次返回萃取前将母液中的草酸进行破坏[3]。
目前对于草酸钚沉淀母液中草酸的破坏一般有Mn2+催化硝酸氧化法[4]、H2O2催化硝酸氧化法[5]、Mn2+催化臭氧氧化法[6]、Pt/MnO2固体催化硝酸氧化法[7]、电解氧化法[8,9]、Fenton 化学反应[10]等。Andreozzi[6]提出络合氧化分解的观点,认为在Mn2+催化破坏草酸的过程中,Mn2+先被氧化成Mn(Ⅲ),Mn(Ⅲ)再与草酸进行反应,从而达到破坏草酸的目的。目前国内外学者对Mn(Ⅲ)氧化破坏有机物进行了相关研究。Hu[11]等进行了Mn(Ⅲ)降解有机污染物的相关研究,认为Mn(Ⅲ)能更快速的氧化高锰酸钾所不能破坏的污染物;Sun[12,13]等认为在酸性高锰酸钾降解有机废液的过程中配合亚硫酸钠使用,过程中产生微量的Mn(Ⅲ)能促使反应进行,并推断Mn(Ⅲ)在酸性条件下对于有机物的降解速度比高锰酸钾更快;Duke[14]等认为反应常数随草酸盐的浓度增加而减小,在该反应中的氢离子浓度会影响反应速度,并且在Mn(Ⅲ)与草酸的反应过程中,Mn(Ⅲ)与草酸之间的络合会使该反应的活化能下降25~40 kcal,反应的过程中会产生一种极不稳定的自由基;Adriana[15]等认为硫酸或高氯酸盐与草酸存在B-Z 震荡反应,认为Mn(Ⅲ)与草酸的反应动力学为非线性反应动力学;Taube[16-18]等在高氯酸体系中研究了Mn(Ⅲ)与草酸的反应为一级反应;Adler[19]等研究了在高氯酸体系下高锰酸钾与草酸的反应,认为在此过程中,Mn(Ⅲ)与草酸的反应也为一级反应。然而对于Mn(Ⅲ)氧化破坏草酸中各物质的反应级数以及总反应速率常数并没有相关研究,Mn(Ⅲ)与草酸的反应机理尚未明确。
本工作拟研究硫酸体系中Mn(Ⅲ)氧化破坏草酸的动力学,考察Mn(Ⅲ)浓度、草酸浓度、酸度等因素对该反应速率的影响。并通过电子自旋共振谱ESR(ElectronSpin Resonance Spectroscopy)法确定Mn(Ⅲ)破坏草酸过程中产生的自由基,以确定该反应过程中草酸的断键方式,为锰催化氧化破坏草酸过程中的反应历程以及反应机理的深入研究提供理论支持。
1 实验部分
1.1 仪器与试剂
HWCL-3 型集热式恒温磁力搅拌浴,郑州长城科工贸有限公司;AvaSpec-364 8 紫外-可见分光光度计,荷兰Avantes 公司;布鲁克A300电子自旋共振(ESR)仪,德国布鲁克公司。
草酸(分析纯)、二氧化锰(分析纯)、硫酸(分析纯)、铬酸钾(分析纯)、甲基红(分析纯)、甲醇(分析纯),国药集团化学试剂有限公司;硝酸氧锆(分析纯),上海麦克林生化科技有限公司;5,5-二甲基-1-吡咯啉-N-氧化物(DMPO),酷尔化学科技(北京)有限公司。
1.2 实验方法及试剂的制备
1.2.1 Mn(Ⅲ)溶液的制备
量取15 mL 去离子水,30 mL 浓硫酸使其混合均匀,加入三口烧瓶中加热,待溶液加热至200 ℃后,称取一定量的二氧化锰加入到三口烧瓶中,持续加热5 min 后,取出,用去离子水稀释至180 mL,静置24 h 后过滤待用。
1.2.2 Mn(Ⅲ)及草酸浓度的分析方法
Mn(Ⅲ)浓度的分析采用分光光度法。通过测定Mn(Ⅲ)溶液在485 nm 波长处的吸光度,依据标准曲线计算Mn(Ⅲ)浓度。
H2C2O4浓度的测定采用分光光度法。将样品稀释后依次加入显色剂甲基红与铬钾酸,经过一定时间后加入终止剂硝酸氧锆溶液,测量在515 nm、700 nm 波长处吸光值,蒸馏水作空白参比。依据标准曲线计算H2C2O4浓度[20]。
1.2.3 实验步骤
反应动力学实验步骤:取一定量的草酸溶液置于分光光度计比色皿中,再加入一定量的制备好的Mn(Ⅲ)溶液,摇匀后将比色皿放置光路中,开始计时,在485 nm 下进行扫描(以蒸馏水为参比溶液),仪器自动扣除空白并记录数据。扫描时间间隔为0.39 s,总反应时间为10 s,整个反应在常温下进行,考察反应过程中消耗Mn(Ⅲ)浓度随时间的变化。
ESR 法测定自由基实验步骤:首先在试管中加入一定浓度的草酸甲醇溶液,通入氮气处理5 min,再往试管中先后加入一定量的DMPO试剂与一定浓度的三价锰硫酸溶液,充分反应30 s 后,用毛细管吸取一定溶液,用真空封泥封住毛细管,放入ESR 谱仪中进行测量。
1.2.4 Mn(Ⅲ)氧化破坏草酸动力学处理方法
Mn(Ⅲ)氧化破坏草酸的总化学方程式如式(1)所示:

假设反应对H2C2O4浓度、Mn(Ⅲ)浓度的反应级数分别为x、y,则Mn(Ⅲ)氧化草酸的反应速率与溶液中各物质浓度的关系为:

式中:k——反应速率常数
对式(2)两边取对数:
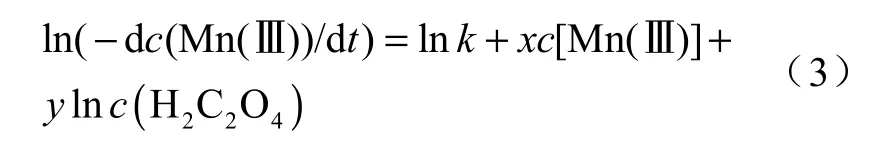
本研究测定反应级数的方法为微分法。对于Mn(Ⅲ)反应级数x的测定,首先保持该反应的初始酸度和初始H2C2O4浓度不变,选择一系列不同的Mn(Ⅲ)作为初始浓度进行实验,得到不同初始Mn(Ⅲ)浓度条件下Mn(Ⅲ)浓度消耗量与时间关系的曲线,通过该曲线可得到初始反应速率为dc0[Mn(Ⅲ)]/dt,作ln(dc0[Mn(Ⅲ)]/dt)与lnc0[Mn(Ⅲ)]的关系图,从图中可得到一条直线,其斜率即为反应级数x。同理可以得到H2C2O4对应的反应级数y以及反应速率常数k。
2 结果与讨论
2.1 Mn(Ⅲ)浓度分析方法的建立
Mn(Ⅲ)离子在485 nm 处可检测到吸收峰,在一定酸度条件下,Mn(Ⅲ)的浓度与吸光度成正比,利用不同浓度的草酸溶液与Mn(Ⅲ)溶液建立一系列标准曲线,根据化学方程式(1)可推算出某一吸光度下Mn(Ⅲ)浓度,其结果如图1 所示。

图1 Mn(Ⅲ)浓度与吸光度的关系Fig.1 The relationship between trivalent manganese concentration and absorbance
从图1 中可以看出Mn(Ⅲ)离子浓度在2~6 mmol/L 范围遵循比尔定律,线性回归方程为:ΔA=0.106 4c[Mn(Ⅲ)]+0.001 8,相关系数R=0.999 4。则可以通过吸光度与Mn(Ⅲ)浓度之间的关系得到溶液中Mn(Ⅲ)的浓度。
2.2 草酸浓度对反应速率的影响
为考察H2C2O4浓度对反应速率的影响,在初始酸度为 6 mol/L、Mn(Ⅲ)浓度为3.769 1 mmol/L、温度为298.15 K,初始的H2C2O4浓度分别为0.729 9 mmol/L、1.206 1 mmol/L、1.444 2 mmol/L、1.682 3 mmol/L 条件下,测得不同初始浓度的H2C2O4与Mn(Ⅲ)反应中消耗的Mn(Ⅲ)浓度随时间t的变化曲线,结果如图2 所示。

图2 不同初始草酸浓度下消耗的Mn(Ⅲ)浓度与反应时间t 的关系Fig.2 The relationship between the Mn (Ⅲ)concentration and the reaction time at different initial oxalic acid concentrations
由图 2 可知,当提高反应体系中的初始H2C2O4浓度,Mn(Ⅲ)的初始消耗速率也随之增大。按照1.2 节所述的方法进行数据处理,作ln(dc0[Mn(Ⅲ)]/dt)与lnc0(H2C2O4)的关系图,可得一条直线,如图3 所示,其斜率为0.885 5,故得到反应体系对H2C2O4的级数为0.885 5。

图3 ln(dc0[Mn(Ⅲ)]/dt)-lnc0(H2C2O4)关系曲线Fig.3 The relationship curve of ln(dc0[Mn(Ⅲ))/dt]-lnc0(H2C2O4)
2.3 Mn(Ⅲ)对反应速度的影响
为考察Mn(Ⅲ)浓度对反应速率的影响,在初始酸度为 6 mol/L,H2C2O4浓度为1.128 7 mmol/L,温度为298.15 K,初始Mn(Ⅲ)浓度分别为0.635 0 mmol/L、2.071 3 mmol/L、2.722 7 mmol/L、3.912 7 mmol/L 条件下,测得不同初始浓度的Mn(Ⅲ)与H2C2O4反应中消耗的Mn(Ⅲ)浓度随时间t的变化曲线如图4所示。
由图4 可知,当提高反应体系中的初始Mn(Ⅲ)浓度,Mn(Ⅲ)的初始消耗速率也随之增大。进行数据处理后,作ln(dc0[Mn(Ⅲ)]/dt)与lnc0[Mn(Ⅲ)]的关系图,可得一条直线,如图5 所示,其斜率为0.727 4。故反应对Mn(Ⅲ)的级数为0.727 4。

图4 不同初始Mn(Ⅲ)浓度下消耗的Mn(Ⅲ)浓度与反应时间t 的关系Fig.4 The relationship between the Mn (Ⅲ)concentration and the reaction time at different initial Mn (Ⅲ) concentrations

图5 ln(dc0[Mn(Ⅲ)]/dt)-lnc0[Mn(Ⅲ)]关系曲线Fig.5 The relationship curve of ln(dc0[Mn(Ⅲ))/dt]-lnc0(Mn(Ⅲ))
综上所述,Mn(Ⅲ)氧化破坏草酸的动力学速率方程可表示为:-dc(Mn(Ⅲ))/dt=kc0.8855(H2C2O4)c0.7274(Mn(Ⅲ)),温度为298.15 K 时,速率常数k=2.0 × 102(mol/L)-0.6129/min。Mn(Ⅲ)氧化草酸的在常温下的反应速率常数大约比363 K 下Mn(Ⅱ)催化硝酸氧化破坏草酸的反应速率常数高五个数量级[4],由此可以推断,在锰催化氧化草酸的过程中,由其他价态的锰转换成Mn(Ⅲ)可能为反应的关键控制步骤。
2.4 酸度对反应速度的影响
为考察酸度对反应速率的影响,在初始H2C2O4浓度为0.722 8 mmol/L,Mn(Ⅲ)浓度为2.137 4 mmol/L,温度为298.15 K,初始酸度分别为4 mol/L、5 mol/L、6 mol/L、8 mol/L 条件下,测得不同初始酸度条件下Mn(Ⅲ)与H2C2O4反应中消耗的Mn(Ⅲ)浓度随时间t的变化曲线如图6 所示。
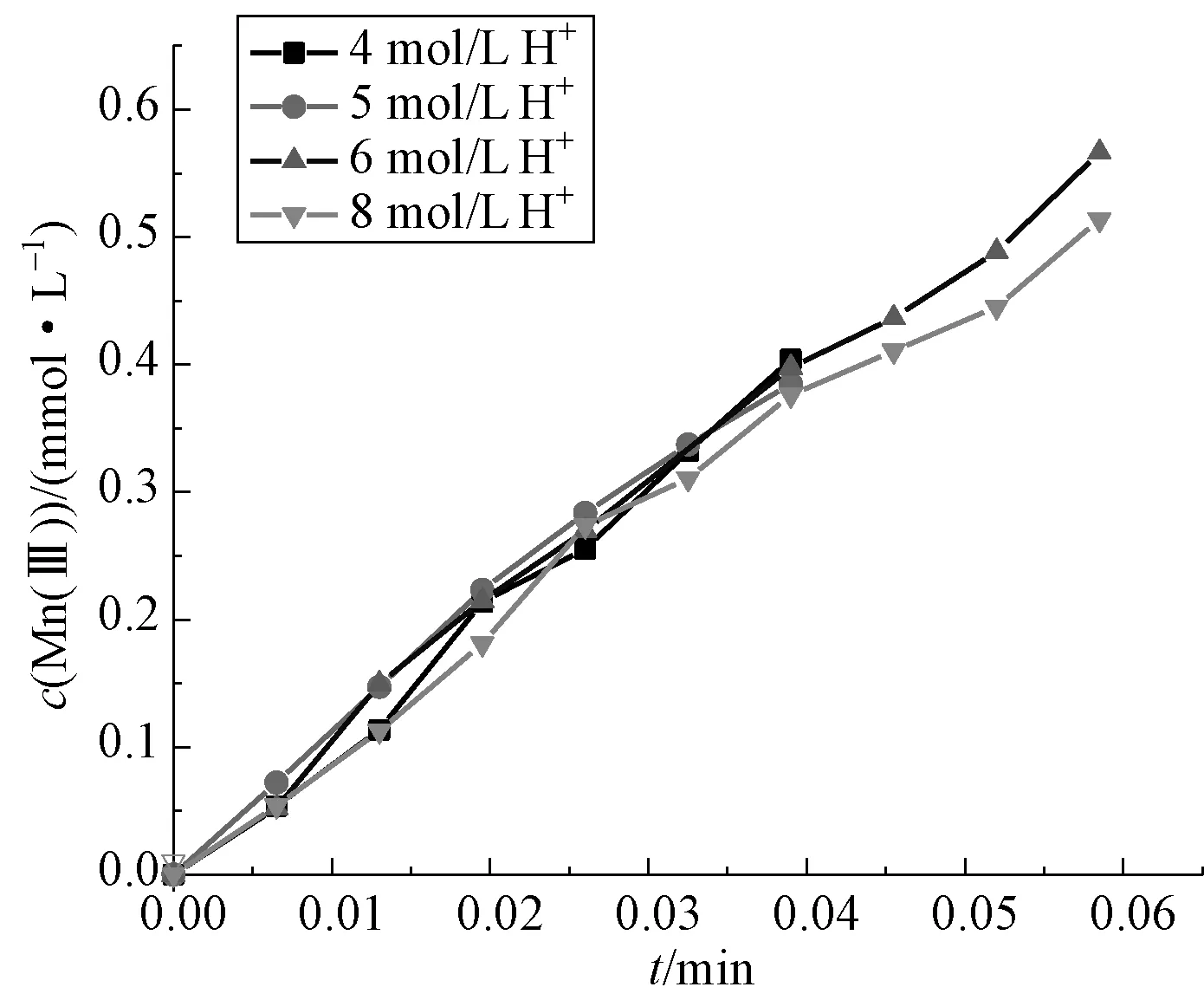
图6 不同酸度下消耗的Mn(Ⅲ)浓度与反应时间t 的关系Fig.6 The relation between the Mn (Ⅲ)concentration and the reaction time at different initial Mn (Ⅲ) concentrations and reaction time at different acidity
由图6 可知,当提高反应体系中的初始酸度,Mn(Ⅲ)的初始消耗速率随之减小。进行数据处理后,作ln(dc0[Mn(Ⅲ)]/dt)与lnc0(H+)的关系图,如图7 所示,得到一条直线,斜率为 -0.251 4,故反应对c(H+)的级数为-0.251 4。说明在反应过程中,酸度过高会使Mn(Ⅲ)氧化破坏草酸的速率降低。
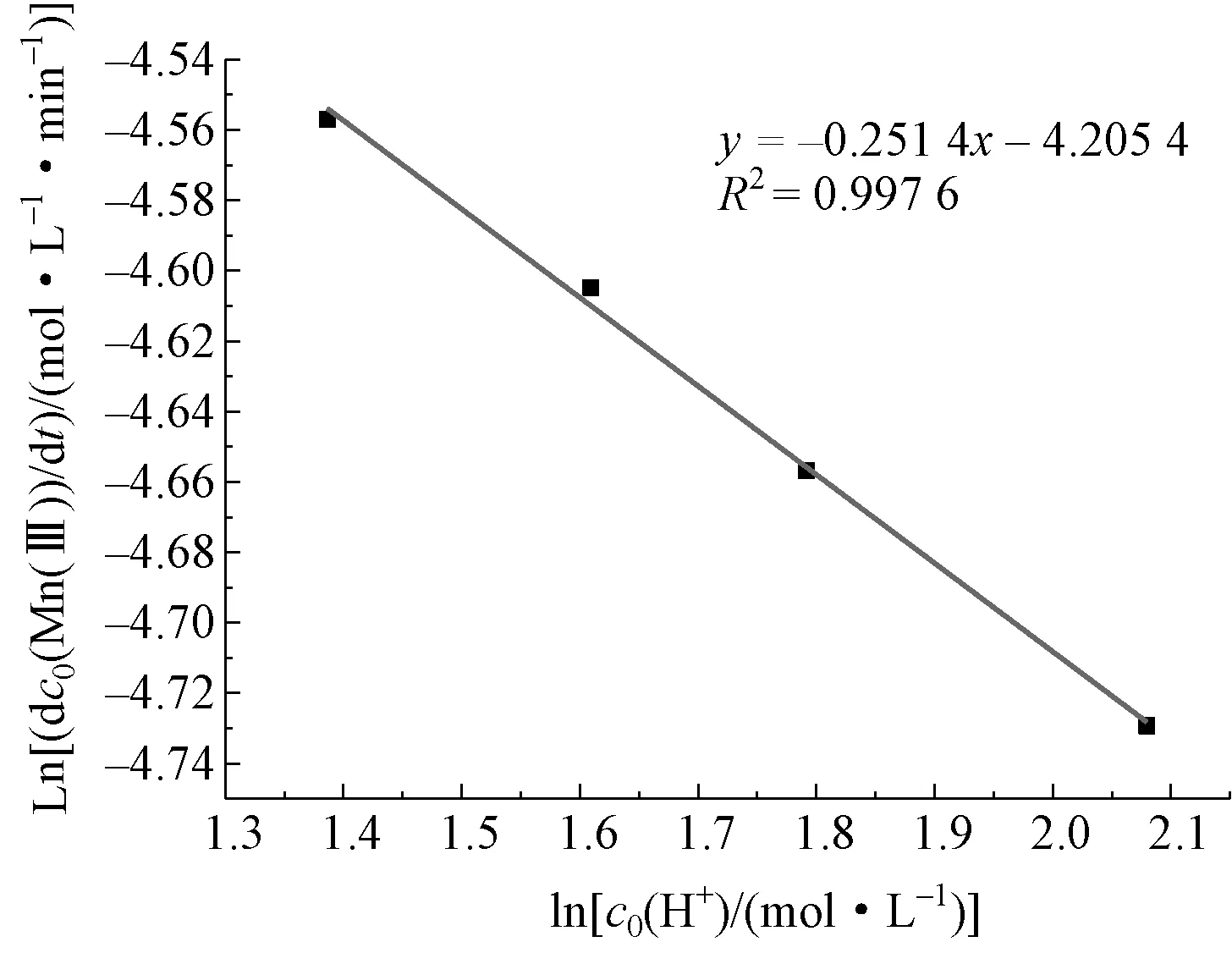
图7 Ln(dc0[Mn(Ⅲ)]/dt)-Lnc0(H+)关系曲线Fig.7 The relationship curve of Ln(dc0[Mn(Ⅲ))/dt] -Lnc0(H+)
2.5 反应过程中间态自由基的研究
为进一步探究Mn(Ⅲ)氧化破坏草酸的反应机理,采用ESR 法对反应过程中的自由基进行检测分析。在50 uL 含1 mol/L 草酸的甲醇溶液中加入Mn(Ⅲ)溶液5 uL 以及5 uL 捕捉剂DMPO,以不含草酸的甲醇溶液作为对照,Mn(Ⅲ)氧化草酸的ESR 谱示如图8 所示。
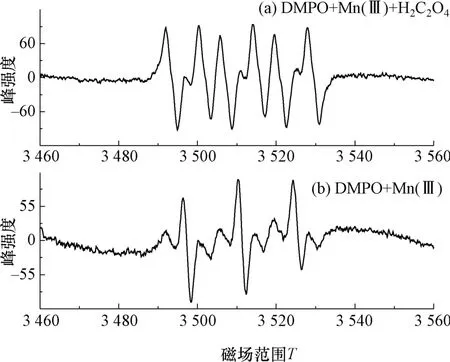
图8 甲醇体系下Mn(Ⅲ)与草酸反应ESR 谱图Fig.8 The ESR spectrum of trivalent manganese reaction with the oxalic acid in the methanol system
图8(a)表示的是在甲醇体系下Mn(Ⅲ)与草酸的反应,从图中可以看出有较为明显的DMPO-加合物信号峰[21],而在不加入草酸的对照组图8(b)中,只出现Mn(Ⅲ)氧化捕捉剂的DMPOX 信号峰。说明Mn(Ⅲ)在破坏草酸的过程中有二氧化碳阴离子自由基的产生,这与Duke[14]做的相关研究的推测机理一致。
2.6 反应机理探讨
通过以上动力学数据以及ESR(电子自旋共振谱)法确定的反应过程中产生的自由基进行分析可得,Mn(Ⅲ)与草酸的反应为单电子氧化过程。增加H2C2O4与Mn(Ⅲ)浓度更有利于提高碰撞几率,促进氧化还原反应的进行,宏观上反映为H2C2O4与Mn(Ⅲ)的反应级数为正数;当提高溶液的酸度后,H2C2O4的水解程度降低,溶液中C2的含量随之下降,影响H2C2O4与Mn(Ⅲ)之间的配位,导致反应速率下降,从宏观上反映为酸度的反应级数为负数;且在Mn(Ⅲ)氧化破坏H2C2O4的反应过程中有捕捉到自由基。则对Mn(Ⅲ)氧化破坏草酸的反应机理进行初步推测,其具体的反应历程可能如图9 所示。

图9 Mn(Ⅲ)氧化破坏草酸反应历程Fig.9 Oxidation of the Mn (Ⅲ) destroyed oxalic acid reaction process
综上所述,整个反应可描述为:在溶液中H2C2O4首先与Mn(Ⅲ)发生配位[15],反应如式(4)所示,Mn(Ⅲ)夺去碳氧单键上氧的一个电子被还原成Mn(Ⅱ),被Mn(Ⅲ)氧化后的的草酸离子中氧上形成孤电子,促使碳碳单键的断裂,生成二氧化碳与,反应如式(5),迅速被其他的Mn(Ⅲ)氧化成二氧化碳,反应如式(6)。
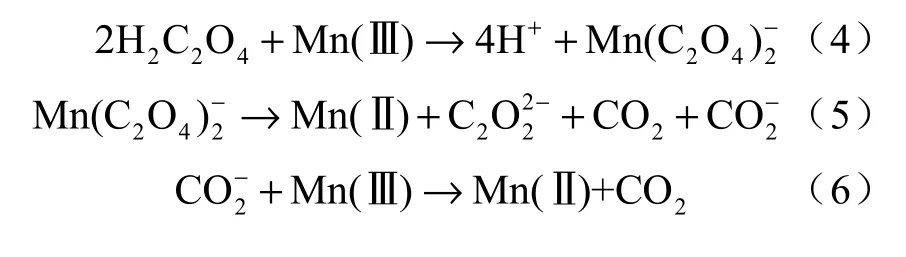
3 结论
本实验条件下,Mn(Ⅲ)氧化破坏草酸的动力学方程为:-dc[Mn(Ⅲ)]/dt=kc0.8855(H2C2O4)c0.7274[Mn(Ⅲ) ],在温度为298.15 K 时,速率常数k=2.0 × 102-0.6129/min。根据动力学的数据及ESR 谱数据分析,推测了Mn(Ⅲ)氧化破坏草酸的反应机理,认为此过程中Mn(Ⅲ)与草酸发生单电子氧化,通过夺取草酸中氧上的电子,进一步导致碳碳单键的断裂,从而促使草酸的分解。
