分光光度法快速测定Mn(Ⅲ)氧化草酸样品中的常量草酸
2022-10-18郝帅李先俊蒋冬梅夏良树
郝帅,李先俊,蒋冬梅,夏良树,*
(1.南华大学核科学技术学院,湖南 衡阳 421001;2.南华大学创新创业学院,湖南 衡阳 421001)
在水法乏燃料处理中,由于锕系元素的草酸盐在水中几乎不溶解,常用草酸作为沉淀剂或络合剂实现锕系元素与其他元素的分离[1],如:在Purex 流程钚纯化循环尾端,常用草酸与Pu(Ⅳ)共沉淀[2];在高放废液的萃取分离流程中,常用草酸作为水相络合剂与锆钌等裂片产物共沉淀实现与其他元素的分离[3]等;不论草酸应用在哪一个方面,都需要在草酸沉淀母液返回使用前,对其中的草酸进行深度破坏,使草酸浓度降低到0.001 mol/L 以下。为此,需要建立一种快速、简便、准确测定草酸浓度的方法,以快速检测破坏后溶液中剩余草酸的浓度,确定其是否达到返回利用的要求。目前,草酸浓度的检测方法主要有滴定法[4]、分光光度法[5,6]、色谱法[7]、酶法[8]等。目前,在乏燃料后处理流程中,工业上常用高锰酸钾作为氧化剂的滴定法进行常量分析,但滴定法存在着滴定精度差,滴定终点较难把握、操作较为复杂、产生废液体积较多等缺点,本文利用Mn(Ⅲ)与草酸能够迅速发生氧化还原反应的特点,建立了一种快速、简便、精确度较高并且产生废液体积少的测定草酸浓度的方法,并适用适用于含有高浓度硝酸的样品检测。
1 实验部分
1.1 仪器和试剂
Cary 3500 UV-Vis 分光光度计,安捷伦公司;HWCL-3 型集热式恒温磁力搅拌仪,郑州长城科工贸有限公司;草酸、二氧化锰、硫酸、硝酸,均为分析纯,购自国药集团化学试剂有限公司。
1.2 二氧化锰的预处理
取25 g 二氧化锰放入坩埚中于600 ℃温度下煅烧1 h,取出放置于干燥箱中,冷却至室温,密闭储存待用。
1.3 Mn(Ⅲ)溶液的制备与保存
量取去离子水15 mL 加入到50 mL 三口瓶中,再量取质量分数98%的浓硫酸30 mL 加入其中,磁力搅拌使硫酸溶液充分混匀后取出转子,然后将三口瓶放入到油浴锅中固定,左右两口用玻璃瓶塞塞住,中间插入直形或球形冷凝回流套管,加热至温度约200 ℃,然后加入0.15 g 预处理过的二氧化锰,继续加热约5 min至溶液微沸腾,之后从油浴锅取出三口瓶,将其放入冰浴中冷却降温,每隔几分钟反复摇晃三口瓶,重复操作三到四次至三口瓶内溶液温度不再发生变化,再缓慢倒入含160 mL 0 ℃去离子水的250 mL 量筒中,继续在冰浴中冷却15 min,再加去离子水定容至210 mL,用玻璃棒搅拌,充分混合后,放入5~10 ℃冷藏室中静置12 小时,最后通过0.02 mm 的PES 过滤,滤液置于5~10 ℃保存即可。制得的Mn(Ⅲ)溶液清澈透明呈暗玫瑰红色,在5 ℃下可稳定保存三个月以上,经检测,其中硫酸浓度约为2.625 mol/L,Mn(Ⅲ)浓度约为6.14 ×10-3mol/L。Mn(Ⅲ)的制备反应方程式为:

1.4 三价锰测定草酸的实验原理
Mn(Ⅲ)与草酸反应方程式如下:2Mn(Ⅲ)+H2C2O4=2CO2↑+2Mn(Ⅱ)+2H+
Mn(Ⅲ)在波长485 nm 附近有明显的吸收峰,而Mn(Ⅱ)没有吸收峰,所以当Mn(Ⅲ)被还原为Mn(Ⅱ)时,Mn(Ⅱ)不会干扰检测。
1.5 精密度的计算
精密度一般采用标准回收率来表示,计算公式如下:
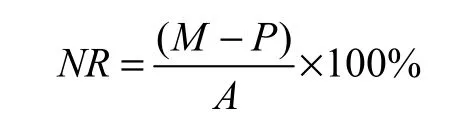
式中:NR——标准回收率;
M——样品与标准样品混合液测量结果的平均值(测量值);
P——样品溶液测量结果的平均值(本底值);
A——标准溶液加入量(加标量)。
待测样品测定其中的草酸浓度后,分别加入高、中、低 3 个不同含量的草酸标准溶液,进行加标回收实验,以计算标准回收率(回收率在 90.0%~110.0%范围内即可接受)。
2 结果与讨论
2.1 酸度对吸光度最大值处的吸收波长的影响
为了获得Mn(Ⅲ)吸光度最大值处的吸收波长,制备含有Mn(Ⅲ)浓度约为6.14 ×10-3mol/L、硫酸浓度约为2.625 mol/L 的Mn(Ⅲ)溶液,测定其350~1 000 nm 的吸光度,其吸收峰与吸光度的关系曲线如图1 所示。

图1 在2.625 mol/L 硫酸溶液中Mn(Ⅲ)的吸收光谱Fig.1 The absorption spectra of the Mn (Ⅲ) -(6.2 × 10-3 M) with H2SO4 -(2.625 M)
从图1 可看出,Mn(Ⅲ)的吸收波长存在一个平展的“峰顶”,不是某一固定值,即存在一个波长范围。Mn(Ⅲ)的吸收峰“峰顶”中心波长为485 nm,峰顶范围为481~489 nm。吸光度最大值的吸收波长范围由一个中心及其左右约4 nm 构成,故选择485 nm 波长作为作Mn(Ⅲ)标准曲线的吸收波长。
王金凤等[9]研究发现,随着酸度的增加,Mn(Ⅲ)溶液吸收波长发生红移,随着酸度的减小,Mn(Ⅲ)发生吸收波长蓝移,故在不同硫酸浓度的条件下Mn(Ⅲ)的吸光度最大值的波长范围存在一定偏差。而在实际配置Mn(Ⅲ)的检测溶液时中我们发现,由于温度、浓硫酸的产品批次、操作误差等使用相同操作配制出硫酸浓度仍会存在着±0.15 mol/L 的误差,固定样品体积可以消除加入样品体积带来的误差,为了进一步减小因配制Mn(Ⅲ)溶液时硫酸浓度带来的测量误差,我们探究了硫酸浓度对Mn(Ⅲ)中心吸收波长的影响,配制不同硫酸浓度(1.75~8 mol/L)的Mn(Ⅲ)溶液[Mn(Ⅲ)≈2.3 × 10-3mol/L]测定其吸收峰中心波长以及485 nm 处的吸光度,结果如图2 所示。
从图2 中可以看出,硫酸浓度在1.75~3.25 mol/L 范围内,Mn(Ⅲ)中心吸收波长缓慢向右移动波动不大,当硫酸浓度>3.25 mol/L后中心吸收波长迅速向右移动波动大,并且硫酸浓度>2.5 mol/L 时可保持Mn(Ⅲ)溶液在常温下较长时间的稳定[9],故选定 2.25~3.25 mol/L 范围内研究硫酸浓度对485 nm Mn(Ⅲ)溶液的吸光度的影响。在2.75~3.25 mol/L范围内吸光度偏差约为±4.5‰,而在 2.25~2.75 mol/L 范围内,偏差约有±1.21‰,在操作误差范围内,不影响测量结果。同时考虑到配置量取的简便性,故选择2.625 mol/L 作为制备Mn(Ⅲ)溶液的目标硫酸浓度。
2.2 溶液中Mn(Ⅲ)与草酸完全反应所需时间的确定
配制硫酸浓度分别为 2、2.5、2.75、3、3.5 mol/L 的Mn(Ⅲ)溶液(其中Mn(Ⅲ)≈4.605 × 10-3mol/L),分别量取5 mLMn(Ⅲ)溶液与100 μL 0.05 mol/L 草酸充分混合放入比色皿中进行测量,测定Mn(Ⅲ)与草酸反应过程中Mn(Ⅲ)485 nm 处吸光度随时间变化的曲线,结果如图3 所示。
从图 3 可以看出,在硫酸浓度为 2~3.5 mol/L 范围内,Mn(Ⅲ)吸光度随时间的延长迅速下降,说明Mn(Ⅲ)氧化破坏草酸速度快。虽然Mn(Ⅲ)吸光度达到稳定的时间随酸度升高略有升高,但都在60 s 以内达到稳定,故取60 s 为测定Mn(Ⅲ)吸光度前的等待反应时间。
2.3 标准曲线和相关参数
检测草酸时,需要量取一定量含有草酸的样品加入到定量的Mn(Ⅲ)溶液中,当样品中c(H2C2O4)>10-3mol/L 时,取样100 μL 加入5 mL 的Mn(Ⅲ)溶液中即可准确测量,依此建立标准曲线即可。但当c(H2C2O4)≤10-3mol/L,100 μL 取样量中的草酸过低,引起Mn(Ⅲ)溶液的吸光度变化小,操作误差及仪器精准度对测量结果的准确度影响大,若要测量10-3mol/L≥c(H2C2O4)≥10-4mol/L 范围内的样品,则需提高样品溶液的加入量,故需对不同草酸浓度范围建立不同的标准曲线。
2.3.1c(H2C2O4)≥10-3mol/L 范围内的标准曲线
取9 支试管,依次向每支试管中加入5 mL Mn(Ⅲ)溶液,然后再向每支试管加入100 μL浓度分别为0.1 mol/L、0.09 mol/L、0.08 mol/L、0.07 mol/L、0.06 mol/L、0.05 mol/L、0.04 mol/L、0.03 mol/L、0.02 mol/L、0 mol/L 的的草酸样品溶液,反应90 s,立即放入比色皿中,在波长485 nm 处检测不同草酸浓度下的吸光度,对应的标准曲线如图 4 所示。这是样品中0.057 5 mol/L≥c(H2C2O4)≥10-3mol/L 所适用的标准曲线,当样品中草酸浓度过高时需稀释一定倍数再进行测量。

图4 Mn(Ⅲ)-草酸的标准曲线(样品中c(H2C2O4)≥10-3 mol/L)Fig.4 The standard curve of Mn (Ⅲ)-oxalic acid for c(H2C2O4)≥10-3 mol/L
2.3.2c(H2C2O4)≥10-3mol/L 范围内的回收率和精密度
取c(H2C2O4)=1 mmol/L 被测样品9 份,分别加入1 mmol/L、2 mmol/L、4 mmol/L 的草酸标准溶液,分别配制了 0.01 mol/L、0.005 mol/L、0.001 mol/L 的草酸溶液,每种浓度下检测4 次,计算测定结果的回收率,结果列于表1。而由表1 数据可知,加标回收率为99.82%~100.19%,平均回收率为100.008 8%,在可接受的范围内,说明该分析方法的准确度高,系统误差较小。

表1 加标回收试验结果(n=4)Table 1 Results of the recovery tests (n=4)
配制下限浓度为1 mmol/L 的草酸溶液,检测10 次,计算测定结果的相对标准偏差RSD,测试结果列于表2 所示。由表2 可知,下限浓度测定结果的相对标准偏差均小于1%,说明该方法的精密度高,系统误差小。

表2 方法的精密度试验结果Table 2 Results of the precision test
2.3.3 (10-3mol/L≥c(H2C2O4)≥10-4mol/L)范围内的标准曲线
取9 支试管,依次向每支试管加入4 mL 的Mn(Ⅲ)溶液,然后再往每支试管中加入1 mL浓度分别为0.01 mol/L、0.009 mol/L、0.008 mol/L、0.007 mol/L、0.006 mol/L、0.005 mol/L、0.004 mol/L、0.003 mol/L、0.002 mol/L、0 mol/L 的草酸样品溶液,反应90 s,立即放入比色皿中,在波长485 nm 处检测不同草酸浓度下的吸收度,对应的标准曲线如图5 所示。
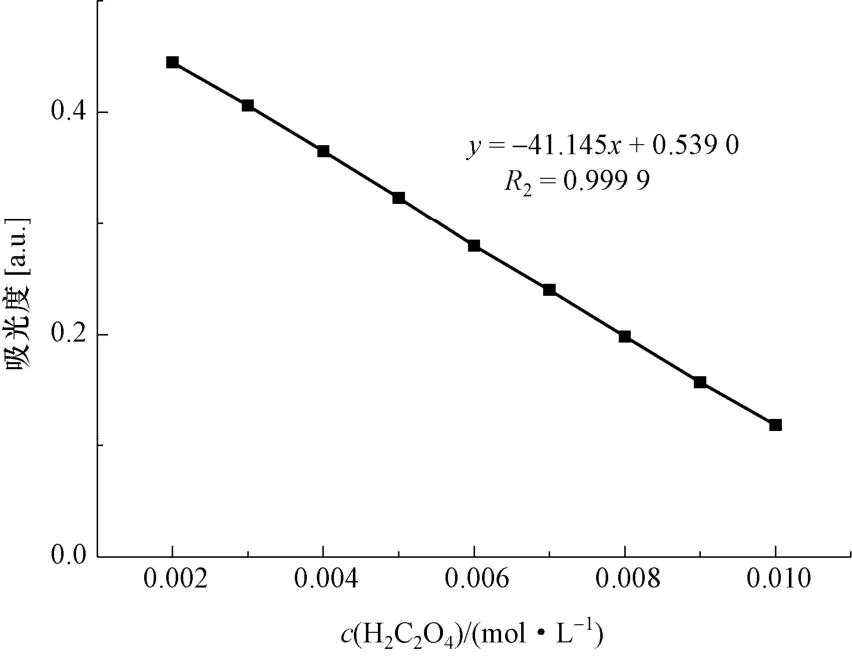
图5 Mn(Ⅲ)-草酸的标准曲线(样品中10-3 mol/L≥c(H2C2O4)≥10-4 mol/L)Fig.5 The standard curve of Mn (Ⅲ)-oxalic acid for 10-3 mol/L≥c(H2C2O4)≥10-4 mol/L
2.3.4 (10-3mol/L≥c(H2C2O4)≥10-4mol/L)范围内的回收率和精密度
取c(H2C2O4)=100 μmol/L 被测样品9 份,分别加入100 μmol/L、200 μmol/L、400 μmol/L的草酸标准溶液,每种浓度下检测测试4 次,计算测定结果的回收率,测试结果如表3 所示。
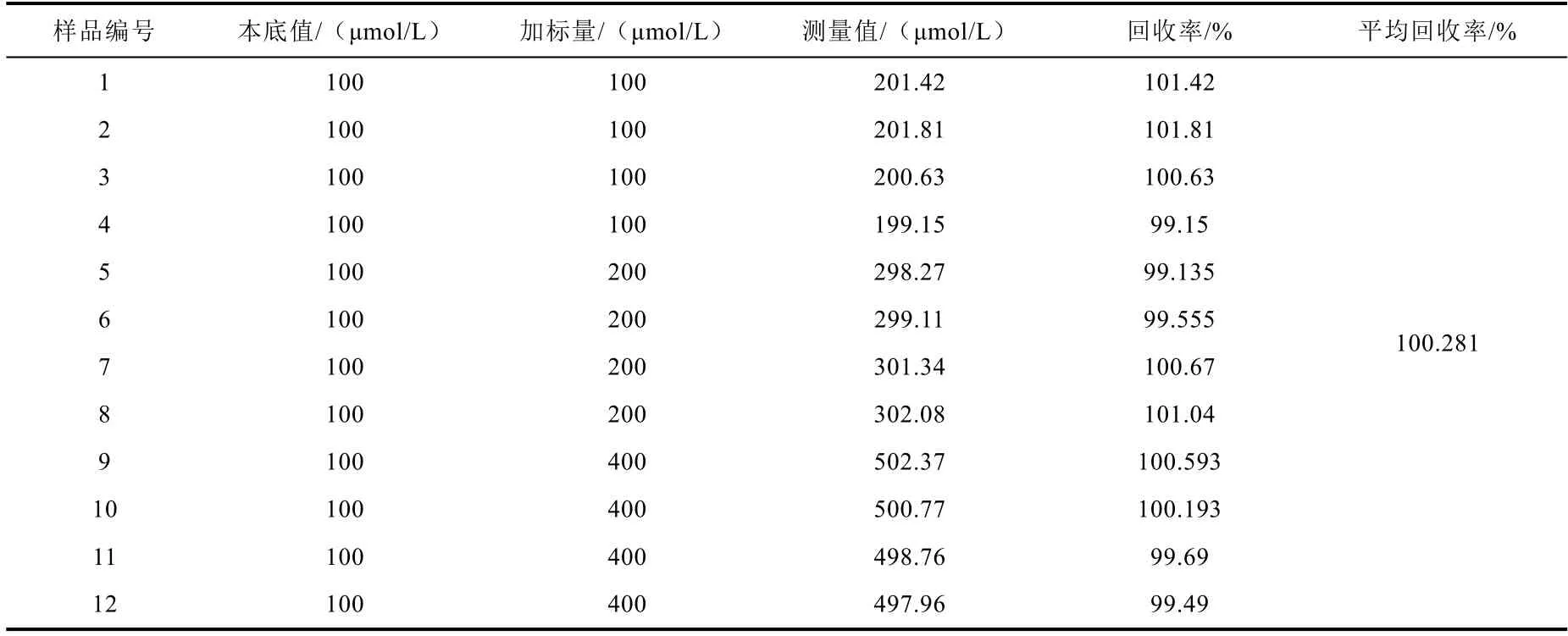
表3 加标回收试验结果(n=4)Table 3 Results of the recovery rest (n=4)
由表 1 可知,加标回收率为 99.15%~101.81%,平均回收率为100.281%,在可接受的范围内,说明该分析方法在测量10-3mol/L≥c(H2C2O4)≥10-4mol/L 时的准确度较高,系统误差较小。但是随着被测溶液浓度的降低,准确度逐渐变差,这是由于在分析低浓度草酸溶液时操作误差会逐渐显现。
配制下限浓度为100 μmol/L 的草酸溶液,测试 10 次,计算测定结果的相对标准偏差RSD,测试结果列于表4。由表4 可知,下限浓度测定结果的相对标准偏差均小于2%,在可接受的范围内,说明该方法的精密度较高,系统误差较小。
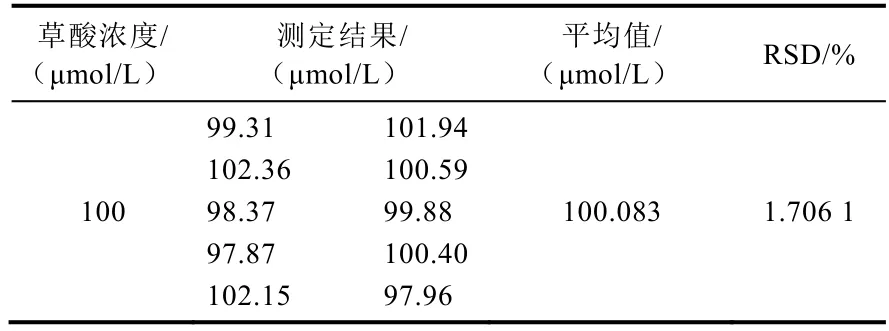
表4 方法的精密度试验结果Table 4 Results of the precision test
2.4 硝酸对Mn(Ⅲ)吸收波长的影响
在后处理厂中草酸样品溶液中一般会含有硝酸,其酸度范围是1~8 mol/L,所以需要研究含有硝酸的样品是否适用该检测方法,即探究硝酸对Mn(Ⅲ)吸收波长的影响。将4 mL的Mn(Ⅲ)溶液与1 mL 浓度分别为8 mol/L、6 mol/L、3 mol/L、1 mol/L、0 mol/L 的硝酸充分混合均匀,将该混合溶液放入比色皿中,在波长485 nm 出检测其吸光度,结果如图6 所示。
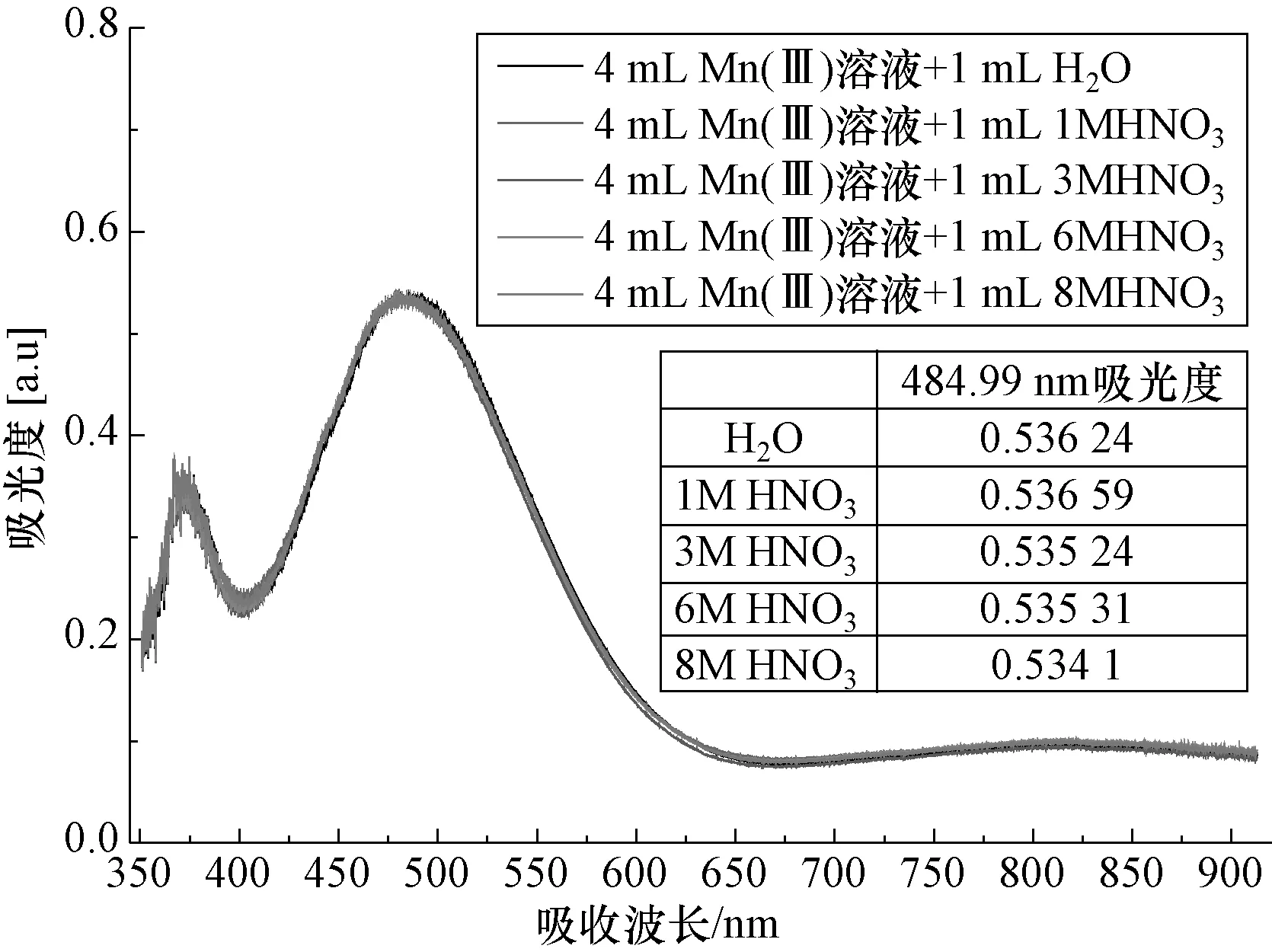
图6 Mn(Ⅲ)溶液与不同浓度硝酸混合后吸收光谱的变化Fig.6 The spectra of 4 ml Mn (Ⅲ) solution mixed with 1 ml of nitric acid with different concentrations
从图6 中可以看出,4 mL 的Mn(Ⅲ)溶液与1 mL 硝酸(0~8 mol/L)混合后,混合溶液中的硝酸对Mn(Ⅲ)吸收波长及吸光度影响不大,在1~8 mol/L 范围内,吸光度偏差约有±4‰,存在一定影响,但对测量结果影响在正常误差范围内,可以接受。说明此方法适用于含有高浓度硝酸的草酸样品。
3 结论
(1)Mn(Ⅲ)溶液在常温稳定存在的最适硫酸浓度为2.625 mol/L,检测草酸吸收波长为485 nm,检测草酸前反应时间为60 s。
(2)样品中0.057 5 mol/L≥c(H2C2O4)≥10-3mol/L 时,硫酸浓度约为2.625 mol/L 的Mn(Ⅲ)溶液与样品溶液体积比为50:1 时,吸光度A与草酸浓度间的回归方程为c(H2C2O4)=(0.677 1 -A)/4.327 7 相关系数R2=0.999 9,该方法应用于实际样品测定时,平均回收率为100.009%,c(H2C2O4)=10-3mol/L 测定结果的相对标准偏差为0.637 8%(n=10),当样品中c(H2C2O4)≥0.057 5 mol/L 稀释一定倍数再进行测量即可。
(3)样品中 10-3mol/L≥c(H2C2O4)≥10-4mol/L 时,硫酸浓度为2.625 mol/L 的Mn(Ⅲ)溶液与样品溶液体积比为4:1 时,吸光度A与草酸浓度间的回归方程为c(H2C2O4)=(0.539 0 -A)/41.145 相关系数R2=0.999 9,该方法应用于实际样品测定时,平均回收率为100.281%,c(H2C2O4)=10-4mol/L 测定结果的相对标准偏差为1.706 1%(n=10)。
(4)硝酸对Mn(Ⅲ)吸收波长无影响。
