低酸牛肉发酵剂的筛选、工艺优化及品质特性研究
2022-10-17杨晓钢赵鑫锐堵国成
杨晓钢,赵鑫锐,2,3,堵国成,2,3*
1(江南大学 生物工程学院,江苏 无锡,214122)2(江南大学 未来食品科学中心,江苏 无锡,214122) 3(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
发酵剂是具有特定酶活性的单独或混合的菌株配方,肉用发酵剂是能够在肉制品中自我繁殖的活性微生物,它们可以保持肉制品的鲜度,控制肉制品卫生安全,增强其可接受性[1]。在肉制品中添加发酵剂还具有降胆固醇、降生物胺、抗氧化等功能特性,同时可以产生促进碳水化合物、蛋白质和脂肪分解的酶类,赋予发酵肉良好风味。自然发酵肉制品存在着品质不稳定、生产易受环境制约且生产周期长等缺点。采用接种发酵剂的方法发酵牛肉,可以提高产品的品质和安全、确保产品独特风味的形成。牛肉富含脂类、蛋白质、矿物质和B族维生素等营养成分,是人们膳食中常见的肉类品种。随着生活质量的提高,消费者对牛肉制品的要求也越来越高,迫切需要研制营养均衡、风味独特的中高档牛肉制品。因此制备一款能产生良好风味、适用于发酵牛肉的发酵剂具有重要的意义。
目前欧美国家对微生物发酵肉制品的特性进行了较为深入的研究,已经完成了从传统的自然发酵向微生物定向接种发酵的工业化生产的转变,发酵肉制品的生产工艺已相当成熟[2]。我国发酵肉制品行业起步较晚,国内的发酵肉制品开发目前还主要停留在实验室阶段,市面产品较少。发酵剂中的乳酸菌利用碳水化合物生成的乳酸和少量的乙酸、甲酸、琥珀酸等,可在抑制腐败菌生长同时赋予发酵肉特殊的香味[3]。葡萄球菌与肉制品色泽的形成相关,而木糖葡萄球菌能够转换氨基酸和游离脂肪酸,协调风味的形成[4]。酵母菌在发酵过程中能够抑制脂肪的氧化,此外还能形成一定量的酯类和醇类改善肉制品的风味。单独使用酵母,会使氨的含量上升,而乳酸和乙酸的含量下降,从而导致pH的上升;酵母菌与乳酸菌和微球菌联合使用时,效果较好[5]。目前多数研究聚焦,单菌或两菌混合发酵肉类,张苏苏等[6]从自然发酵酸菜汁中分离出乳酸菌,将其和汉逊德巴利酵母菌混合发酵块状鹿肉并研究其发酵特性。SUN等[7]在哈尔滨干肠中接种木糖葡萄球菌和植物乳杆菌,研究其对香肠的肠杆菌数、生物胺积累量和感官品质的影响。RUIZ-MOYANO等[8]将乳酸片球菌SP979和发酵乳杆菌HL57混合作为发酵剂,进行伊比利亚发酵香肠的研制。然而对于乳酸菌、葡萄球菌和酵母菌3种菌组合发酵肉的研究报道较少。
在肉制品发酵过程中,微生物可以代谢亮氨酸生成3-甲基丁醛,3-甲基丁醛可以和含硫化合物反应,产生良好的风味。同时,3-甲基丁醛的阈值很低,对发酵肉制品的典型风味有重要影响,可以作为发酵剂菌种产香性状量化的标准。本实验从传统发酵肉制品出发,经过发酵特性试验初步筛选出符合要求的乳酸菌、葡萄球菌和酵母菌,以产3-甲基丁醛的能力为标准复筛筛选出产香菌株。再经拮抗实验,并以pH和游离氨基酸含量为标准确定最优的菌种组合以及其比例。经过单因素试验确定优化范围,以pH和感官评分为标准运用响应面法优化发酵工艺。随后,将本实验研制的发酵剂与商业发酵剂进行对比,探讨与商业发酵剂发酵的肉制品在pH、色差、游离氨基酸含量、质构和风味等方面的差异,以期为我国优良发酵剂的制备和研发提供依据和参考。
1 材料与方法
1.1 实验材料
各种来源的中国传统发酵肉制品如宣威火腿、金华火腿、皇上皇腊肠、松桂坊腊鱼、如皋火腿、四川腊肠、哈尔滨红肠、湖南烟熏腊肉、贵州酸渣肉等十余种样品,市售。商业发酵剂WBX-43、THM-17、BM-60和BM-101,上海昊岳有限公司。
1.2 培养基
MRS培养基、氨基酸脱羧酶培养基、葡萄糖产气培养基、产H2S培养基、产氨培养基、H2O2产生检测培养基、硝酸盐还原培养基、糖发酵培养基、MSA培养基、发酵葡萄糖产气培养基、硝酸盐还原酶培养基、精氨酸产氨培养基、葡萄糖蛋白胨水培养基、生长培养基、DNA酶培养基、YPD培养基等培养基配制参考王永霞[9]的方法,TTC上层培养基和TTC下层培养基配制参考许艳丰等[10]的方法。
1.3 仪器与设备
电子天平,奥豪斯仪器有限公司;可见分光光度计,岛津仪器有限公司;显微镜,上海永亨光学仪器制造有限公司;SW-CJ-2G型双人单面净化工作台,苏州净化设备有限公司;立式压力蒸汽灭菌器,致微(厦门)仪器有限公司;恒温振荡培养箱,上海一恒科学仪器有限公司;HG303-4型电热恒温培养箱,南京试验仪器厂。
1.4 实验方法
1.4.1 乳酸菌初步筛选
1.4.1.1 样品处理
在无菌环境下准确称取各样品10 g,剪碎后将各样品分别转入90 mL无菌蛋白胨水中,于摇床振荡混匀(220 r/min,1 h),随后静置5 min。取1 mL上清液接种于MRS液体培养基,37 ℃培养24 h。以2%(体积分数,下同)接种量接种到MRS液体培养基中,37 ℃培养24 h。用无菌生理盐水将培养液稀释成不同倍数的菌悬液,分别吸取0.2 mL菌悬液均匀涂布于MRS鉴别培养基,37 ℃培养48 h,挑取变为黄色的单菌落,随后将单菌落在MRS固体培养基上划线分离纯化2次,得到纯菌落。将筛选出来的菌株进行革兰氏染色和镜检,将革兰氏阳性的菌株进行16S rRNA测定,筛选出乳酸菌。将筛选出的乳酸菌接种到MRS固体试管斜面,于4 ℃保藏。
1.4.1.2 乳酸菌发酵特性试验
将筛选得到的乳酸菌进行产黏性试验、产H2O2试验、产氨试验、葡萄糖产气试验、产H2S试验、硝酸盐还原能力试验、氨基酸脱羧酶实验、耐盐性实验和耐亚硝酸盐实验,参考卢士玲[11]的方法进行实验。
1.4.2 葡萄球菌初步筛选
1.4.2.1 样品处理
在无菌环境下准确称取各样品10 g,剪碎后将各样品分别转入90 mL无菌蛋白胨水中,于摇床振荡混匀(220 r/min,1 h),随后静置5 min。取1 mL上清液接种于MSA液体培养基,37 ℃培养24 h。以2%接种量接种到MSA液体培养基中,37 ℃培养24 h。用无菌生理盐水将培养液稀释成不同倍数的菌悬液,均匀涂布于MSA固体培养基上,筛选出单菌落。随后将单菌落在MSA固体培养基上划线分离纯化2次,得到纯菌落。将筛选出来的菌株进行革兰氏染色和镜检,将革兰氏阳性的菌株进行16S rRNA测定,筛选出葡萄球菌。将筛选出的葡萄球菌接种到MSA固体试管斜面,于4 ℃保藏。
1.4.2.2 葡萄球菌发酵特性试验
将筛选得到的菌株进行过氧化氢酶检测、凝固酶检测、脱氧核糖核酸酶检测、硝酸还原酶检测、发酵葡萄糖产气实验、产H2S试验、分解精氨酸检测、氨基酸脱羧酶、蛋白酶活性测定和脂肪酶活性测定实验检测,参考刘艳霞[12]的方法进行实验。
1.4.3 酵母菌初步筛选
1.4.3.1 样品处理
取各样品10 g于无菌下剪碎,将样品加入YPD液体培养基中,加入链霉素和四环素盐酸盐至终质量浓度为25 mg/L,于220 r/min 摇床,30 ℃培养24 h后,取1 mL培养液上清液,用无菌生理盐水稀释成不同的倍数,涂布于YPD固体平板培养基上于30 ℃静置培养24 h,挑取单菌落。随后将单菌落在YPD固体培养基上划线分离纯化2次,得到纯菌落。
1.4.3.2 酵母菌发酵特性试验
将筛选的菌株进行产酒精能力测定、耐盐性试验、耐亚硝酸盐试验、产香能力试验测定,参照张鹏[13]的方法进行实验。
1.4.4 初筛菌株产3-甲基丁醛能力的复筛[14]
1.4.4.1 活化培养
将菌株于液体培养基中35 ℃活化2次,然后按2%的接种量接种到100 mL培养基中,35 ℃下培养24 h,4 ℃、10 000 r/min离心10 min收集菌体,将菌体重悬于无菌生理盐水中,再次离心。重复操作1次,以洗去残余培养基。所获菌体于-20 ℃贮藏下备用。
1.4.4.2 3-甲基丁醛的生成
在已灭菌固相微萃取样品瓶中加入0.5 mL待测菌液,3 mL含有2 mmol/L亮氨酸、2 mmol/L 5′-磷酸吡哆醛、10 mmol/L α-酮戊二酸、0.067 mol/L已灭菌磷酸缓冲液(pH 6.5),反应体系共3.5 mL;对照组加入0.5 mL无菌生理盐水。35 ℃培养24 h。
1.4.4.3 3-甲基丁醛的提取
在室温下用萃取纤维头[羧基-聚二甲基硅氧烷(carboxen-polydimethylsiloxane, CAR-PDMS)]在固相微萃取样品瓶中顶空萃取15 min,随后在气谱上解吸10 min。色谱条件:载气N2,流量1.4 mL/min;毛细管色谱柱DB-1701(30 m×0.32 mm×1 μm);柱箱温度:维持38 ℃的温度2 min,然后以3 ℃/min升温到90 ℃,然后以10 ℃/min升温到220 ℃,随后保持3 min。检测器:氢火焰离子化检测器(flame ionization detector,FID);温度275 ℃。
1.4.4.4 3-甲基丁醛的鉴定和定量测定
根据3-甲基丁醛标品的保留时间来定性,根据峰面积来定量。
1.4.5 菌种拮抗实验
将复筛筛选出的3株菌用接种环挑取单菌落,不同菌株间两两依次交叉划线于MRS固体培养基平板上进行拮抗试验。35 ℃培养48 h,待长出菌落后,观察菌株划线的交叉处是否生长菌落。如试验菌落不能在交叉处生长,说明菌间有拮抗作用;反之则无拮抗作用,可用于发酵。
1.4.6 发酵牛肉工艺流程
参考李疆[15]的方法并稍作修改,选用检验合格的牛里脊肉,剔除筋膜和脂肪后,切成500 g左右的小块,立即浸入准备好的凉水中,除去残余血液,大约浸泡1 h左右,中间换水2次。浸泡后沥干,漂煮10 min,漂煮后的牛肉经切块(顺纤维,20 g,5 cm×2 cm×1.5 cm)、发酵(注射)、烘烤(55~60 ℃,3~4 h)、杀菌(115 ℃灭菌,30 min),冷却至室温将牛肉进行真空包装即为成品。牛肉处理过程中不添加任何调味料。
1.4.7 发酵牛肉品质特性检测
pH测定参照 GB/T 9695.5—2008《肉与肉制品 pH测定》;游离氨基酸测定采用茚三酮比色法;感官评定参照庞国强[16]的方法;色差和质构检测参照付丽等[17]的方法;挥发性风味化合物检测参照周亚军等[18]的方法。
1.4.8 单因素试验设计
1.4.8.1 最适发酵组合确定
选择35 ℃为发酵温度,发酵时间48 h,接种量107CFU/g,菌种比例1∶1∶1,以pH和游离氨基酸含量为标准筛选出发酵剂最优菌种组合。
1.4.8.2 发酵组合最适发酵比例确定
选择35 ℃为发酵温度,发酵时间48 h,接种量107CFU/g,将最优发酵剂组合按着不同发酵剂菌种比例(1∶1∶1、1∶1∶2、1∶2∶1、1∶2∶2、2∶1∶1、2∶1∶2、2∶2∶1)进行发酵,以pH和游离氨基酸含量为标准筛选出发酵剂最佳菌种组合的最佳菌种配比。
1.4.8.3 响应面优化工艺范围确定
以pH和游离氨基酸含量为评价标准,确定发酵温度、发酵时间和接种量响应面优化的条件范围选择。将各实验研究因素定为变量,其他因素固定不变。不变因素为发酵温度35 ℃、接种量107CFU/g,发酵时间48 h,发酵剂菌种配比植物乳杆菌LM34∶肉葡萄球菌SAB18∶异常威克汉姆酵母YE3为2∶1∶1。
1.4.9 响应面法优化发酵工艺
为确定最优发酵工艺水平,在单因素实验的基础上,对发酵温度、发酵时间、接种量三因素进行优化组合,以pH和感官评分为响应值采用三因素三水平Box-Behnken试验优化发酵工艺参数,利用Design-Expert 8.0.6软件进行Box-Behnken实验设计,其编码水平见表1。

表1 Box-Behnken设计因素与水平Table 1 Factors and leels used in Box-Behnken design
1.4.10 与商业发酵剂发酵制品品质对比
将本实验筛选出的菌种按照最佳比例配制成发酵剂,发酵剂命名为FBS-55。将此发酵剂与4种商业发酵剂WBX-43、THM-17、BM-60和BM-101在响应面优化的发酵条件下共同发酵牛肉样品,分析比较FBS-55与商业发酵剂发酵的样品在pH、色差、游离氨基酸含量、质构和挥发性风味化合物差异。
2 结果与分析
2.1 发酵剂菌株筛选
2.1.1 发酵特性实验
从样品中共筛选出乳酸菌、葡萄球菌和酵母菌各270株。经一系列发酵特性试验(表2)共筛选出符合全部发酵特性试验要求的菌株,其中乳酸菌21株,葡萄球菌9株,酵母菌12株。经16S rRNA菌株鉴定后,21株乳酸菌中15株为植物乳杆菌(Lactobacillusplantarum),6株为戊糖乳杆菌(Lactobacilluspentosus);9株葡萄球菌皆为肉葡萄球菌(Staphylococcuscarnosus);12株酵母菌中,5株为近平滑假丝酵母(Candidametapsilosis),7株为异常威克汉姆酵母(Wickerhamomycesanomalus)。其中植物乳杆菌、戊糖乳杆菌和肉葡萄球菌为一般认为安全(Generally Recognized As Safe,GRAS)的食品级菌株,异常威克汉姆酵母可用于酸面团的发酵[19],而近平滑假丝酵母为非食品级菌株,因此仅选择除近平滑假丝酵母外的37株菌用于低酸牛肉发酵剂的筛选。

表2 分离菌株主要发酵特性Table 2 The main fermentation characteristics of the isolates
2.1.2 产3-甲基丁醛实验结果
对发酵特性实验所筛选得到的菌株产风味物质3-甲基丁醛的能力的大小进行检测。由表3可知,葡萄球菌产3-甲基丁醛能力较强,乳酸菌和酵母菌产3-甲基丁醛能力较差,这与王海燕等[14]的研究结果一致。挑选出3-甲基丁醛产量最高的乳酸菌、葡萄球菌和酵母菌各3株,分别为植物乳杆菌LRS3、LRS50和LM34;肉葡萄球菌SAB18、SAB113和SAB25;异常威克汉姆酵母YE3、YE10和YE15。

表3 不同菌株的3-甲基丁醛产量Table 3 Production of 3-methyl-butanal by different strains
2.1.3 拮抗实验
将3种菌两两交叉划线涂布培养,共27个组合每组3个平行。当2种菌的相交处没有出现抑菌圈,说明2种菌之间不存在拮抗作用。统计结果可知,27个组合之间均未出现抑菌圈,3种菌株两两之间不存在拮抗作用,可用于发酵剂配制。
2.1.4 最佳菌种组合确定
不同组合发酵牛肉的pH和游离氨基酸含量见表4。游离氨基酸含量最高的3组为第5组、第19组和第21组,其游离氨基酸均>1 000 mg/kg,其中第19组的游离氨基酸含量最高,为1 174.44 mg/kg。传统上认为低酸牛肉pH≥5.50,低酸发酵在风味、营养方面都优于高酸发酵,而且从我国消费习惯来看,低酸发酵肉制品更具有市场竞争力。而pH>5.90时腐败菌会生长,导致牛肉腐败[15]。3组中,第5组pH为6.00,第19组pH为5.53,第21组pH为5.77。第19组最接近低酸发酵牛肉的酸度标准且游离氨基酸含量最高,故选择第19组即植物乳杆菌LM34、肉葡萄球菌SAB18和异常威克汉姆酵母YE3作为发酵剂菌种组合。
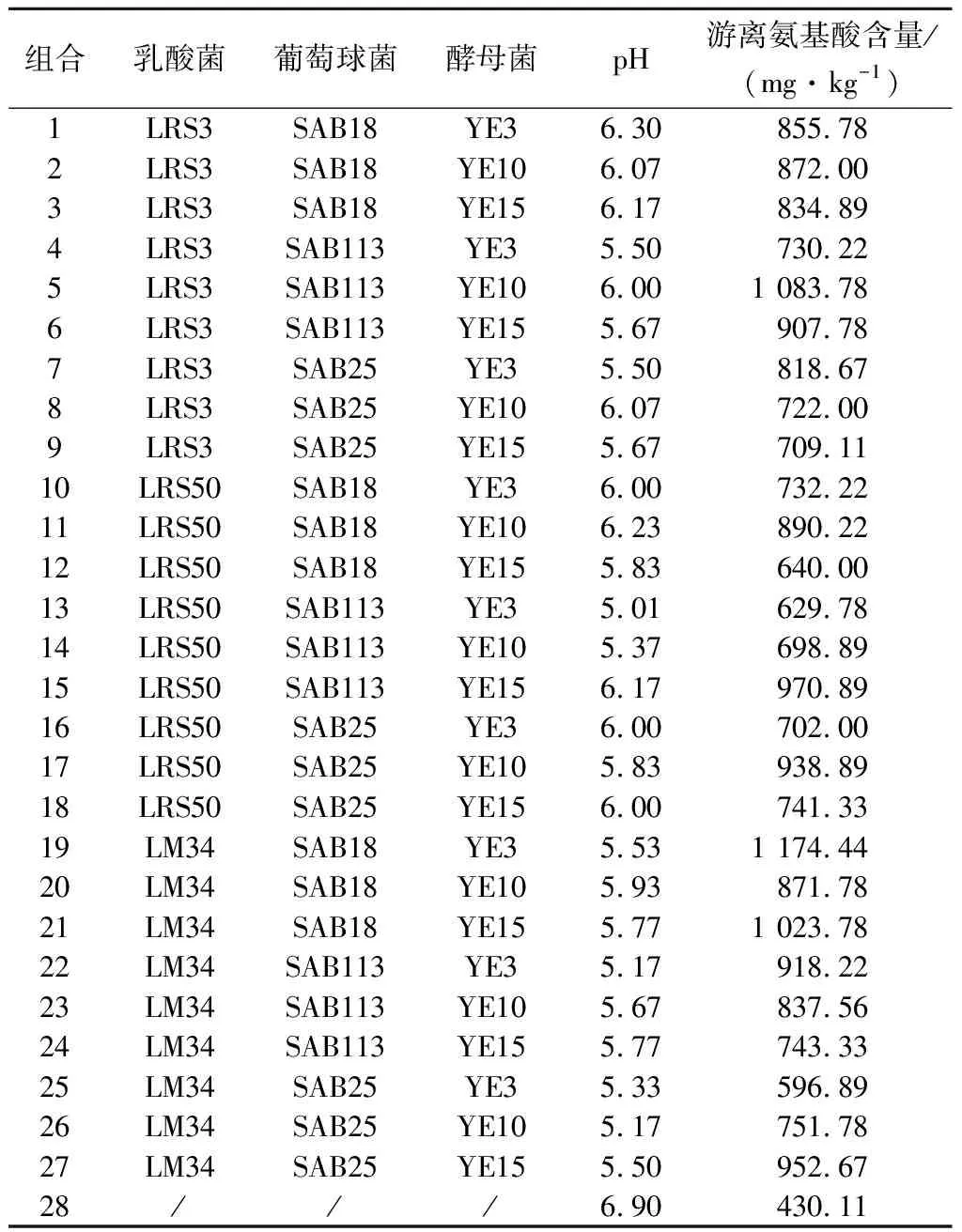
表4 不同菌种组合发酵牛肉的pH和游离氨基酸含量Table 4 pH and free amino acid contents of the different combination of strains
2.2 工艺条件优化
2.2.1 最佳配比确定
由图1可知游离氨基酸含量最高的2组菌种配比是植物乳杆菌LM34∶肉葡萄球菌SAB18∶异常威克汉姆酵母YE3为2∶1∶1和1∶1∶2,其他组游离氨基酸含量差别不大。但由于1∶1∶2组的pH值为5.93>5.90,可能会导致腐败菌生长。2∶1∶1组的pH为5.43,符合低酸牛肉标准,更适合国人口感且能抑制腐败菌生长。选择发酵剂菌种比例为植物乳杆菌LM34∶肉葡萄球菌SAB18∶异常威克汉姆酵母YE3 2∶1∶1。
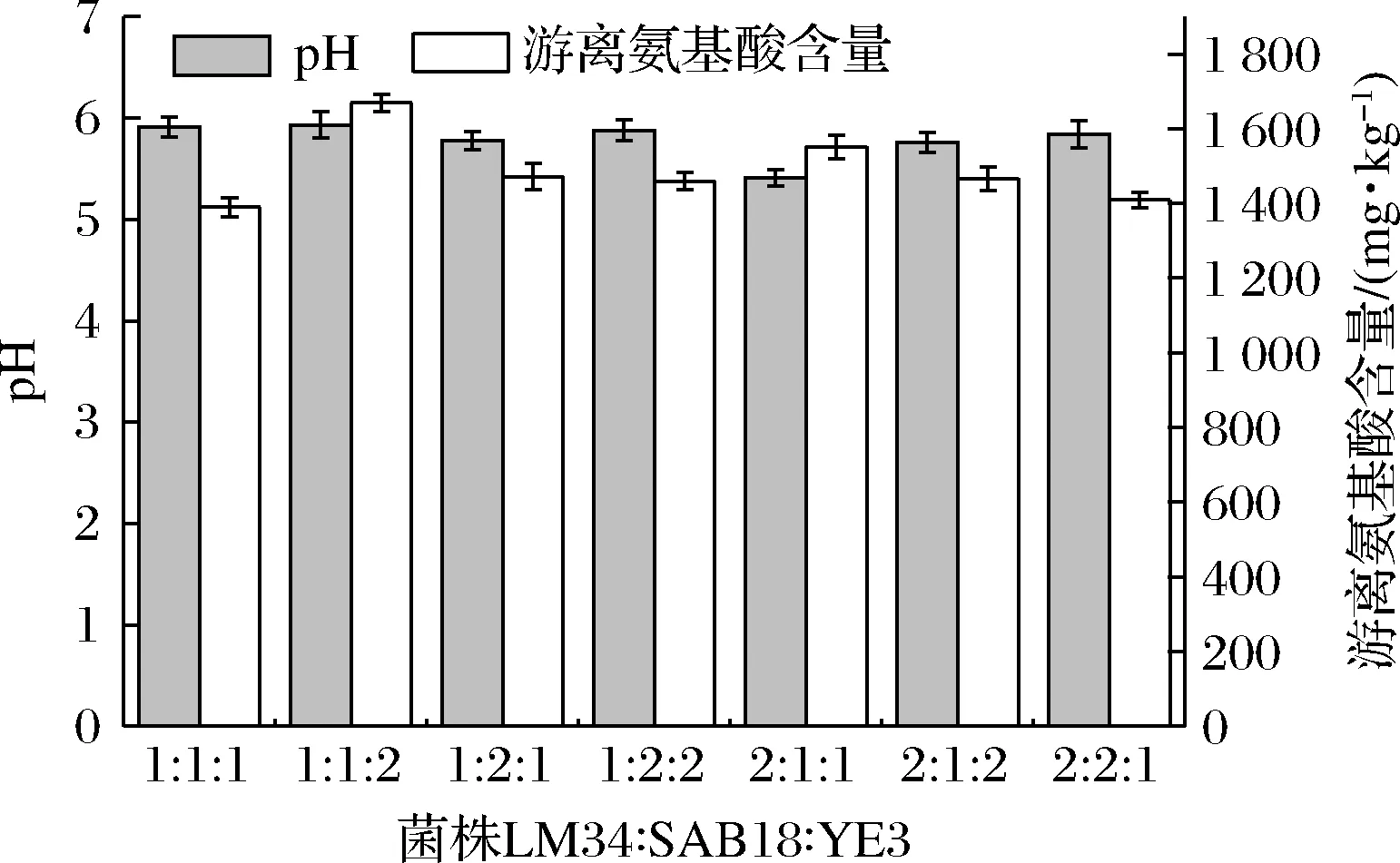
图1 发酵剂配比对牛肉pH及游离氨基酸含量的影响Fig.1 Effect of mixed starter cultures on pH and free amino acid content of fermented beef
2.2.2 发酵时间的选择
由图2可知,随着发酵时间的延长,乳酸菌大量繁殖,牛肉干pH逐渐降低,游离氨基酸含量显著提高。在发酵时间12~36 h,pH值急速下降,36 h时达到5.60,能够抑制腐败菌生长。在36 h后pH值降低速度变缓,在48 h达到5.47,符合低酸牛肉发酵标准。在48 h后pH值继续下降,到达发酵终点时pH值为5.27,可能会造成口感过酸。综合考虑,发酵时间选择18(pH 6.37)~66 h(pH 5.29)。

图2 发酵时间对牛肉pH和游离氨基酸含量的影响Fig.2 Effect of fermentation time on pH and free amino acid content of fermented beef
2.2.3 发酵温度的选择
由图3-a可知,随着发酵温度的升高,发酵牛肉的产酸速率增大。其中22 ℃组pH下降速率较小,到发酵终点时pH值为6.03,无法抑制腐败菌生长。26 ℃组在12~36 h发酵产酸速率比22 ℃组高,但明显低于其他3组。产生这样变化的原因可能是乳酸菌低温产酸能力小于高温产酸能力[20]。30、34和38 ℃发酵在12 h之前pH下降速率不大,在12 h后迅速下降,在36 h后下降速率又开始变慢,最终34和38 ℃ 2组发酵终点pH相近,均为5.10左右。由图3-b可知,随着发酵时间延长,5组游离氨基酸含量都增加,在48 h前38 ℃组的游离氨基酸含量低于34 ℃组,随后38 ℃组的游离氨基酸含量慢慢超过34 ℃组,在发酵终点时,发酵温度越高,游离氨基酸含量越高。综上,发酵温度优化范围选择26~38 ℃较为适宜。

a-pH;b-游离氨基酸含量图3 发酵温度对牛肉pH和游离氨基酸含量的影响Fig.3 Effect of fermentation temperature on pH and free amino acid content of fermented beef
2.2.4 菌种接种量的选择
由于乳酸菌分解碳水化合物生成乳酸,由图4-a可知,随着乳酸菌的接种量增大,乳酸的产量增加,pH逐渐降低。接种量为104和105CFU/g时,发酵终点的pH分别为6.43和6.18,无法抑制腐败菌生长。由图4-b可知,随接种量增加和发酵时间延长,牛肉中游离氨基酸含量逐渐增加。这与CANDOGAN等[21]的研究一致。因此接种量选择106~108CFU/g较为适宜。

a-pH;b-游离氨基酸含量图4 接种量对发酵牛肉pH和游离氨基酸含量的影响Fig.4 Effect of inoculum size on pH and free amino acid content on fermented beef
2.3 响应面优化发酵工艺
2.3.1 Box-Behnken试验设计及结果
Box-Behnken试验设计及结果见表5。试验共17个试验点(零点5个、析因点12个),A、B、C三因素所构成三维顶点为自变量值。pH值和感官评分为响应值,所得数据由Design-Expert 8.0.6软件回归分析。
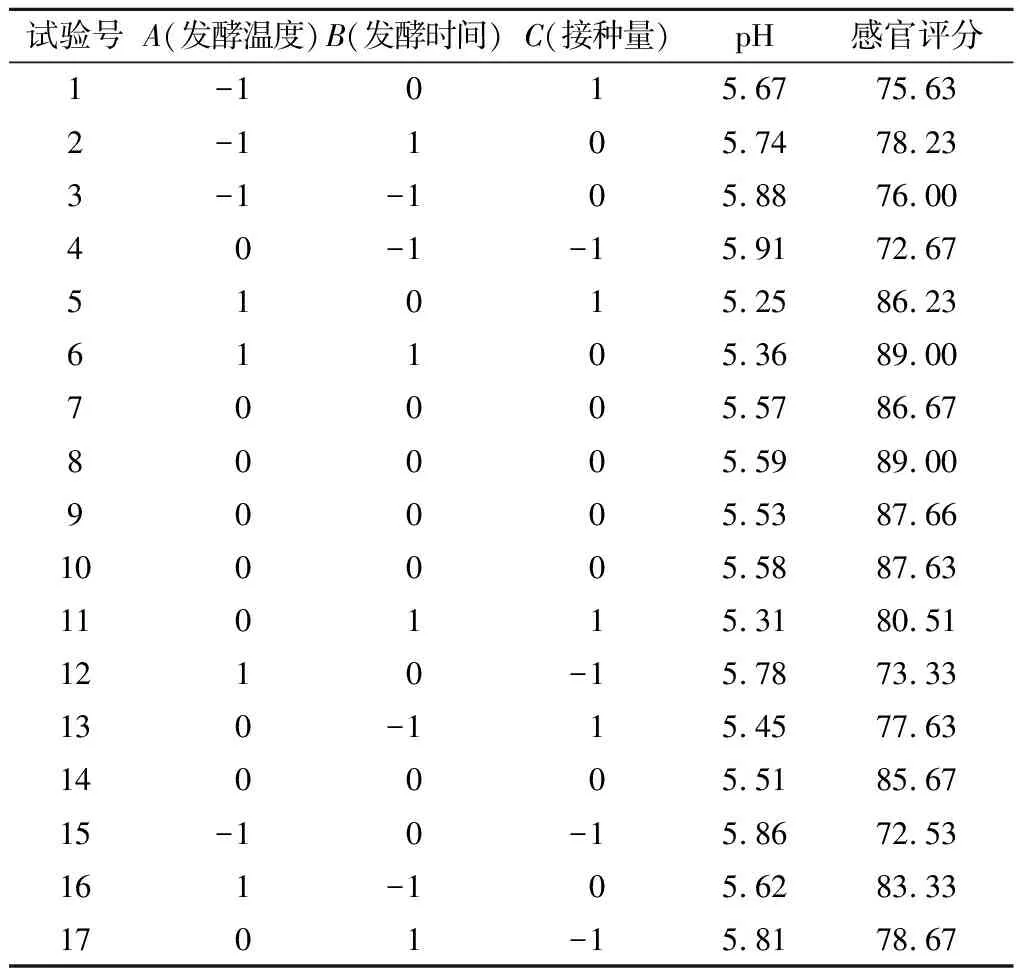
表5 Box-Behnken试验设计方案及结果Table 5 Box-Behnken design and results
2.3.2 响应面优化结果分析
pH响应面模型F值为19.31、P为0.000 4,失拟项F为3.52、P为0.127 8>0.05,变异系数为2.21%;感官评分响应面模型F值为27.63、P为0.000 1,失拟项F为3.63、P为0.122 5>0.05,变异系数为0.89%。2个实验模型回归极显著,失拟合相对于纯误差不显著、模型建立有效,试验精密度及可靠性较高。由图5可知对pH值影响的因素由大到小为:接种量>发酵温度>发酵时间;对感官评分影响的各因素从大到小依次为:发酵温度>接种量>发酵时间(图6)。在Design-Expert 8.0.6软件中,Optimization设定感官评价为Maximize,pH为5.40~5.70,得到的最优发酵条件组合是发酵温度35.87 ℃,发酵时间48.18 h,接种量1.32×107CFU/g。其pH预测值为5.43,感官评价得分预测值为89.33。经发酵验证试验后测得发酵牛肉干pH值为5.48,感官评价得分为87.67,得分与预测值相近,表明本研究确定的工艺可行度高,发酵剂可用于牛肉的发酵,将此发酵剂命名为FBS-55。

a-发酵温度和发酵时间;b-发酵温度和接种量;c-发酵时间和接种量图5 各因素对牛肉pH影响的等高线图和响应面图Fig.5 Response surface and contour plots showing the effect fermentation conditions on the pH of fermented beef

a-发酵温度和发酵时间;b-发酵温度和接种量;c-发酵时间和接种量图6 各因素对牛肉感官评分影响的等高线图和响应面图Fig.6 Response surface and contour plots showing the effect of fermentation conditions on the sensory ealuation score of fermented beef
2.4 与商业发酵剂发酵制品品质对比
2.4.1 pH对比
由图7可知BM-60和THM-17两组发酵剂发酵牛肉所得的牛肉pH值相近,分别为5.25和5.27,FBS-55和BM-101两组发酵剂发酵牛肉所得pH值相近分别为5.51和5.56,WBX-43发酵牛肉pH最低为5.04。5组发酵剂均能抑制腐败菌生长,但发酵剂WBX-43发酵的牛肉由于pH过低,可能会造成口感偏酸。最符合低酸牛肉的标准的两组是发酵剂FBS-55和发酵剂BM-101。

图7 不同发酵剂的发酵牛肉pHFig.7 pH of fermented beef with different starters
2.4.2 色泽对比
由表6可知THM-17、BM-101和FBS-55三组发酵剂的样品L*差别不显著(P<0.05),WBX-43组L*明显低于BM-60。FBS-55的样品红度值a*明显高于其他组发酵剂,WBX-43和FBS-55组的黄度b*小于其他组,其余3组差别不大。在发酵牛肉干制作过程中,对色泽影响最关键的是红度值a*,但黄度值b*和亮度值L*对其也有一定的影响[22]。因此参考段艳[23]的方法引入影响参数E值作为衡量、评价牛肉色的主要参数。由表6可知FBS-55的E值高于其余发酵剂组。综合以上结果,在发酵牛肉干整个制作过程中,FBS-55发酵剂组的红度值a*和E值显著高于其他3组(P<0.05)。说明添加FBS-55发酵剂可以有效地改善发酵牛肉干的色泽,使其颜色更鲜艳,更易吸引消费者。

表6 不同发酵剂发酵牛肉色度Table 6 Chroma of fermented beef by different starters
2.4.3 游离氨基酸含量差异
如图8所示,5组发酵剂中游离氨基酸含量最高的是FBS-55,BM-60游离氨基酸含量最低,其余3组游离氨基酸含量差别不大(P<0.05)。游离氨基酸的含量直接影响着发酵牛肉干风味物质的形成[24]。因此采用FBS-55发酵牛肉,可能会产生更好的风味。
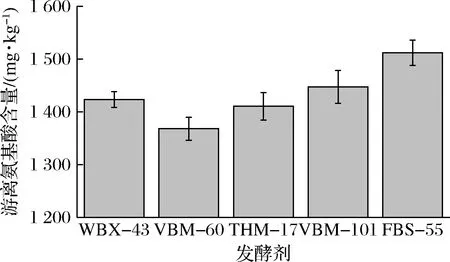
图8 不同发酵剂发酵牛肉游离氨基酸含量Fig.8 Free amino acid contents of fermented beef by different starters
2.4.4 发酵牛肉质构特性分析
在质地属性中,硬度对消费者来说是最重要的,它决定了肉类的商业价值[25]。由表7可知,BM-60组样品的硬度最高,THM-17组样品硬度最低,WBX-43、BM-101和FBS-55三组样品的硬度适宜[26]。造成发酵肉样硬度和咀嚼度不同的原因是发酵时菌种的蛋白酶作用不同,蛋白酶含量在发酵过程中增强,促使牛肉中肌浆蛋白与肌原纤维蛋白分解,破坏样品内部结合力,降低硬度和咀嚼性。THM-14和BM-101两组发酵肉黏性过大,可能会造成不良口感。5组发酵肉样的弹性之间差别不大。
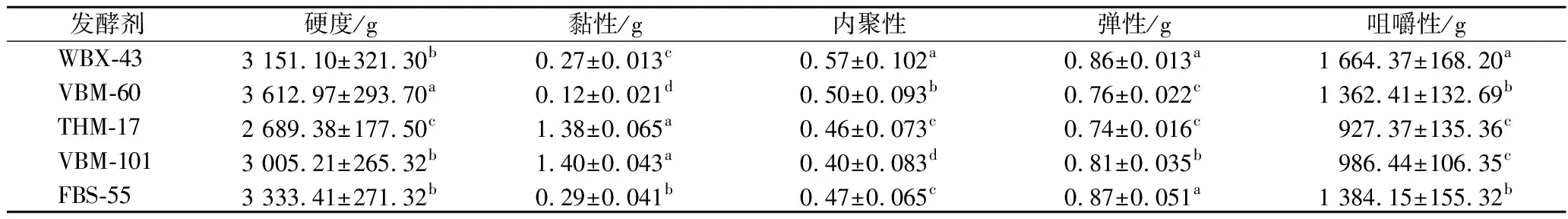
表7 不同发酵剂发酵牛肉质构参数Table 7 Texture parameters of fermented beef by different starters
2.4.5 挥发性风味物质
分离出的挥发性化合物主要以醛类和醇类化合物为主,碳氢化合物的香味阈值较高,对肉品香味形成直接贡献不大。醛类是最重要的挥发性化合物,其风味阈值较低。己醛、壬醛、癸醛等直链醛类主要是脂肪氧化降解产生的,这说明接种复合发酵剂在一定程度上促进了牛肉蛋白质和脂质氧化[18]。由表8可知,其中5组发酵剂醛类相对含量最多的是WBX-43,其中壬醛含量远高于其他组。壬醛为油酸的氧化之后的产物,具有油脂的清新味,是烧制类牛肉中常见的风味物质[27]。FBS-55组是5组中唯一含有3-甲基丁醛的样品,相对含量为2.26%。3-甲基丁醛来源于亮氨酸,与风味密切相关。此外在高浓度的酸和醇存在以及微生物酯酶活力低的情况下,它们能够进一步转化成芳香的酯类物质改善产品风味。

表8 不同发酵剂发酵牛肉主要挥发性风味物质种类及相对含量Table 8 Types and relatie contents of olatile flaor substances in fermented beef by different starters
3-甲基-1-丁醇风味阈值较低,是熟肉制品中重要的香气成分。5组发酵剂中FBS-55和THM-17发酵样品中检出3-甲基-1-丁醇,其含量分别为2.90%和0.30%。1-辛烯-3-醇被认为是产生香气的重要因素,具有蘑菇般的气味[28],FBS-55发酵样品中1-辛烯-3-醇含量较高,为6.03%。醇类中乙醇是多数酯类风味物质的合成底物,对酱类制品风味的形成起到间接重要影响。乙醇,有的被氧化生成有机酸,有的和氨基酸或有机酸等生成醋,有的部分挥发或残留在酱膠中,对发酵型酱制品的香味构成有重要的作用[29]。5组发酵中只有FBS-55组样品中检出乙醇,含量为5.11%。
吡嗪类物质是美拉德反应的中间产物,具有浓郁的烤肉香气,5组发酵剂中FBS-55和BM-101发酵样品吡嗪相对含量较高,分别为3.52%和3.01%。适量的有机酸可提高酱制品的香味和口感,除了本身呈味之外,有机酸参与酯化反应,形成酯香风味[30]。由表8可知WBX-43发酵的牛肉中含有10种酸类,相对含量为35.62%。乙酸含量为7.01%,远高于其余4组,有机酸含量过高,可能会造成不良风味。
综上所述,自主研发发酵剂FBS-55发酵的肉制品中含有3-甲基丁醛,能够产生良好风味,有机酸含量适量,有助于提高牛肉口感,同时含有熟肉肉制品中重要的香气物质3-甲基-1-丁醇和1-辛烯-3-醇。此外还含有乙醇,可以使肉制品产生良好的酱香。
3 结论
从我国传统发酵肉制品中筛选出3种菌,经过发酵特性实验的初筛和产3-甲基丁醛能力的复筛筛选出植物乳杆菌、肉葡萄球菌和异常威克汉姆酵母各3株。经过拮抗实验和最佳组合筛选实验筛选出植物乳杆菌LM34、肉葡萄球菌SAB18和异常威克汉姆酵母YE3作为发酵剂菌种。以pH和游离氨基酸为评价指标进行一系列的单因素试验,确定发酵剂菌种配比为2∶1∶1,发酵条件优化的选择范围为:发酵温度26~38 ℃、发酵时间18~66 h和接种量106~108CFU/g。以pH和感官评分为响应值采用三因素三水平Box-Behnken试验优化发酵工艺参数,优化后的参数为发酵温度35.87 ℃,发酵时间48.18 h,接种量1.32×107CFU/g。其pH预测值为5.43,感官评价得分预测值为89.33。经发酵验证试验后测得发酵牛肉干pH值为5.48,感官评价得分为87.67。
将本实验研制发酵剂FBS-55与4种商业发酵剂进行pH、游离氨基酸含量、质构、色差和风味物质的对比。自制发酵剂发酵的牛肉样品pH值适宜符合低酸牛肉标准,游离氨基酸含量较高,口感优良、软硬适中,色泽较好,同时具有良好的风味,可用于低酸牛肉的发酵。
