重组牛乳铁蛋白多肽对沙门菌抑菌作用机制研究
2022-10-17李海涛刘艳环葛冰洁周鸿缘苗利光张雪梅
李海涛 , 张 宇 , 刘艳环 , 桑 锐 , 葛冰洁 , 周鸿缘 , 王 巍 , 苗利光 , 张雪梅
(1.延边大学农学院 , 吉林 延吉 133002 ; 2.中国农业科学院特产研究所 , 吉林 长春 130112)
牛乳铁蛋白(Bovine lactoferrin,bLf)是一种铁结合糖蛋白,分子量约为80 kDa,在牛乳汁中广泛存在,尤其在牛初乳中含量较高,具有免疫调节、抗氧化、杀菌和抗肿瘤等生物活性功能[1-3]。牛乳铁蛋白广泛应用于调制乳、风味发酵乳和含乳饮料中,并且作为营养强化剂用于婴幼儿配方奶粉及食品中[4-5]。
牛乳铁蛋白的重要生物学作用之一是抗菌,其具有抑菌谱广、天然、无毒等抗菌特点,近年来被研究者广泛关注。重组牛乳铁蛋白多肽(Recombinant bovine lactoferrin polypeptide,rbLfP)是从牛乳铁蛋白分子的N-末端分离到的1条多肽[6],是经基因改造后由毕赤酵母真核表达载体分泌表达的一种重造蛋白质,具有高效广谱的抗菌活性,对动物临床常见鸡白痢沙门菌[7]、绿脓杆菌和金黄色葡萄球菌[8]等病原菌均有很好的抑菌活性,未来将会在养殖替抗应用领域有突破性研究进展。
目前,对rbLfP的研究主要集中在理化性质[9]、发酵工艺[10]、质量鉴定[9]等方面,对其抗菌机制的研究相对较少。本试验从rbLfP对沙门菌的体外最小抑菌浓度(Minimal inhibitory concentration,MIC)、细胞膜损伤作用和对细菌基因组DNA的相互作用影响等方面研究rbLfP对沙门菌抑菌的作用机制。
1 材料与方法
1.1 主要试剂 rbLfP溶液(2 000 μg/mL)由中国农业科学院特产研究所兽用生物药创制技术中试平台提供;Mueller-Hinton(MH)肉汤培养基、琼脂粉,均购自北京索莱宝科技有限公司;细菌基因组提取试剂盒,购自北京全式金生物技术有限公司;PURExpressTM体外蛋白合成试剂盒,购自纽英伦生物技术(北京)有限公司。
1.2 主要仪器 MultiskanSkyHigh全波长酶标仪,赛默飞世尔科技(中国)有限公司产品;Bio-RadSynergy H1光谱仪,伯乐(上海)生命科学研究发展有限公司产品;THZ-98A恒温振荡培养箱、BPH-9402精密恒温培养,上海一恒科学仪器有限公司产品。
1.3 菌株 沙门菌选用鸡白痢沙门菌(CVCC1790),中国农业科学院特产研究所保存。
1.4 rbLfP对沙门菌体外最小抑菌浓度(MIC)测定 取rbLfP溶液,使用无菌水进行倍比稀释至浓度分别为128、64、32、16 μg/mL和8 μg/mL,备用。体外MIC的测定方法参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)标准,具体步骤:挑取过夜培养的MH肉汤琼脂平板上的沙门菌单菌落,接种于MH肉汤液体培养基中,37 ℃培养16 h,调整菌液浓度为1.0×106CFU/mL,作为菌悬液备用;向无菌96孔培养板中各加入180 μL菌悬液,每行设置样品孔和阴性对照孔,样品孔分别加入浓度为128、64、32、16 μg/mL和8 μg/mL的rbLfP稀释液20 μL,设置3个平行,同时设置3个菌悬液空白对照孔[11-12],阴性对照孔内加入20 μL无菌水。37 ℃恒温培养箱培养16 h,每隔2 h采样1次,测定OD600 nm值,无细菌生长的最低rbLfP浓度即为MIC。
1.5 rbLfP对沙门菌细胞膜的损伤作用
1.5.1 rbLfP作用沙门菌后胞外核酸和蛋白质浓度的变化 取对数生长期的沙门菌菌液,用MH肉汤液体培养基稀释至1.0×106CFU/mL,分别加入rbLfP至终浓度为1×MIC(1×MIC组)、2×MIC(2×MIC组),空白对照组(CK)加入等量的无菌水,混匀,于37 ℃保温孵育,于0、2 h和4 h取样,10 000 r/min离心10 min,取上清液于260 nm、280 nm测定其吸光度值,分析细菌胞外核酸和蛋白质浓度变化规律[13-14]。
1.5.2 rbLfP作用沙门菌后基因组DNA浓度的变化 取对数生长期的沙门菌菌液,用MH肉汤液体培养基稀释至1.0×106CFU/mL,加入rbLfP至终浓度为1×MIC(1×MIC组)、2×MIC(2×MIC组),设置空白对照组(CK),加入等量的无菌水,混匀,于37 ℃保温孵育16 h,然后使用细菌基因组提取试剂盒提取细菌基因组,于260 nm测定其吸光度值,分析基因组DNA浓度变化规律。
1.5.3 rbLfP对沙门菌细胞膜渗透性的影响 通过测定细胞膜电导率来检测rbLfP对沙门菌细胞膜渗透性的影响,按照参考文献[15]的方法进行。取在对数生长期的沙门菌,OD600 nm为0.8~1.0,使用PBS溶液清洗3次,并用PBS溶液重悬菌体使之混匀,加入rbLfP并使其终浓度为1×MIC(1×MIC组),将处理的沙门菌悬液在37 ℃、160 r/min条件下孵育培养。每隔2 h取样1次,3 000 r/min离心15 min,取上清液测定电导率值;然后加热煮沸处理20 min,3 000 r/min离心15 min,取上清液测定电导率值。设置空白对照组(CK),使用等体积去离子水代替rbLfP。
按照公式(1),用电导率值计算相对渗透率,使用相对渗透率表示细胞膜的渗透性。
K/%=(J1-J0)/(J2-J0)×100%
(1)
其中:K为采用时间的相对渗透率(%),J0为起始时间的电导率(ms/cm),J1为采样时间的电导率(ms/cm),J2为采样时间煮沸处理后的电导率(ms/cm)。
1.6 rbLfP对基因组DNA的相互作用影响
1.6.1 rbLfP对体外蛋白质合成的抑制作用 按照PURExpressTM体外蛋白合成试剂盒说明书,加入rbLfP终浓度分别为1×MIC、2×MIC、4×MIC、8×MIC和16×MIC,设置空白对照组(CK)和阳性对照组,不加S70、rbLfP的为空白对照组,不加rbLfP的为阳性对照组。反应结束后,使用酶标仪于280 nm测定其吸光度值[16]。
按照公式(2)计算蛋白合成速率,反应rbLfP对蛋白质合成的抑制作用。
ps/%=Δb/Δa×100%
(2)
其中:ps为相对蛋白质合成速率(%),Δb为rbLfP处理组吸光值曲线的斜率,Δa为阳性对照组吸光值曲线的斜率。
1.6.2 DNA凝胶阻滞试验 将生长至对数期的沙门菌10 000 r/min离心10 min,然后用PBS清洗3次,再用PBS重悬菌体,按照细菌基因组DNA提取试剂盒操作说明书进行DNA提取,使用紫外分光光度计测定OD260 nm,并用1×TE溶液稀释提取的DNA,使其浓度在OD260 nm为1.8左右[17]。取10 μL细菌基因组DNA分别与1×MIC、2×MIC的rbLfP等体积混合,设置生理盐水空白对照组(CK),37 ℃静止培养30 min。反应结束后,进行1%琼脂糖凝胶电泳,观察rbLfP与DNA相互作用后的凝胶阻滞结果。
1.6.3 荧光光谱分析rbLfP与DNA相互作用方式 参照参考文献[18-19]方法,在96孔板中加入浓度为50 μg/mL的沙门菌基因组DNA和100 μg/mL的EB溶液10 μL,然后分别加入1×MIC、2×MIC的rbLfP混匀,设置生理盐水空白对照组(CK),混合均匀后置于培养箱中37 ℃避光反应30 min。结束后,用Bio-Rad Synergy H1光谱仪在波长550~750 nm进行光谱分析。
1.7 数据处理 试验数据采用Excel 2019进行整理,采用SPSS软件进行单因素方差分析(One-way ANOVA),数据结果以平均值±标准误表示,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果
2.1 rbLfP对沙门菌体外MIC测定 将rbLfP浓度从128 μg/mL倍比稀释至8 μg/mL后作用于沙门菌,37 ℃培养16 h,每隔2 h采样1次并测定OD600 nm值。结果如图1所示,rbLfP质量浓度与OD600 nm值呈线性反比关系,随着rbLfP质量浓度变大,OD600 nm值变小,说明rbLfP质量浓度越大对沙门菌的抑制作用越强。与空白对照孔(0 μg/mL)相比,样品孔均对沙门菌生长产生了抑制作用,当rbLfP浓度为32 μg/mL时,rbLfP基本抑制了沙门菌的生长;当rbLfP浓度在32 μg/mL以上时,培养时间从4 h后,OD600 nm值越来越小,细菌繁殖受到了明显的抑制。因此,rbLfP对沙门菌体外MIC为32 μg/mL。
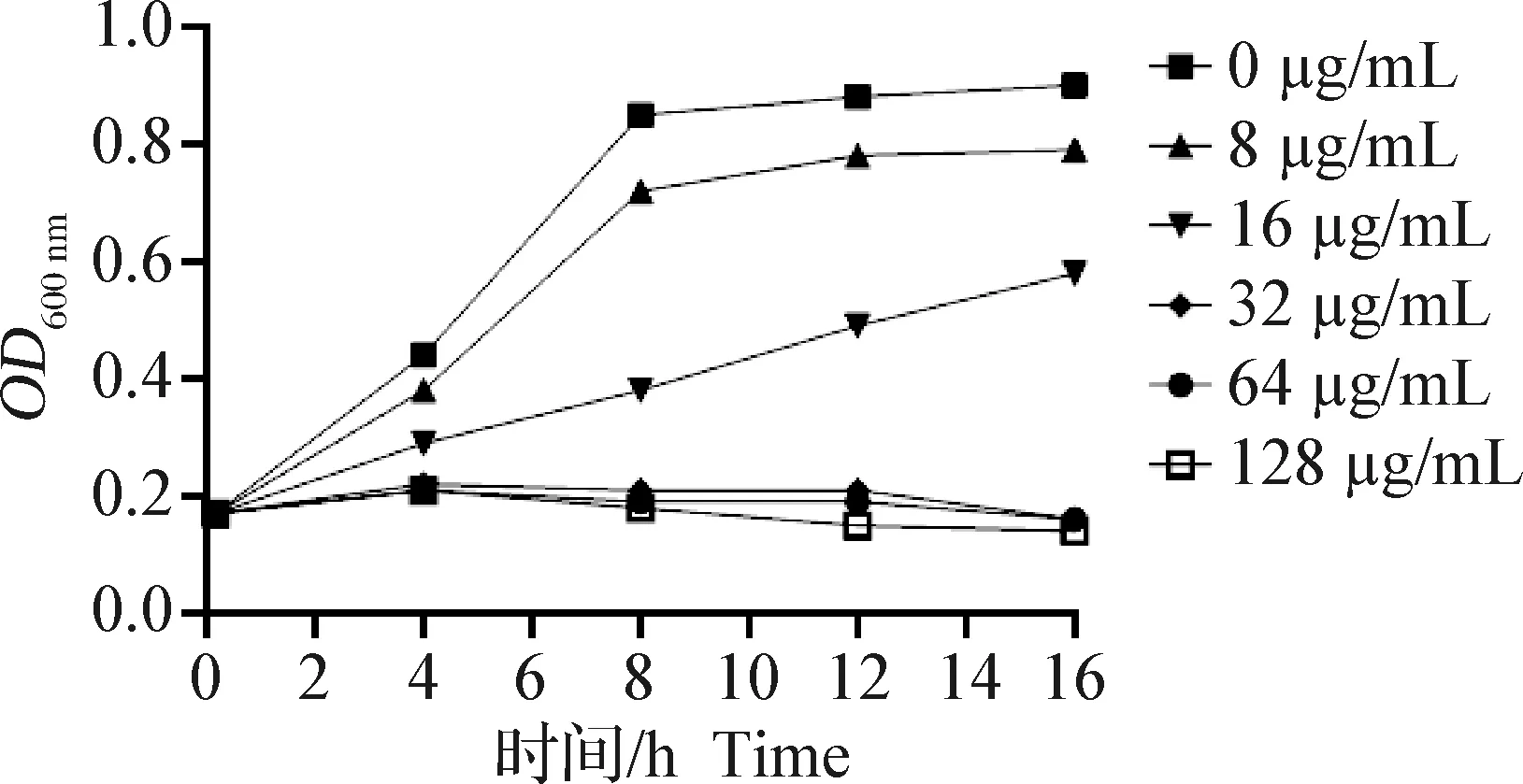
图1 rbLfP对沙门菌体外最小抑菌浓度的测定Fig.1 MIC of rbLfP against Salmonella in vitro
2.2 rbLfP对沙门菌细胞膜的损伤作用
2.2.1 rbLfP作用沙门菌后胞外核酸和蛋白质浓度的变化 结果如图2、图3所示,在1×MIC、2×MIC的rbLfP作用下培养2 h,培养液中的核酸和蛋白质含量升高,与空白对照比较差异显著(P<0.05);rbLfP作用4 h,相比培养2 h培养液中的核酸和蛋白质含量均有所升高,与空白对照组比较差异显著(P<0.05)。可见rbLfP作用于沙门菌导致细菌培养液在260 nm和280 nm吸光度有明显变化,说明细胞膜的通透性变大,细胞膜完整性受损;同时,可以观察到胞内大分子物质核酸和蛋白质透膜泄漏变化与rbLfP的浓度和作用时间呈线性正相关。结果表明,rbLfP可以改变沙门菌细胞膜的完整性,导致细胞内核酸和蛋白质外漏,从而抑制菌体正常生长和繁殖。
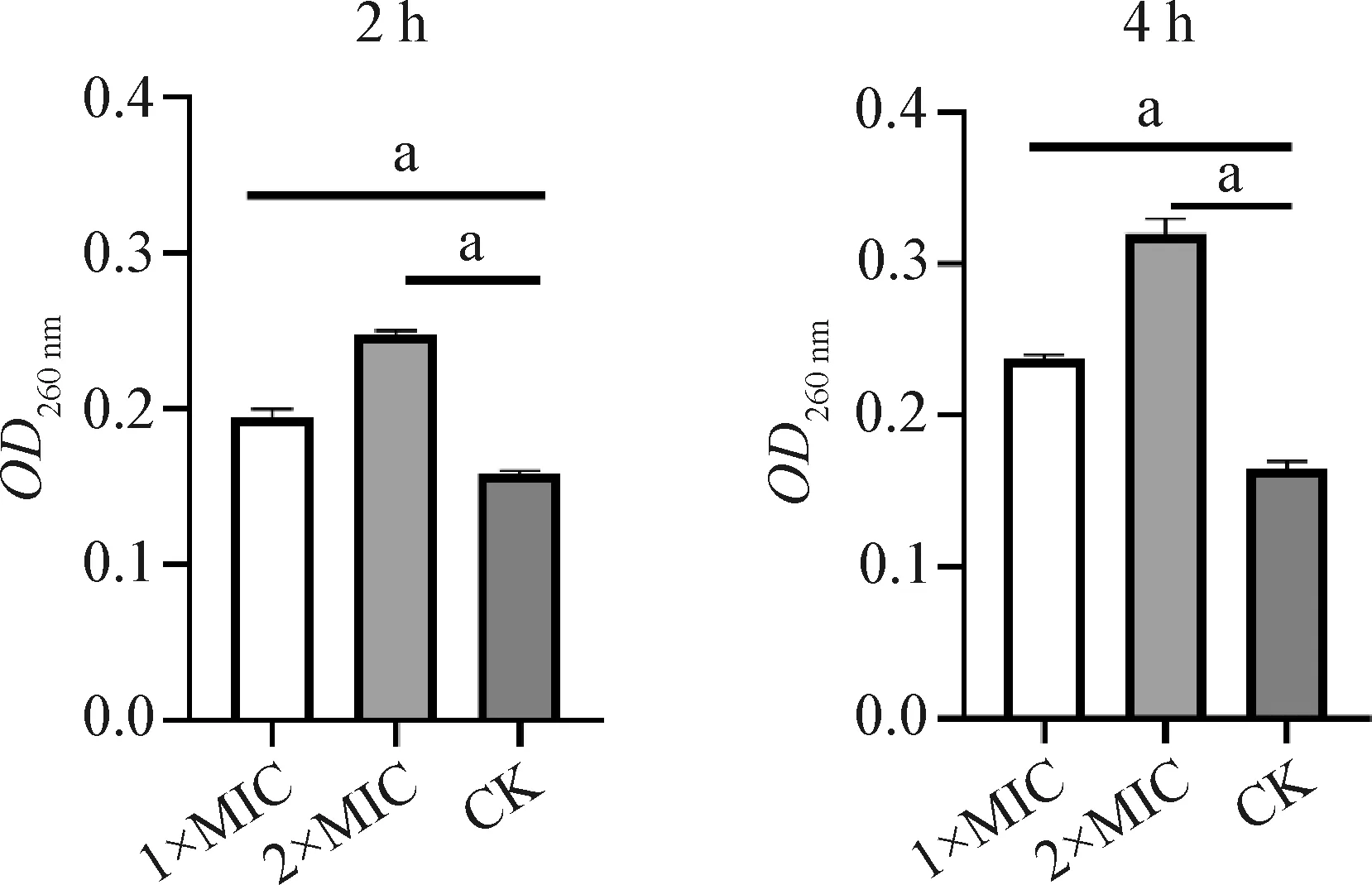
图2 rbLfP作用沙门菌后胞外核酸浓度的变化Fig.2 Concentration changes of extracellular nucleic acid of Salmonella treated with rbLfP与空白对照组比较,a:P<0.05;下图同Compared with CK group,a:P<0.05. The same as below
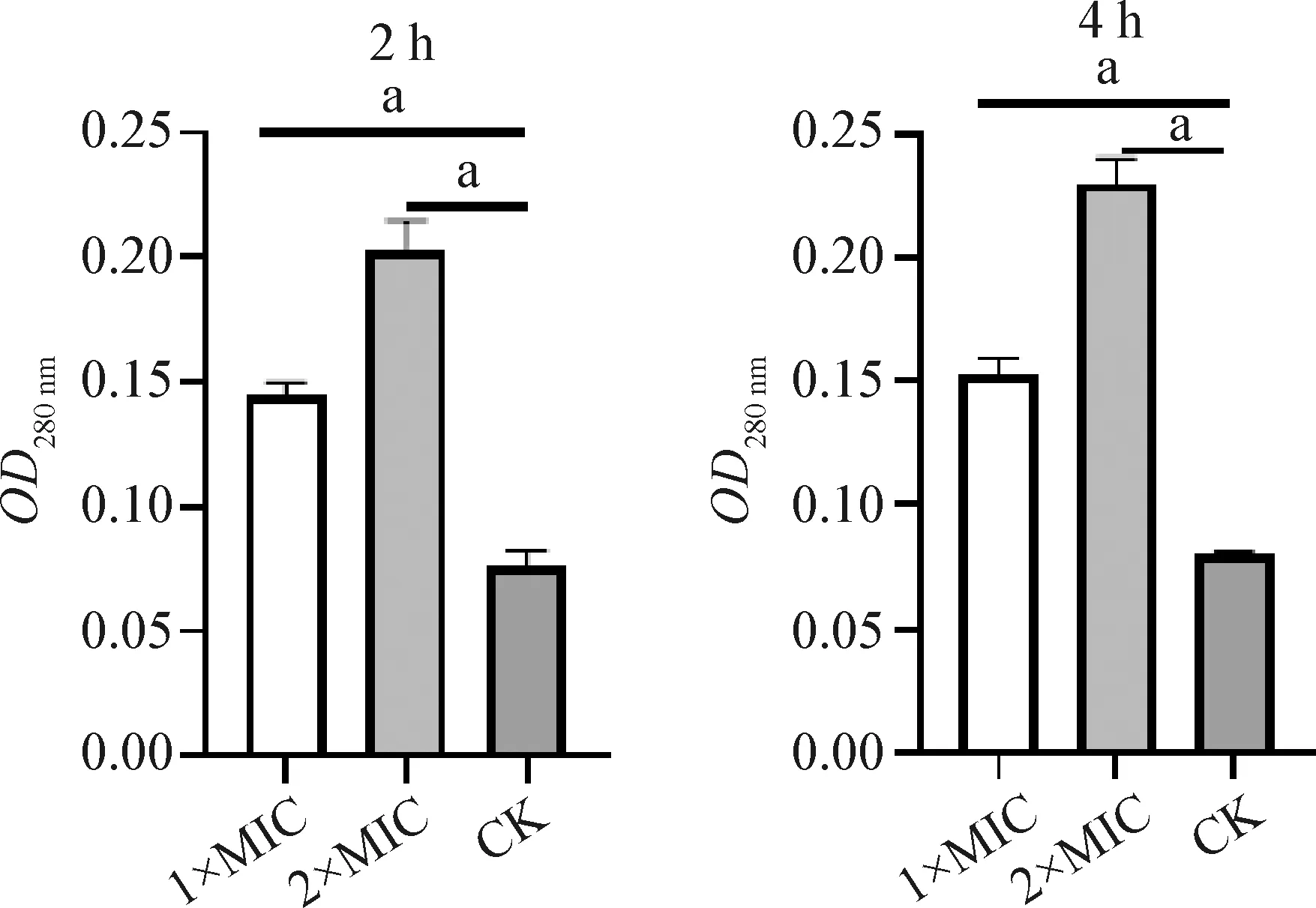
图3 rbLfP作用沙门菌后胞外蛋白质浓度的变化Fig.3 Concentration changes of extracellular protein of Salmonella treated with rbLfP
2.2.2 rbLfP作用沙门菌后基因组DNA浓度的变化 结果如图4所示,rbLfP与沙门菌共培养2 h,1×MIC组细菌基因组DNA浓度比空白对照组低,但差异不显著(P>0.05),2×MIC组细菌基因组DNA的浓度明显较空白对照组低,且结果差异显著(P<0.05);在共培养4 h时,空白对照组的细菌基因组DNA浓度明显升高,1×MIC组和2×MIC组的细菌基因组DNA浓度明显降低,与空白对照组比较差异显著(P<0.05)。随着rbLfP浓度的升高和作用时间的延长,细菌基因组DNA浓度逐渐减少,表明rbLfP对沙门菌的抑杀过程中,细菌基因组DNA的外泄与rbLfP的浓度和作用时间呈正相关。结果表明,rbLfP在一定浓度时可以有效抑制细菌基因组DNA的复制,从而起到抑菌、杀菌作用。
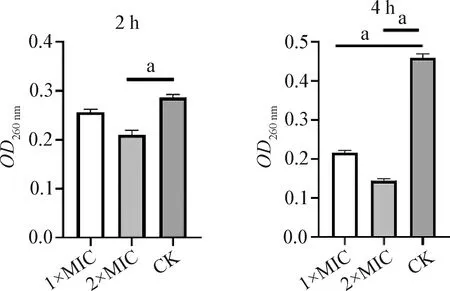
图4 rbLfP对沙门菌基因组DNA的影响Fig.4 Effects of rbLfP on genomic DNA of Salmonella
2.2.3 rbLfP对沙门菌细胞膜渗透性的影响 通过检测电导率,利用相对渗透率来表示细菌细胞膜损伤后通透性的改变。如图5所示,1×MIC的rbLfP与沙门菌共培养后,随着时间变化,相对渗透率变大,在4 h之后,1×MIC组的相对渗透率与空白对照组比较,差异显著(P<0.05);到6 h后变化趋缓基本稳定。说明rbLfP可以改变沙门菌细胞膜的通透性,与通透性相关的金属离子从胞内向胞外渗出,导致细胞内环境改变;rbLfP对沙门菌的作用方式之一是通过改变细胞膜的通透性,进而可能影响胞内外物质转运、代谢等功能,从而起到抑制沙门菌生长的作用。
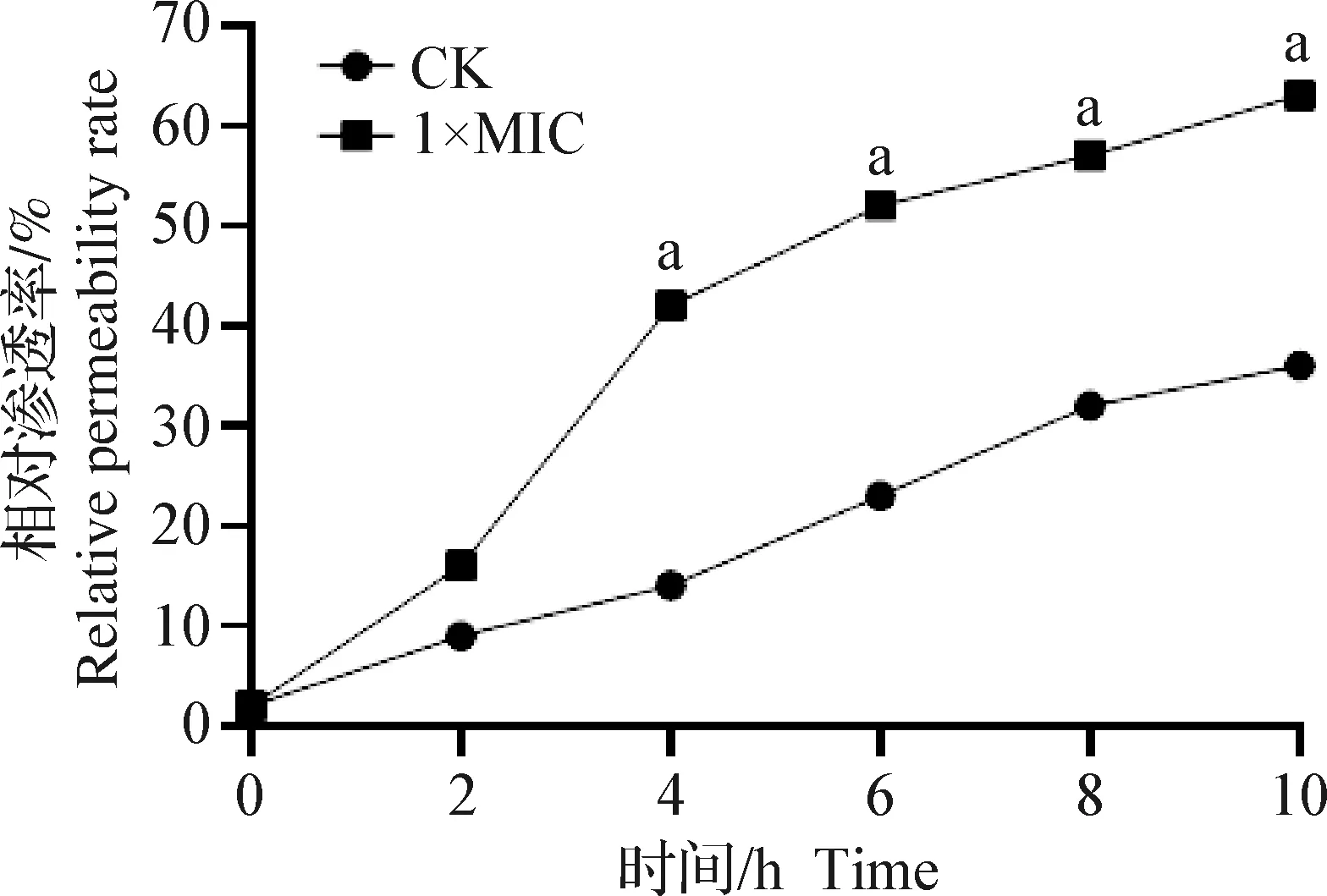
图5 rbLfP对细胞膜相对渗透率的影响Fig.5 Effects of rbLfP on relative permeability of cell membrane
2.3 rbLfP对基因组DNA的相互作用影响
2.3.1 rbLfP对蛋白质合成的抑制作用 为研究rbLfP对细胞胞内蛋白质合成的抑制作用,选用体外无细胞蛋白合成系统,进行蛋白质合成抑制试验。结果见图6,rbLfP对蛋白质合成抑制作用呈现一定的剂量依赖效应,较低浓度的rbLfP对蛋白质合成抑制作用不明显,8×MIC的rbLfP对蛋白质合成速率为79%,抑制率为21%,16×MIC的rbLfP蛋白质合成速率为54%,抑制率为46%,对蛋白质合成抑制速率效果更明显。因此,rbLfP可以通过影响细菌胞内蛋白质的合成来抑杀细菌,且抑杀效果与rbLfP的浓度呈正相关。
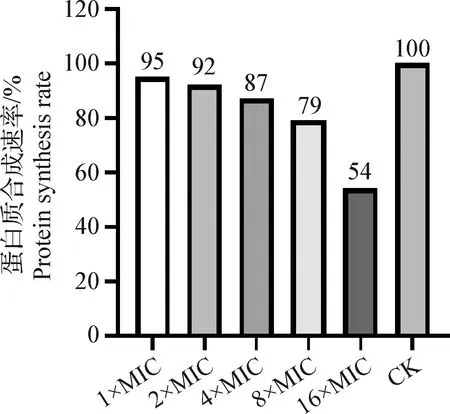
图6 rbLfP对体外蛋白质合成的影响Fig.6 Effects of rbLfP on protein synthesis in vitro
2.3.2 rbLfP对细菌基因组DNA凝胶阻滞试验 结果如图7所示,在凝胶电泳时,rbLfP与DNA的结合物在琼脂糖凝胶上的迁移速率比DNA慢;rbLfP可以与EB竞争性结合细菌基因组DNA,随着rbLfP浓度增加,DNA的迁移速率越慢,但没有达到完全阻断DNA迁移的水平。由此可见,rbLfP可能通过改变细菌细胞膜的通透性进入细菌菌体后与胞内DNA的作用靶点发生作用,影响细菌基因组DNA的复制,由于rbLfP在2×MIC的浓度下,未能完全阻断DNA的迁移,因此rbLfP与DNA直接结合的能力有限,所以,此途径不一定是主要抑菌途径。

图7 rbLfP与细菌基因组DNA结合的凝胶阻滞试验Fig.7 Gel retardation analysis of rbLfP binding to bacterial genomic DNA
2.3.3 荧光光谱分析rbLfP与DNA的作用影响 结果如图8所示,浓度在1×MIC、2×MIC时,rbLfP与基因组DNA的结合能力比较有限,在550~750 nm的紫外吸收光谱发生变化,600 nm和650 nm的吸收峰发生位移,高度降低,但影响作用有限,结果差异不显著(P>0.05)。结果表明,可能是rbLfP分子中的氨基酸与细菌基因组DNA的磷酸骨架结合,抑或是与DNA分子发生沟槽作用,影响细菌基因组DNA的复制。
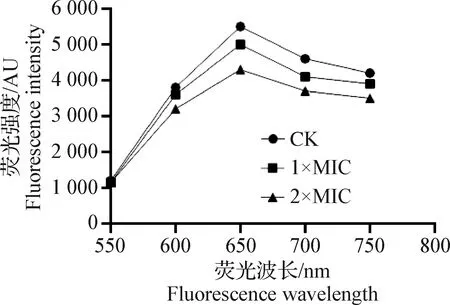
图8 rbLfP与DNA相互作用的荧光光谱分析Fig.8 Fluorescence spectrum analysis of rbLfP interaction with DNA
3 讨论
牛乳铁蛋白的抗菌功能是其主要生物学功能之一,也是较早被发现的生物学功能,对常见的病原细菌诸如大肠杆菌、沙门菌[20]、金黄色葡萄球菌、绿脓杆菌、结核分枝杆菌等均有良好的抑菌效果[21-22]。Evelien等在研究牛乳铁蛋白对溶血性大肠杆菌的作用时发现,通过直肠给药能够对出血性大肠杆菌O157∶H7在牛体内的感染进行有效的治疗,同时可以调节牛的机体免疫力[23]。周恬等研究表明,口服牛乳铁蛋白能抑制牙龈卟啉单胞菌的生长繁殖,对牙周组织炎症有很好的控制作用[24]。
牛乳铁蛋白的抗菌机制如何,是通过何种途径进行抑制细菌繁殖生长的呢?目前对牛乳铁蛋白抑菌机制的研究较少,而与之同源性最相近的乳铁蛋白抑菌机制则研究较多。有研究表明,乳铁蛋白的抑菌机制与其特殊的分子结构有关系。乳铁蛋白表面某些结构能够与细菌表面分子非特异性结合,对细菌细胞膜上的通道位点能够有效的封闭,进而通过封闭通道位点来阻断营养物质和菌体内合成蛋白的转运,从而抑制细菌的合成与代谢[25]。乳铁蛋白的分子结构中含有氨基末端强阳离子结合区域,使得其带正电荷,可通过其与革兰阴性菌表面的脂多糖(阳离子区)相互作用,与带负电荷的细胞表面成分有很强的亲和性,可黏附于细菌的细胞膜,从而增强细胞膜的通透性,使细菌的脂多糖从外膜渗出,导致菌体内部的核酸和蛋白质泄漏,起到裂解细菌、抑制细菌生长繁殖的作用[26-27]。
核酸和蛋白质是细菌细胞内两类重要的大分子物质,在正常生理状态条件下,不能穿透细胞膜,但当药物或者其他刺激源对细菌细胞膜完整性造成破坏时,核酸和蛋白质会通过细胞膜上特定孔道释放到细胞外,利用核酸在260 nm、蛋白质在280 nm处有较强的紫外吸收,可以通过检测培养液中核酸和蛋白质紫外吸收强度的变化规律来判断细菌细胞膜的完整性[28-29]。
本试验对rbLfP抑制沙门菌生长繁殖的机制进行了探索,结果显示,rbLfP对沙门菌的体外MIC为32 μg/mL时,可以有效抑制菌体生长繁殖。对rbLfP抑菌机制的进一步研究结果显示,在1×MIC、2×MIC的rbLfP作用下培养2 h,沙门菌培养液中的核酸和蛋白质含量均升高,结果与空白对照组相比差异显著(P<0.05),rbLfP与细菌共培养4 h,培养液中的核酸和蛋白质含量明显升高,与空白对照组相比差异显著(P<0.05)。通过对细胞膜渗透率的变化研究表明,rbLfP可以通过改变沙门菌细胞膜表面的通透性,使细胞膜相对渗透率变大,对菌体细胞膜的完整性造成损伤,导致菌体内金属离子、核酸和蛋白质泄漏,起到抑菌作用,且rbLfP浓度越高,抑菌作用效果越明显。
研究表明,EB是一种非常典型的灵敏度高、选择性好的嵌入式荧光探针,其本身的荧光很弱。EB与DNA作用,EB的生色基团插入DNA碱基序列中,插入形式是以较高亲和力嵌入DNA的双链内部的碱基对之间,EB与DNA结合后荧光强度将会大幅度增强[30]。rbLfP与EB共存于DNA体系时,rbLfP与EB则相互竞争与DNA的结合,导致EB与DNA结合的能力变弱,在荧光光谱检测时,表现为荧光光谱强度降低。蛋白质可以与DNA的双螺旋表面通过静电作用的方式相结合,同时可以与显色液EB竞争性结合DNA,在凝胶电泳时蛋白质与DNA结合的复合物比EB与DNA结合产物的迁移速率慢,发生拖尾等现象[31]。体外蛋白质合成速率试验验证了rbLfP在体外有一定的抑制蛋白质合成的效果。本试验中荧光光谱分析rbLfP与DNA磷酸骨架的影响结果显示,rbLfP使沙门菌DNA的吸收峰发生位移,高度降低,但影响作用有限,结果差异不显著(P>0.05),可能是rbLfP分子中的氨基酸与细菌基因组DNA的磷酸骨架结合,抑或是与DNA分子发生沟槽作用,影响细菌基因组DNA的复制,抑制沙门菌的生长繁殖,起到抑菌杀菌效果。
本试验揭示了rbLfP对沙门菌抑菌的作用机制:rbLfP可通过改变沙门菌细胞膜的通透性,可能是rbLfP对沙门菌抑菌的主要作用途径;同时其与细胞内DNA相互作用,抑制菌体DNA复制,起到一定抑菌作用,可以与膜损伤抑菌途径共同作用,但不是主要抑菌作用途径。本试验结果为下一步研究rbLfP抑菌的分子机理提供了科学依据。
