糖尿病肾脏病湿热证患者肠道菌群临床特征的研究
2022-10-17陈玮鸿柳红芳张梦久
陈玮鸿,柳红芳,郭 燕,张梦久
(1. 北京中医药大学东直门医院,北京 100700;2. 内蒙古民族大学附属医院,内蒙古 通辽 028000)
糖尿病肾脏病是高血糖导致的肾脏结构和功能障碍性疾病,因患者肾小球、肾小管结构和功能障碍,不能完全排泄体内代谢废物如硫酸吲哚酚、硫酸对甲酚等肠源性尿毒症毒素,直接导致肠道微环境改变,肠道菌群失衡,引起肠壁通透性增加,肠腔内大量的脂多糖、甲酚、吲哚啉基分子等毒素通过肠壁进入血液循环,促进体内微炎症形成,产生一系列促炎性因子,导致肾小球内炎症放大,肾小管上皮细胞坏死、肾间质纤维化,加重糖尿病肾病的发展[1]。中医认为糖尿病肾脏病与隋代甄立言《古今录验方》中的“肾消病”最为密切相关[2],《古今录验方》云:“渴而饮水不能多,但腿肿脚先瘦小,阴痿弱,数小便者,此是肾消病也。”[3]糖尿病肾脏病临床主要表现为疲倦乏力、腰膝酸软、颜面肢体浮肿、恶心呕吐、二便不畅等,目前研究认为其病机特点是本虚标实、虚实夹杂,本虚以脾肾气虚为根本,标实以湿热、痰浊、瘀血夹杂胶结为主[4-6]。消渴病起于中焦而及下焦,发展到后期累及于肾脏,导致脾肾两脏失用,脾失健运,不能升清降浊,肾不主水,气化失常,开合不利,导致水湿痰浊内蕴,日久郁而化热,脾肾两虚,积伤入络,血脉运行不畅,最终导致湿热、痰浊、瘀血等,其中以湿热因素居多。现有研究认为糖尿病肾脏病与肠道菌群失衡关系密切,但中医证型与肠道菌群分布特征的关系鲜有报道,因此本研究探讨了糖尿病肾脏病湿热证患者肠道菌群分布的特征,旨在为糖尿病肾脏病的中西医结合防治提供有意义的参考。
1 资料和方法
1.1诊断标准
1.1.12型糖尿病诊断标准 参照《中国2型糖尿病防治指南2017年版》的糖尿病诊断标准,符合下述3条任意一条即可诊断:①典型糖尿病症状,如原因不明的体重减轻、多饮、多食、多尿加上随机(一天中任意时间)的静脉血浆葡萄糖值≥11.1 mmoL/L;②空腹(至少8 h没有进食热量)静脉血浆葡萄糖值≥7.0 mmoL/L;③葡萄糖负荷后2 h静脉血浆葡萄糖值≥11.1 mmoL/L。无糖尿病典型症状者,需改日重复检测。
1.1.2糖尿病肾脏病诊断标准 参照《中国2型糖尿病防治指南2017年版》的糖尿病肾脏病诊断标准,符合临床诊断标准或肾脏组织活检证实。临床诊断标准:确诊糖尿病后,随机尿液的尿白蛋白/尿肌酐≥30 mg/g为尿白蛋白排泄增加,3~6个月内重复检测,其中3次中任意2次有尿白蛋白排泄增加,排除发热、感染、心力衰竭等因素后可诊断为糖尿病肾脏病;或确诊糖尿病后,估算肾小球滤过率(eGFR)<60 mL/(min·1.73 m2)3个月以上,排除其他慢性肾脏病即可诊断为糖尿病肾脏病。
1.1.3中医诊断标准 通过文献查阅,结合既往课题数据和糖尿病肾脏病相关行业规范,通过问卷咨询、会议讨论的灵活方式进行了5轮专家咨询,制定出《中医证候调查表》,认为湿热证型符合下述2个及2个以上症状方可判定:肢体困重、食少纳呆、脘腹胀满、口干口苦、舌苔黄腻。
1.2纳入标准
1.2.1单纯2型糖尿病患者纳入标准 ①符合糖尿病诊断标准但无糖尿病肾脏病变;②采样前2个月未服用过抗生素、二甲双胍、阿卡波糖、黄连素、微生物活菌制剂、乳果糖、通便药物等;③血压(100~170)/(40~80)mmHg(1 mmHg=0.133 kPa),糖化血红蛋白4%~10%,血肌酐58~110 μmol/L。
1.2.2糖尿病肾脏病湿热证患者纳入标准 ①符合糖尿病肾脏病诊断标准及中医湿热证辨证标准;②采样前2个月未服用过抗生素、二甲双胍、阿卡波糖、黄连素、微生物活菌制剂、乳果糖、通便药物等,采样前1个月内未接受过外用灌肠疗法、结肠透析者;③血压(100~170)/(40~80)mmHg,糖化血红蛋白4%~10%,血肌酐58~700 μmol/L。
1.2.3糖尿病肾脏病非湿热证患者纳入标准 ①符合糖尿病肾脏病诊断标准且不符合中医湿热证辨证标准;②采样前2个月未服用过抗生素、二甲双胍、阿卡波糖、黄连素、微生物活菌制剂、乳果糖、通便药物等,采样前1个月内未接受过外用灌肠疗法、结肠透析者;③血压(100~170)/(40~80)mmHg,糖化血红蛋白4%~10%,血肌酐58~700 μmol/L。
1.3排除标准 ①患胃肠道疾病、肠道产气疾病者;②患急、慢性全身或局部感染者;③6个月内有手术或外伤史者;④6个月内有恶性高血压、心脑血管意外和糖尿病酮症酸中毒等危急重病病史者;⑤患严重的呼吸、消化、肝病、血液、肿瘤、自身免疫等疾病者;⑥妊娠、哺乳者;⑦不自愿受试或不签署知情同意书者。
1.4一般资料 参考上述标准,选择2018年10月—2019年11月就诊于北京中医药大学东直门医院的20例糖尿病肾脏病湿热证患者作为糖尿病肾病湿热组, 20例健康体检者作为健康组,20例单纯2型糖尿病患者作为糖尿病组,20例糖尿病肾脏病非湿热证患者作为糖尿病肾病非湿热组,入组者年龄18~80岁。4组间年龄、体质指数、收缩压、舒张压比较差异均无统计学意义(P均>0.05),糖尿病肾病湿热组和糖尿病肾病非湿热组肌酐、尿酸、C反应蛋白、24 h尿蛋白定量、糖化血红蛋白比较差异均无统计学意义(P均>0.05),糖尿病肾病湿热组和健康组肌酐、C反应蛋白比较差异均有统计学意义(P均<0.05),糖尿病肾病湿热组和糖尿病组患者肌酐、C反应蛋白、糖化血红蛋白比较差异均有统计学意义(P均<0.05)。见表1。本研究经北京中医药大学东直门医院医学伦理委员会审查同意(DZMEC-KY-2018-21)。
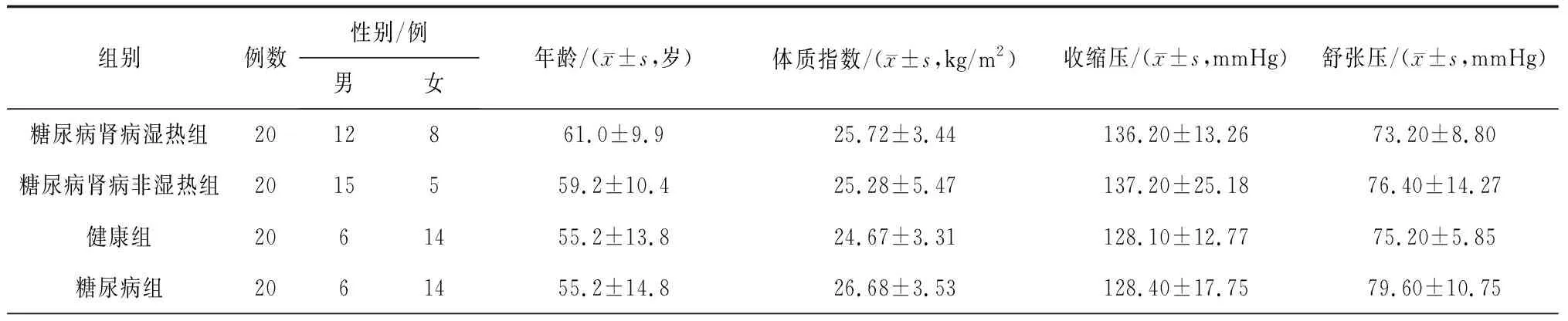
表1 4组受检者基线资料比较
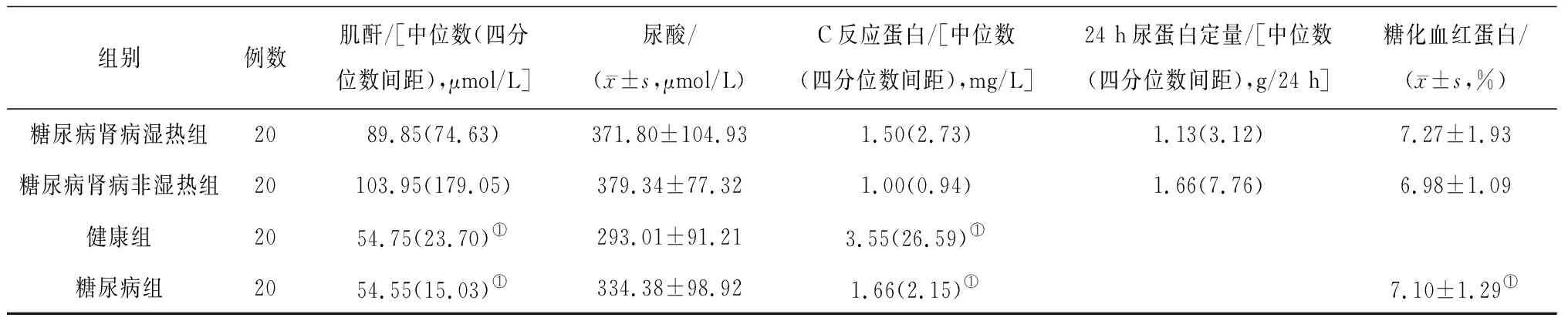
组别例数肌酐/[中位数(四分位数间距),μmol/L]尿酸/(x±s,μmol/L)C反应蛋白/[中位数(四分位数间距),mg/L]24 h尿蛋白定量/[中位数(四分位数间距),g/24 h]糖化血红蛋白/(x±s,%)糖尿病肾病湿热组2089.85(74.63)371.80±104.931.50(2.73)1.13(3.12)7.27±1.93糖尿病肾病非湿热组20103.95(179.05)379.34±77.321.00(0.94)1.66(7.76)6.98±1.09健康组2054.75(23.70)①293.01±91.213.55(26.59)①糖尿病组2054.55(15.03)①334.38±98.921.66(2.15)①7.10±1.29①
1.5研究方法 收集各组受检者粪便样本进行基因DNA提取,获取粪便样本的生物学信息。将4组检测结果进行菌门和菌属水平分析,使用R语言作图工具绘制柱状图,比较各组肠道菌群的多样性、菌落组成、物种丰度。
1.5.1粪便样本基因检测方法 让受试者将粪便排到干净的容器中,用无菌勺挖取中后部内侧的粪便约1 g,放入肠道菌群保存管中,并立刻放入-80 ℃冰箱进行低温保存。按照以下步骤进行检测:①提取粪便样本中基因组DNA后,使用1%琼脂糖凝胶电泳对提取的基因组DNA进行质检;②按粪便样本基因16s V3-V4区域,合成带有错位碱基的融合引物,每个样本重复3次,将同一样本的PCR产物混合后,用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,三羟甲基氨基甲烷与盐酸配比溶液洗脱,2%琼脂糖电泳检测;③Miseq文库构建:首先基因两端连接“Y”字形接头,使用磁珠筛选纯化接头自连片段,利用PCR扩增构建文库模板的富集,氢氧化钠变性,产生单链DNA片段;④Miseq上机测序:DNA片段的一端与引物碱基互补,另一端随机与附近的另外一个引物互补,两端都固定在芯片上,形成“桥”,通过PCR扩增,产生DNA簇,DNA扩增子线性化使DNA簇成为单链,加入改造过的DNA聚合酶和带有4种荧光标记的脱氧核糖核苷三磷酸,每次循环只合成一个碱基,用激光扫描反应板表面,根据捕捉的荧光序号,读取模板序列第一轮反应所聚合上去的核苷酸种类,将“荧光基团”和“终止基团”化学切割,恢复3’端黏性,继续聚合第二个核苷酸,然后依次统计每轮收集到的荧光信号结果,最终获知模板DNA片段的序列。
1.5.2数据质控优化 ①利用Trimmomatic软件、Pear软件对Fastq数据进行质控:对于Trimmomatic软件,采用滑动窗口方法,窗口大小制定为50 bp,平均质量值为20,最小保留序列长度为120,Pear软件用于去除具有N的序列;②利用Flash软件、Pear软件根据PE的重叠关系对两端序列进行拼接处理,最小重叠设置10 bp,错配率为0.1,得到Fasta序列;③根据已知数据库用嵌合体识别方法比对去除Fasta序列的嵌合体,对于未知数据库使用自比对方法进行去除,同时去除不符合要求的短序列,得到优质Fasta数据;④下机的双端序列数据,再去除短序列和引物并拼接后得到经过过滤的低质量的原始序列,原始序列再经进一步去除嵌合体、短序列后得到优质序列;⑤为了便于进行生物信息统计分析,将数据质控优化后得到的优质序列进行97%相似水平的OTUs聚类分析,选用 uparse聚类法。基于聚类结果,进行多样性分析及物种注释分析。

2 结 果
2.1OTUs聚类结果 共产生1 726个OTUs,经过抽平处理剩余1 592个OTUs,其中健康组平均每个样品含204.7个OTUs,糖尿病组平均每个样品含176个OTUs,糖尿病肾病湿热组平均每个样品含206.1个OTUs,糖尿病肾病非湿热组平均每个样品含204.8个OTUs,4组OTUs的平均数量:糖尿病肾病湿热组>糖尿病肾病非湿热组>健康组>糖尿病组。
2.2样本量合理曲线 基于4组受检者的OTUs聚类结果绘制物种积累曲线(见图1),发现随着样本量的增加,曲线缓慢上升,后逐渐平稳,表明此时并不会随样本量的增加而发现大量新物种,说明本研究样本量较为充分。
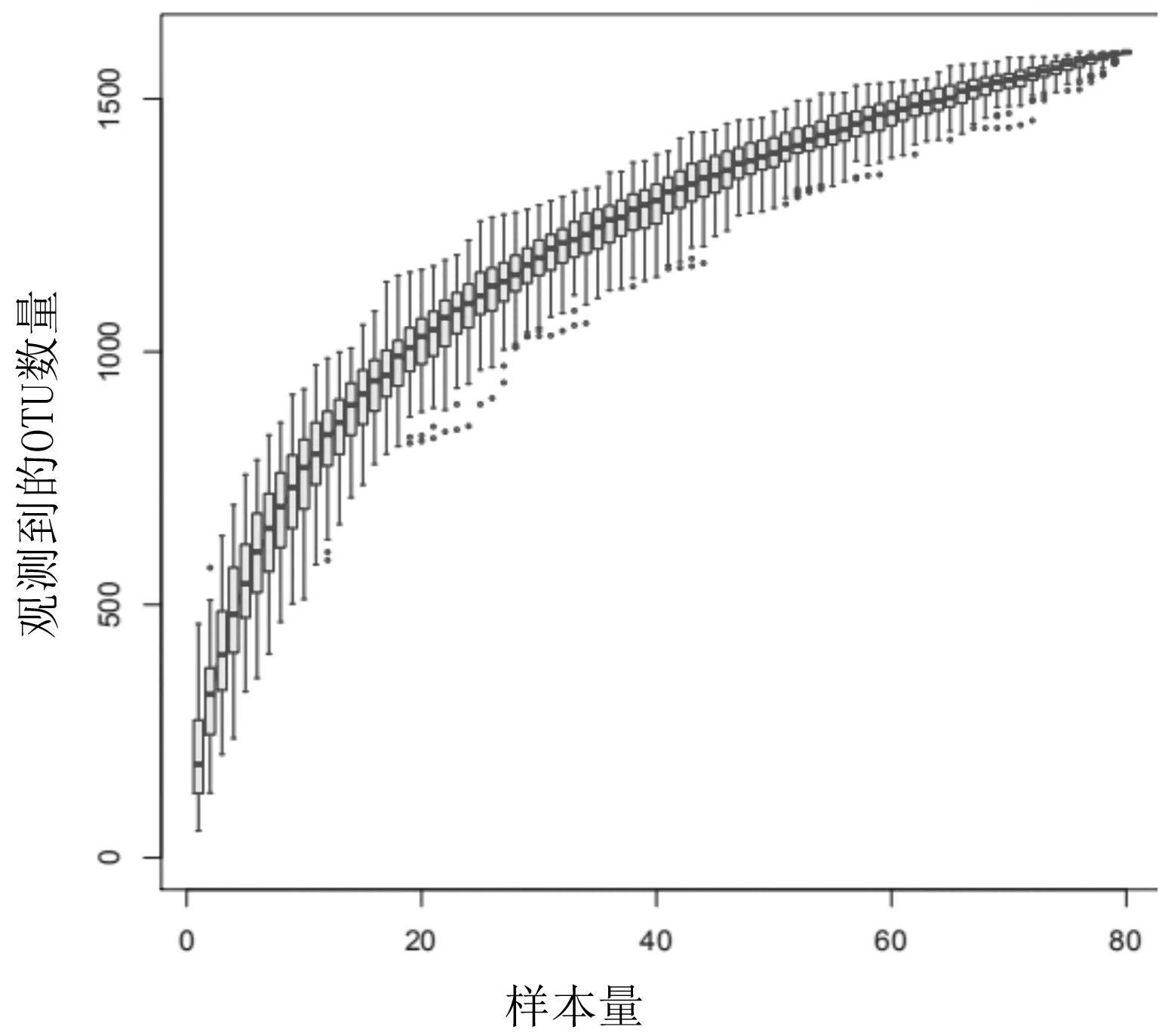
图1 基于4组受检者肠道菌群的OTUs聚类结果绘制的物种积累曲线
2.3测序量合理曲线 基于4组受检者的OTUs聚类结果绘制稀释性曲线和Shannon-Wiener曲线(见图2及图3),发现随着测序量的增加,曲线趋向平坦,说明测序数据量合理,更多的数据量只会产生少量新的OTU,可以反映4组样本中绝大部分的微生物多样性信息。
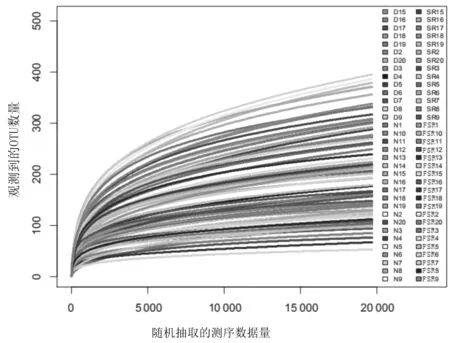
图2 基于4组受检者肠道菌群的OTUs聚类结果绘制的稀释性曲线
图3 基于4组受检者肠道菌群的OTUs聚类结果绘制的Shannon-Wiener曲线
2.4多样性指数比较 基于OUTs聚类结果,使用SPSS软件做箱线图判断chao1指数、observed spe-cies指数、PD whole tree指数、shannon指数离散程度,见图4。结果糖尿病肾病湿热组chao1指数、observed species指数、PD whole tree指数、shannon指数高于健康组、糖尿病组、糖尿病肾病非湿热组,但差异均无统计学意义(P均>0.05)。
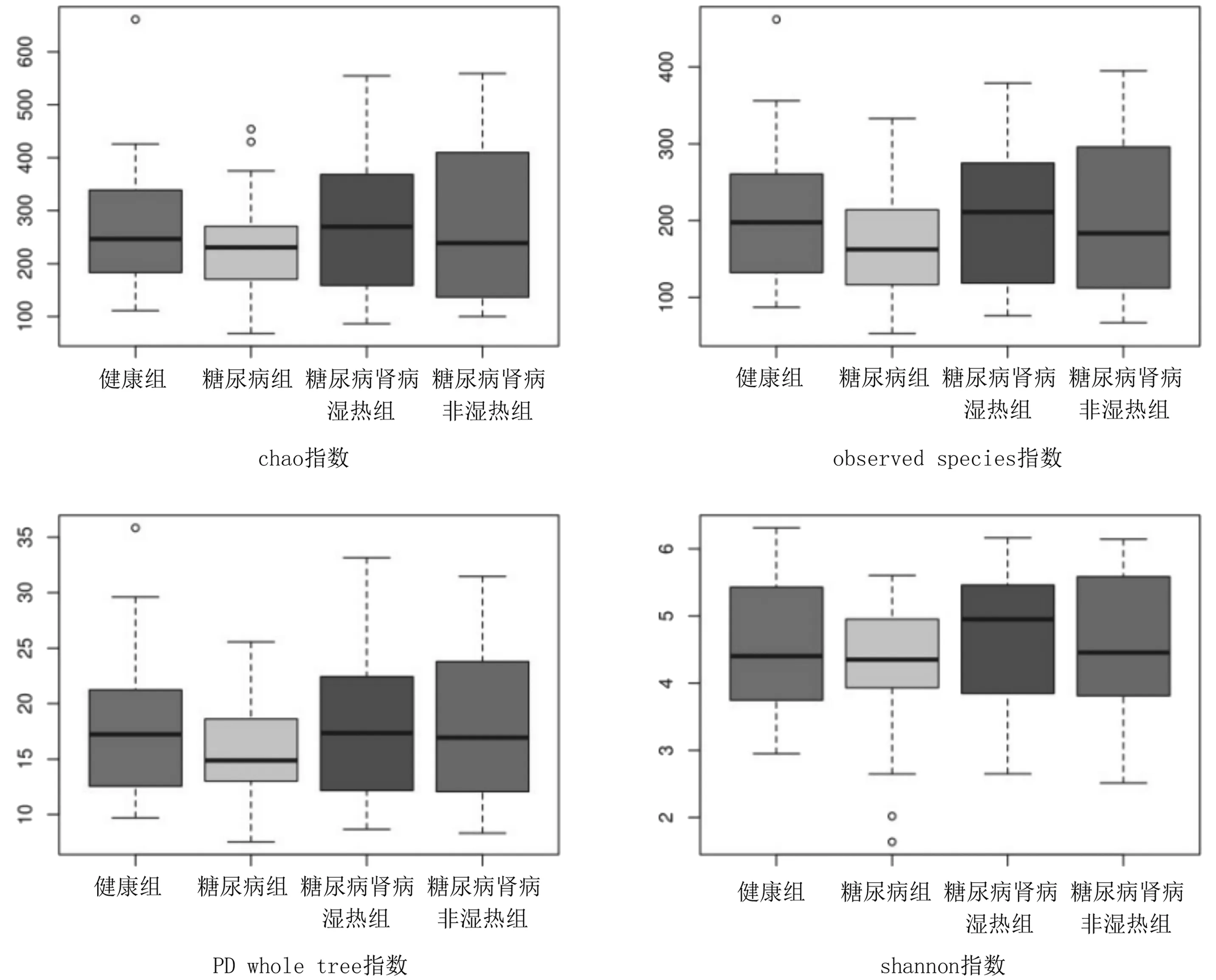
图4 基于OUTs聚类结果的4组肠道菌群多样性指数箱形图
2.5菌群构成及丰度
2.5.1菌门水平构成及丰度 4组受试者肠道菌群物种菌门水平丰度见图5,主要存在8个菌门:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)、疣微菌门(Verrucomicrobia)、互养菌门(Synergistetes)、软壁菌门(Tenericutes),其中厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)为优势菌门,4组优势菌门丰度见图6。Metastats分析,糖尿病肾病湿热组放线菌门(Actinobacteria)的丰度明显高于健康组(P<0.05),变形菌门(Proteobacteria)的丰度明显低于糖尿病肾病非湿热组(P<0.05),其余菌门的丰度各组间比较差异均无统计学意义(P均>0.05)。见表2。

横坐标为样本名称图5 4组受试者肠道菌群物种菌门水平丰度(相对丰度1%以上的物种信息)

图6 4组受试者肠道菌群菌门水平物种组成情况

表2 4组受试者肠道菌群菌门水平物种相对丰度比较
2.5.2菌属水平构成及丰度 在菌属水平上,4组受试者样本主要获得72个菌属(见图7),丰度前10的菌属有拟杆菌属(Bacteroides)、布劳特氏菌属(Blautia)、普拉梭菌属(Faecalibacterium)、双歧杆菌属(Bifidobacterium)、普雷沃菌属(Prevotella)、Unidentified、乳杆菌属(Lactobacillus)、优杆菌属(Eubacterium)、巨型球菌属(Megasphaera)、巨单胞菌属(Megamonas),4组物种菌属丰度见图8。 Metastats分析,与健康组比较,糖尿病肾病湿热组布劳特氏菌属(Blautia)、毛螺菌属(Lachnospira)、罗斯氏菌属(Roseburia)的丰度明显降低(P均<0.05),双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)的丰度明显升高(P均<0.05);与糖尿病组比较,糖尿病肾病湿热组布劳特氏菌属(Blautia)的丰度明显降低(P<0.05),普雷沃菌属(Prevotella_2)、瘤胃球菌(Ruminococcaceae_UCG-002)、优杆菌属(Eubac-terium_eligens_group)的丰度明显升高(P均<0.05);与糖尿病肾病非湿热组比较,糖尿病肾病湿热组粪芽孢菌属(Coprobacillus)的丰度明显升高(P<0.05),克雷伯氏菌属(Klebsiella)、肠杆菌属(Enterorhabdus)、变形菌属(Proteus)的丰度明显降低(P均<0.05),见表3~5。

横坐标为样本名称 图7 4组受试者肠道菌群物种菌属水平丰度(相对丰度1%以上的物种信息)

图8 4组受试者肠道菌群菌属水平物种组成情况

表3 健康组和糖尿病肾病湿热组肠道菌群菌属水平丰度值比较

表4 糖尿病组和糖尿病肾病湿热组肠道菌群菌属水平丰度值比较

表5 糖尿病肾病湿热组和糖尿病肾病非湿热组肠道菌群菌属水平丰度值比较
3 讨 论
糖尿病肾脏病是糖尿病常见的慢性并发症,糖尿病患者中约34.2%的患者合并白蛋白尿,其中微量白蛋白尿占26.0%,大量白蛋白尿占8.2%,因糖尿病导致的慢性肾功能不全的住院率逐年升高,已经超过慢性肾小球肾炎导致的慢性肾功能不全的住院率,成为肾脏代替治疗的首要原因之一[7]。目前,糖尿病肾脏病的发病机制尚未完全阐明,公认的机制有基因多态性、血流动力学改变、糖代谢紊乱、炎症反应、氧化应激、内质网应激等,近年来糖尿病肾脏病患者肠道内微环境日益受到人们的重视。
本研究中,糖尿病肾病湿热组变形菌门、拟杆菌门的丰度低于糖尿病肾病非湿热组,厚壁菌门、放线菌门的丰度高于糖尿病肾病非湿热组。厚壁菌门的差异主要表现在粪芽孢菌属。既往文献报道,粪芽孢菌属在肠癌大鼠、慢性功能性便秘患者、老年人中丰度明显升高[8-10],是潜在的致病菌,与癌症关系密切。变形菌门的差异主要表现在肠杆菌属、克雷伯菌属、变形菌属,这3种菌属均为变形菌门肠杆菌科革兰染色阴性的细菌,是可以引起多种条件性致病感染的常见病原菌,常分布于外伤创面、泌尿道、呼吸道等部位,近年来耐药性逐步增强,在承德市中心医院的调查研究中发现肠杆菌属和克雷伯菌属对含β-内酰胺环的抗菌药物的耐药率几乎都达到100%[11],对其他类抗生素也存在着不同程度的耐药情况,所以导致临床治疗存在一定的困难,治愈率低,病死率高。糖尿病肾脏病中医证型与肠道菌群相关研究较少,笔者查阅其他疾病,如功能性便秘的脾胃湿热证与非脾胃湿热证患者的粪便肠道菌群分布情况,发现非脾胃湿热证患者肠道菌属内肠杆菌属数量明显增多[12],这与本研究中非湿热证糖尿病肾脏病患者肠道菌群分布情况相似。
本研究中,糖尿病肾病湿热组梭杆菌门、厚壁菌门的丰度低于糖尿病组,放线菌门的丰度高于糖尿病组。厚壁菌门的差异主要表现在布劳特氏菌属,该菌属是肠道发酵膳食纤维产生短链脂肪酸的微生物之一,短链脂肪酸在糖尿病、肥胖等代谢疾病中有积极作用,除了可维持肠道内稳态外,还可以降低血糖、改善胰岛素抵抗等[13]。放线菌门的差异主要表现在双歧杆菌属,该菌属作为人体重要的微生态调节剂,具有调节免疫功能、保护肠道黏膜屏障、改善肝功能等多种作用[14-16]。其他条件致病菌如普雷沃菌6属、普雷沃菌2属、柰瑟菌属,产丁酸有益菌属如瘤胃球菌(Ruminococcaceae_UCG-002)、优杆菌属(Eubacterium_eligens_group)的丰度在糖尿病肾脏病湿热证患者中均明显升高。普雷沃菌属主要寄生在人体肠道、泌尿道、口腔系统中,是人体重要菌群之一。当机体免疫力紊乱或免疫力低下时,普雷沃菌属则为条件致病菌,可引起内源性感染。柰瑟菌属为革兰染色阴性球菌,主要包括脑膜炎柰瑟菌、淋球菌等25个种,其中脑膜炎柰瑟菌、淋球菌严格以人为宿主,菌种丰度与流行性脑脊髓膜炎、淋病、结直肠腺癌等疾病呈正相关[17-18]。毛螺旋菌属、瘤胃球菌属、优杆菌属可以产生丁酸,丁酸是肠道上皮细胞能量的主要来源,而且在保护肠道黏膜的完整性、改善微生物菌群比例、调节肠道炎症性反应、降低血糖、增加胰岛素敏感性方面有重要作用,是人体重要的有益菌属[19-20]。
本研究中,糖尿病肾病湿热组厚壁菌门、拟杆菌门、梭杆菌门、变形菌门的丰度低于健康组,放线菌门的丰度高于健康组。厚壁菌门的差异主要表现为布劳特氏菌属、毛螺旋菌属、罗斯氏菌、韦荣球菌属含量降低,这些菌属可以产生丁酸,丁酸能通过降低肠道pH值调节肠道微生物结构,增加有益菌数量,抑制病原菌的定植[21]。放线菌门的差异主要表现在双歧杆菌属。其他如变形菌门中的乳杆菌属、假单胞菌属、柰瑟菌属均有明显升高,其中乳杆菌属为革兰染色阳性菌属,同双歧杆菌属一同被归为人体肠道的有益菌,有预防和治疗肠道类疾病、自身免疫性疾病、代谢性疾病等作用,可改善糖耐受,降低血糖、血脂等[22-23]。对于有益菌含量升高,笔者猜想可能是糖尿病肾脏病患者肠道长期受到高血糖的刺激,肠道内菌群构成发生改变,为应对肠道内炎症、内毒素等而产生的应激反应,从而导致双歧杆菌属、乳杆菌属数量增高。假单胞菌属为革兰染色阴性杆菌,代表菌种为铜绿假单胞菌,在某种程度上均为条件致病菌,当机体免疫力低下时容易发生感染,也是医院感染的重要病原菌,常见于呼吸系统、血液系统、泌尿系统及外伤创面的感染,耐药率较高[24]。
总之,糖尿病肾脏病湿热证和非湿热证患者均有不同程度的致病菌、有益菌增加,因为肠道内微生态系统复杂多变,至今未完全阐明,且考虑到可能因为样本量、检测方法、控制因素等多方面原因,研究结果有待进一步探究。
利益冲突:所有作者均声明不存在利益冲突。
