外泌体携载MMPs在椎间盘退变中的作用研究进展
2022-10-16蔺茂强胡一村张晓勃安海英郭涛文高熙丹张芮浩陈祥义于得臣周海宇
蔺茂强,胡一村,张晓勃,安海英,郭涛文,高熙丹,张芮浩,陈祥义,于得臣,周海宇*
1兰州大学第二医院骨科,甘肃 兰州 730030;2甘肃省骨关节疾病研究重点实验室,甘肃 兰州 730030;3西安红会医院骨科,陕西 西安 710000;4武汉大学中南医院检验科,湖北 武汉 430000
下腰痛(low back pain,LBP)是目前全球致残率最高的慢性疾病,据统计约有5.4亿人正被腰痛疾病所困扰[1]。许多因素可造成LBP,其中椎间盘退变(intervertebral disc degeneration,IVDD)被认为是最主要的原因之一[2-4]。目前针对IVDD的治疗包括非手术治疗和手术干预,但均无法阻止疾病进展及恢复椎间盘重建[5],而基于外泌体的生物疗法在椎间盘再生方面具有良好的应用前景。近期研究发现,椎间盘细胞外基质(extracellular matrix,ECM)含量和组成的改变与IVDD的发生发展密切相关[6]。值得注意的是,ECM成分中的基质金属蛋白酶(matrix metalloproteinases,MMPs)在不同退变程度椎间盘ECM中的表达存在明显差异[7]。虽然造成上述差异的具体机制尚未阐明,但随着IVDD程度的加重,一系列MMPs的表达及活性增加,直接或间接参与了IVDD进程[8-9]。外泌体作为细胞间通讯和物质交换的小分子囊泡,通过在细胞与细胞、细胞与ECM之间输送MMPs参与了IVDD的发生发展过程[10]。
近年来,外泌体因具有亲代细胞生物学特性、低免疫原性和易存贮等优点[11],在IVDD研究中取得了丰硕的成果,从而有望从生物分子水平治疗IVDD。越来越多的证据表明,外泌体在细胞间通过传递MMPs等物质影响或改变椎间盘的ECM代谢,从而影响正常椎间盘细胞的生物学功能,进而参与机体的生理和病理过程[12]。本文总结目前已证实的外泌体携载的MMPs在IVDD中的作用,旨在为外泌体及MMPs应用于IVDD的基础及临床研究提供理论基础。
1 IVDD的病理机制
IVDD是多种机制共同参与导致的脊柱外科疾病,其具体病因及发病机制尚不明确,有研究发现,IVDD的发生与椎间盘细胞丢失、ECM成分改变密切相关[13-14];而且在IVDD的发生过程中,有多种环境因素(如年龄增长、异常应力增加等)及遗传因素等共同参与[15]。椎间盘是人体内完全封闭的无血管组织,由软骨终板、外围的纤维环和中央的髓核组成,缺少血液供应[16-17],因此,ECM是椎间盘细胞赖以生存的细胞外微环境。
研究发现,ECM主要由蛋白多糖、水、胶原、少量弹性蛋白等成分组成,髓核细胞在这种微环境下可产生一种高度水合的基质,当脊柱承受压力时髓核细胞发挥作用使椎间盘各部分受力均匀,以避免异常外力造成椎间盘结构的改变[18-19]。最新研究证实,MMPs作为一类蛋白水解酶,可通过降解椎间盘的ECM成分而加速IVDD进展[9],而外泌体在此过程中发挥一定的桥梁作用[20]。由此可见,以外泌体和MMPs作为分子治疗靶标,调节其表达水平,有望延缓ECM成分改变导致的IVDD进展。
2 外泌体参与椎间盘退变及修复
2.1 外泌体及其作用 外泌体最初是由Pan于1983年在绵羊的网织红细胞中发现的,直径为30~100 nm,在电子显微镜下表现为“杯状”或“碟状”,具有与细胞膜相似的磷脂双分子层结构,这种双层膜壳结构可防止其内容物在细胞间传递过程中被酶降解[21-22]。外泌体是由多囊泡小体途径衍生而来的胞外小囊泡,产生于多囊泡内涵体(multivesicular endosomes,MVEs)或多囊泡体(multivesicular bodies,MVBs),并在这些小室与质膜融合时分泌出来[23]。外泌体到达受体细胞并与受体细胞膜融合后,将所携载的生物活性物质释放到受体细胞或ECM中,从而发挥细胞间信号传递和物质交换的作用[24]。外泌体的信使作用是其携载相关生物活性分子在IVDD中发挥作用的基础,其有可能成为IVDD生物分子水平治疗的新靶点[5]。
2.2 外泌体参与椎间盘退变及修复的潜在机制外泌体具有双层膜壳结构,可维持其携载的内容物在长距离运输及与受体细胞相互作用过程中的稳定性,且与干细胞相比,更易在退变的椎间盘所产生的低细胞结构、低葡萄糖、高渗透压、低pH值和低氧的恶劣环境中生存[25],这些特性使其成为IVDD干细胞移植治疗的潜在替代方案。
IVDD发生的主要原因是中央的髓核细胞凋亡增加、过度的氧化压力、炎性因子的大量入侵,以及髓核中的ECM代谢紊乱等,其中ECM代谢紊乱被认为是引起IVDD最主要的机制[26]。研究证实,外泌体可通过miRNA等调控因子促进髓核中ECM的合成而延缓IVDD[27],且可借助于携载的生物活性物质调节免疫系统[28],抑制髓核细胞凋亡和炎症反应,促进髓核细胞增殖和再生,修复组织损伤,参与椎间盘的退变及修复过程[25,29]。
外泌体作为含有亲代细胞成分的纳米囊泡[30],在细胞间通讯中发挥着重要的介质作用,其功能与亲代细胞和携载的内容物密切相关[25,31]。Sun等[32]观察纤维环细胞衍生的外泌体(annulus fibrosus cell derived exosome,AF-exo)对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)产生的效应,探讨外泌体在IVDD血管化调节中的作用,结果显示,退化的AF-exo可上调TNF-α、IL-6等炎性因子的表达,增强HUVECs的迁移能力,促进HUVECs的血管化,对椎间盘产生不利影响;而非退化的AF-exo表现出相反的效应,可维持椎间盘的无血管化,对椎间盘起着保护作用。近期研究发现,人尿源性干细胞衍生的外泌体可通过转移母体蛋白-3(matrilin-3,MATN3)促进髓核细胞的增殖和ECM的合成,延缓IVDD[33]。Lu等[25]研究发现,间充质干细胞衍生的外泌体可增强髓核细胞中ECM的合成,实现退化椎间盘的自我修复。由此可见,外泌体在IVDD中的作用与其来源密切相关,不同来源的外泌体对椎间盘的作用不同,既可通过促血管化作用对椎间盘产生不利影响,也可通过促进ECM的合成和髓核细胞的增殖以及抑制髓核细胞的凋亡等对椎间盘起到保护作用。
3 外泌体携载MMPs参与IVDD
3.1 MMPs MMPs属于锌依赖性蛋白水解酶家族,是降解ECM中各种蛋白组分(包括糖蛋白、蛋白多糖尤其是胶原)的关键物质。在机体正常的生理状态下,这些酶的活性受自身激活机制和内源性金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases,TIMPs)的调节。然而在病理状态下,MMPs与TIMPs之间的平衡被打破,MMPs被多种因子(如血管内皮生长因子)激活,从而降解ECM,加速IVDD的进程[34-35]。尽管目前MMPs参与IVDD的具体机制仍不清楚,但最近研究发现,外泌体在这一过程中发挥了转运作用[20]。
3.2 外泌体携载的MMPs 外泌体可携载相应的生物活性物质(包括蛋白质、核酸和脂质)对受体细胞产生一系列的影响,如细胞信号转导、细胞黏附和迁移、细胞增殖和基因表达等[30,36-38]。研究证实,MMPs作为一类蛋白水解酶可被外泌体携载,通过外泌体的传递在特定的受体细胞中发挥生物学作用[39],如表1[38,40-48]所示。例如,Olejarz等[40]发现,肿瘤细胞来源的外泌体中富含MMPs,尤其是MMP-2、MMP-9、MMP-13,其通过外泌体的运输到达肿瘤微环境,参与肿瘤血管生成,促进肿瘤细胞的迁移。Xu等[38]在胃癌患者血浆纯化的外泌体中发现了MMP-11,并证实其可促进胃癌细胞的迁移。此外,MMP-1[41]、MMP-3[42]、MMP-13[43]、MMP-14[41,44]、MMP-19[41]也被证实存在于不同来源的外泌体中。由此可见,MMPs存在于外泌体中,虽然目前其发挥作用的具体机制仍不清楚,但对其作用机制的研究可能是深入了解外泌体治疗IVDD的新途径。
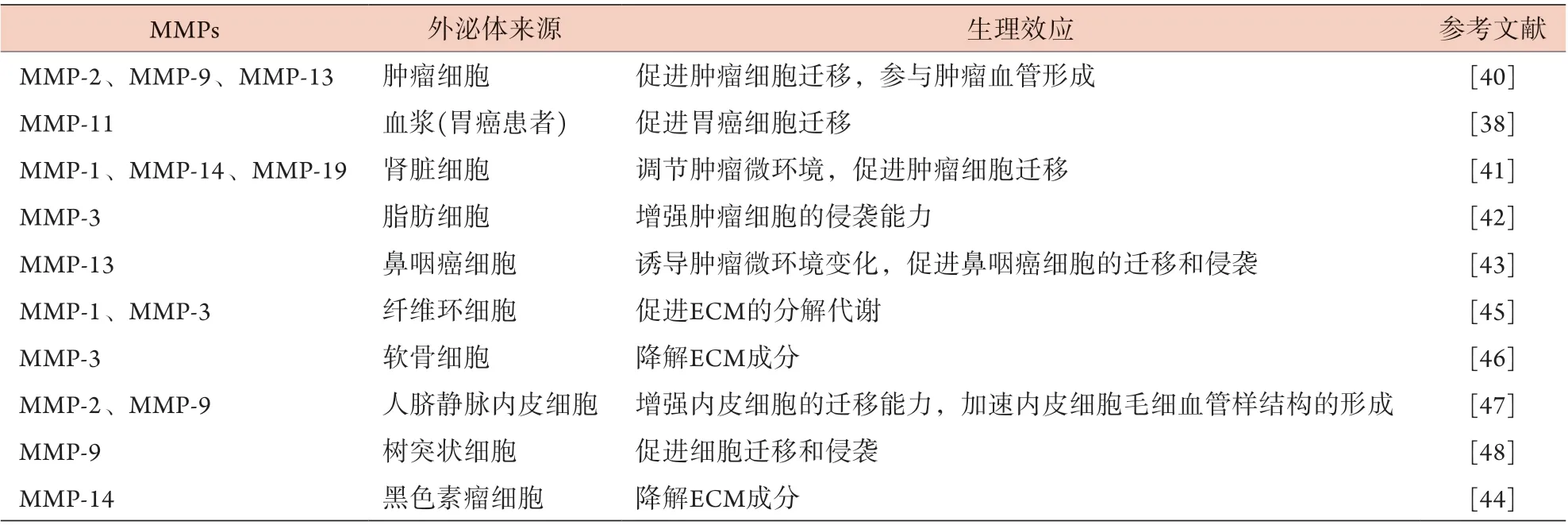
表1 外泌体携载的MMPs及其生理效应Tab.1 MMPs carried by exosomes and their physiological effects
3.3 外泌体携载MMPs调节ECM代谢 目前,对于外泌体携载MMPs的研究主要集中在肿瘤领域,与IVDD相关的研究鲜少报道。MMPs作为一类蛋白酶,主要通过调节ECM的代谢参与IVDD。在正常健康椎间盘中,MMPs的分解代谢作用与组织的合成代谢活动处于一种平衡状态;而在病理状态下,MMPs的活性和表达出现失衡,分解代谢增强,从而导致ECM成分发生改变,最终加速椎间盘的病理改变[49]。下文总结了近年来外泌体携载的参与IVDD的MMPs。
3.3.1 MMP-1、MMP-3 MMP-1、MMP-3均可在退变的椎间盘中表达,且其表达水平与椎间盘的退变程度存在明显正相关关系[50]。Pohl等[45]将内皮细胞分泌的外泌体与纤维环细胞共培养后发现,MMP-1、MMP-3的表达明显上调,并通过Western blotting检测证实,过量表达的MMP-1、MMP-3一部分来自内皮细胞分泌的外泌体,另一部分来自纤维环细胞,而MMP-1、MMP-3过量表达导致纤维环细胞的基质分解代谢增强,破坏了椎间盘的基质稳态。此外,来自内皮细胞的外泌体可抑制纤维环细胞中蛋白聚糖基因的表达,促进新生血管的形成,加速椎间盘血管化。
Dean等[46]通过RT-PCR、酪蛋白酶谱分析和Western blotting检测证实,MMP-3存在于软骨细胞分泌的外泌体中,且其活性受维生素代谢物的调节。基于上述研究,Boyan等[51]发现,1,25(OH)2D3直接作用于外泌体表面的膜受体蛋白质二硫键异构酶A3,激活磷脂酶A2,产生溶血磷脂破坏外泌体膜的稳定性,释放活性MMP-3,而后者可特异性水解软骨细胞的ECM成分。由此可见,临床上可通过制备靶向药物等手段降低MMP-1、MMP-3的表达,抑制椎间盘的ECM降解,进而延缓IVDD的进展。
3.3.2 MMP-2、MMP-9、MMP-14 MMP-2、MMP-9是MMPs家族的重要成员,对椎间盘的稳态极为重要,均被称为明胶酶,主要靶向ECM中的变性胶原蛋白[52]。有研究发现,MMP-2、MMP-9的表达水平与椎间盘退变程度呈正相关[53]。Taraboletti等[47]通过明胶酶谱分析、Western blotting和免疫金电镜实验分析证实,MMP-2、MMP-9存在于HUVECs产生的外泌体中,并证实外泌体携载的MMP-2、MMP-9可增强内皮细胞的迁移能力,加速内皮细胞毛细血管样结构的形成,而内皮细胞的这些改变可促进椎间盘血管化,加速IVDD进程[32]。此外,为了进一步了解MMP-9是否存在于外泌体内部,Silva等[48]利用成像流式细胞术和明胶酶谱分析在树突状细胞分泌的外泌体内部发现了具有活性形式的MMP-9,并证实其不仅通过重塑和降解ECM成分促进细胞迁移和侵袭,还可通过切割骨桥蛋白形成活性片段促进细胞迁移和侵袭。
Hakulinen等[44]利用免疫电镜检测到MMP-14在外泌体表面过量表达,而MMP-14可降解ECM中的胶原(Ⅰ型、Ⅱ型和Ⅲ型)、纤维连接蛋白、玻璃体连接蛋白和层黏连蛋白等,还能发挥脱落酶的作用,如裂解syndecan-1、细胞内黏附分子-1(intracellular adhesion molecule-1,ICAM-1)、CD44并将他们从细胞表面释放出来,从而改变椎间盘细胞的正常生物学活性[54]。由此可见,外泌体携载的MMP-2、MMP-9、MMP-14可通过促进内皮细胞的迁移和ECM的分解代谢,加速IVDD的进展。因此,MMP-2、MMP-9、MMP-14可作为生物学指标预测IVDD的严重程度,且可通过降低其表达为IVDD的临床治疗和预防提供新方案。
除了上述5种MMPs可通过外泌体转运形式参与IVDD过程外,MMP-8[55]、MMP-10[56]和MMP-12[57]已被证实直接或间接参与IVDD的发生发展,但其发挥作用是否通过外泌体的转运有待进一步证实。随着对MMPs和外泌体研究的不断深入,其在IVDD过程中的作用机制将逐渐被阐明,这为从生物分子水平治疗和预防IVDD提供了新思路。
4 外泌体携载的MMPs在IVDD中的应用局限性
尽管外泌体携载MMPs在IVDD中的研究不断获得认可,但目前尚存在以下问题亟需解决。首先,MMPs在IVDD过程中的作用机制尚不清楚。其次,由于目前提取外泌体技术的局限,很难以低成本高效获得高纯度外泌体,仅局限于高级平台实验室,并且外泌体的含量与细胞类型和状态有关。由于外泌体是一个包含有生物活性物质的胞外囊泡,其内包含的各种小分子物质对于疾病发生发展的作用各不相同,有益和有害的遗传物质并存,目前的技术尚不足以提取完整有效的功效性分子。最后,虽然外泌体携载的MMPs已逐步应用于肿瘤的检测和预防等方面,但在椎间盘领域的研究主要集中于体外细胞实验,尚缺乏一定的理论基础,并且其临床应用操作仍缺乏统一标准。因此,进一步增强对外泌体携载的MMPs在IVDD中的作用机制研究,对于从分子水平治疗IVDD具有重要的意义。
5 总结与展望
综上所述,外泌体作为由亲代细胞分泌的细胞外囊泡,主要通过其携载的内容物影响受体细胞的生物学活动。外泌体可通过转移MATN3促进髓核细胞的增殖和ECM的合成,延缓IVDD,也可通过携载MMPs加速ECM成分的降解、促进内皮细胞的迁移及椎间盘的血管化,进而加速IVDD,但目前外泌体延缓或加速IVDD的具体作用机制仍未阐明。此外,与IVDD的传统治疗相比,基于外泌体的分子治疗具有阻止疾病进展、重建椎间盘的优势和潜力,但目前研究仍处于起步阶段,距离应用于IVDD的临床治疗仍存在诸多挑战。进一步深化外泌体参与IVDD作用机制的研究,对于外泌体在IVDD治疗中的应用及椎间盘的再生有着深远的意义。
