小核仁RNA宿主基因17在癌症进展中的作用研究进展
2022-10-16李渊王欣鑫陈世勇杜雪芹杨晓军
李渊,王欣鑫,陈世勇,杜雪芹,杨晓军,3*
1宁夏医科大学临床医学院,宁夏 银川 750004;2甘肃省人民医院普外二科,甘肃 兰州 730000;3兰州大学第一临床医学院甘肃省外科肿瘤分子诊断与精准治疗重点实验室/甘肃省消化道恶性肿瘤防控工程研究中心,甘肃 兰州730000
癌症是全球的重要公共卫生问题,也是全世界最致命的疾病之一。据统计,2020年全球新发癌症1930万例,癌症死亡人数近1000万[1]。尽管目前出现了针对癌症治疗的新兴疗法及各种靶向药物,但终究无法完全治愈癌症。因此,迫切需要开发新的早期诊断工具、预后生物标志物和更可靠的治疗方法,以提高癌症的治愈率和生存率[2]。由于全基因组测序的发展,越来越多的长链非编码RNA(long non-coding RNAs,lncRNAs)研究为癌症治疗提供了建设性的选择[3-5]。
LncRNAs是长度超过200个核苷酸的RNA分子,其本身缺乏开放的阅读框架,包含很少的外显子,具有有限的非蛋白质编码能力[6],因此最初被认为是基因表达过程中的“转录噪声”[7]。然而,随着研究的深入,人们发现lncRNAs可以与RNA、DNA及蛋白质相互作用,形成RNA-RNA、RNADNA、RNA-蛋白质复合物,通过多种机制调节基因表达,包括转录、mRNA稳定性及翻译等[8];而就其机制而言,lncRNAs可以与蛋白质或miRNAs结合,这取决于它们的亚细胞位置:如果lncRNAs定位于细胞核内,它们通常与蛋白质结合,在转录水平上调控靶基因的表达;如果lncRNAs主要分布在细胞质中,它们很可能通过充当竞争性内源RNA(competing endogenous RNAs,ceRNA)在转录后水平增强靶基因的表达,进而影响癌症的发生发展。小核仁RNA宿主基因17(small nucleolar RNA host gene 17,SNHG17)作为一种新近发现的lncRNA,在多种癌症进展中扮演着重要角色。本文主要对SNHG17的表达、功能及作用机制进行综述,并探讨其作为癌症诊断、预后预测及潜在治疗靶点的价值。
1 SNHG17概述
小核仁RNA宿主基因(small nucleolar RNA host genes,SNHGs)家族包括多个成员,其中与癌症明显相关的是SNHG1、SNHG2、SNHG3、SNHG5、SNHG6、SNHG7、SNHG8、SNHG9、S N H G 1 2、S N H G 1 3、S N H G 1 4、S N H G 1 5、SNHG16、SNHG17、SNHG18及SNHG20等,每种SNHG均可通过多种分子机制调控人类癌症的发生发展。其中,SNHG17(HGNC:48600,基因号:ENSG00000196756.11)位于人类染色体20q11.23上(图1),全长1186 bp,存在14个转录本,但其潜在的生理功能至今仍未见明确报道。近年来,SNHG17被发现在人类恶性肿瘤中呈异常高表达,包括消化系统、呼吸系统、泌尿生殖系统肿瘤等,并与其发生、发展密切相关,在癌症的诊断、治疗及预后评估等多个方面具有潜在的应用价值。

图1 SNHG17位于人类20号染色体Fig.1 SNHG17 presented in human chromosome 20
2 SNHG17在癌症中的异常表达
国内外多项研究发现,与正常细胞及邻近组织相比,SNHG17在肿瘤细胞及组织中异常表达。采用反转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)技术检测肿瘤组织及细胞中SNHG17的表达水平,发现其表达均上调,且明显高于相应癌旁及正常组织、细胞,包括口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)[9-11]、胃癌[12-16]、肝细胞癌(hepatocellular carcinom,HCC)[17]、胰腺癌[18]、结直肠癌[19-22]、卵巢癌[23-24]、乳腺癌[25]、肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)[26]、前列腺癌[27-29]、肺癌[30-33]、胶质瘤[34-35]、星形细胞瘤[36]、黑色素瘤[37]、骨肉瘤[38]等。另外,通过肿瘤基因组图谱(TCGA)、自噬数据集的RNA测序、加权基因共表达网络分析(WGCNA)、基因表达综合数据库(GEO)等检索并筛选lncRNA表达数据集,最终发现SNHG17在OC[39]、早期结肠腺癌[40]、鼻咽癌[41]中的表达均上调,并可作为其独立预后因素发挥作用。为了对上述结果进行验证,笔者从基因表达谱交互式分析(gene expression profiling interactive analysis,GEPIA)数据库中提取了SNHG17在多种癌症中的表达情况,可以看出,SNHG17在绝大多数肿瘤组织中呈异常高表达,且明显高于配对正常组织,与上述研 究结果一致(图2)。
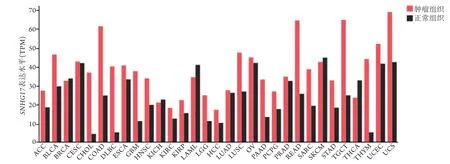
图2 相关肿瘤样本和配对正常组织的SNHG17表达谱Fig.2 SNHG17 expression profiles of related tumor samples and paired normal tissues
3 SNHG17在癌症中的临床价值
大多数研究发现,SNHG17表达上调可促进肿瘤的发生、发展,并与临床病理参数(包括肿瘤大小、TNM分期、临床分级、淋巴结转移、远处转移、分化程度、复发等)密切相关[10,12-13,24-25,28-29,37]。此外,相关数据分析表明,S N HG 1 7高表达的患者比低表达患者有着更差的总生存期(overall survival,OS)及无进展生存期(progression-free survival,PFS)[12,29]。为进一步验证其预后价值,笔者从GEPIA数据库中提取不同SNHG17表达水平的人类肿瘤的Kaplan-Meier生存曲线及生存地图,可以看出,SNHG17的表达水平与OS及无病生存期(disease free survival,DFS)密切相关(图3)。值得注意的是,前列腺腺癌(prostatic adenocarcinoma,PRAD)中SNHG17表达越高,可能预示着预后越差;相反,葡萄膜黑色素瘤(uveal melanoma,UVM)中SNHG17表达越高,其预后反而越好(图4)。另外,Chen等[12]为了探讨SNHG17在胃癌中的预后价值,进行Kaplan-Meier生存分析发现,SNHG17高表达的胃癌患者比SNHG17低表达者的OS及PFS更短,进一步行多因素分析发现,SNHG17高表达是胃癌患者OS及PFS较短的独立预测因素。
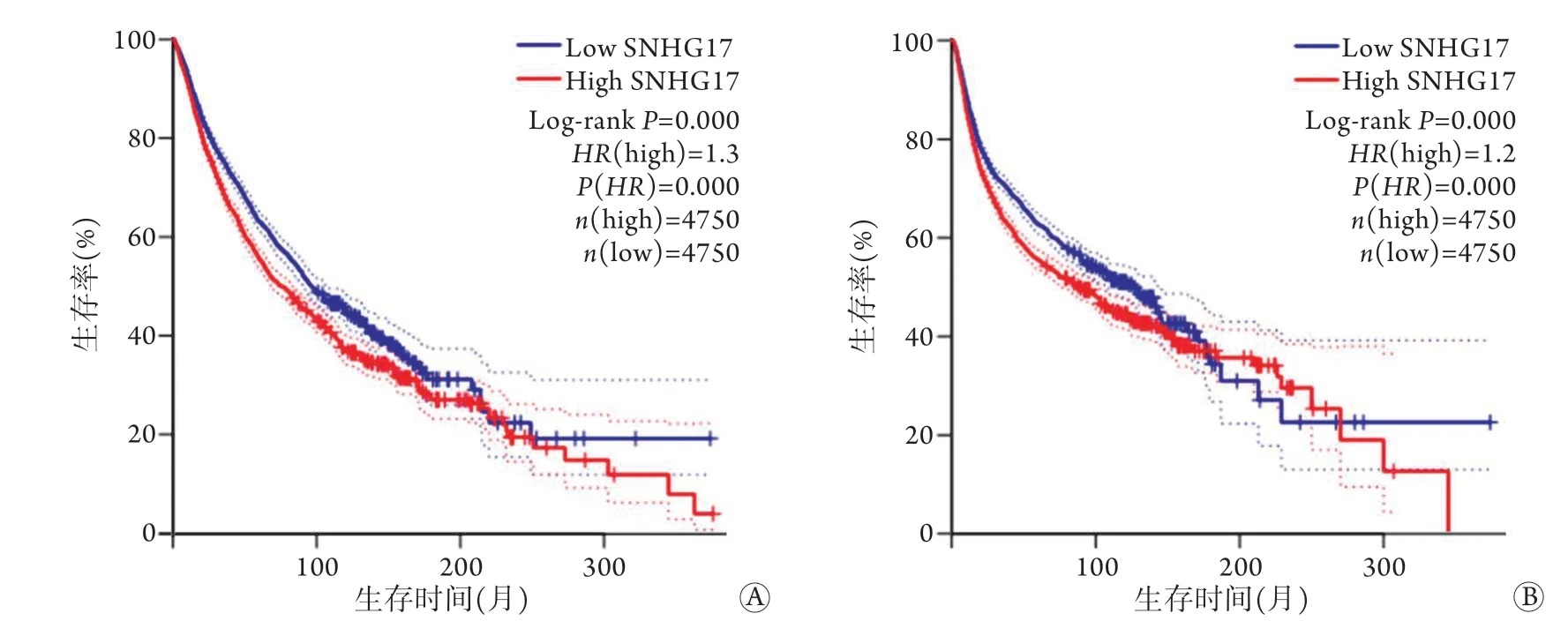
图3 从GEPIA数据库提取不同SNHG17表达水平的人类肿瘤的生存曲线Fig.3 Survival curve of SNHG17 extracted from GEPIA database in human tumors

图4 GEPIA数据库中提取不同SNHG17表达水平的人类肿瘤的生存地图Fig.4 Survival map of SNHG17 extracted from GEPIA database in human tumors
4 SNHG17参与癌症进展的致病机制
SNHG17参与多种人类恶性肿瘤的发生发展。就其机制而言,SNHG17主要作为ceRNA参与并调节相关信号通路。
4.1 消化系统肿瘤 消化系统肿瘤是全世界最常见的癌症死亡原因[42]。近年来,尽管消化道肿瘤的治疗取得了重大进展,但在早期诊断、精准治疗及耐药性等方面仍面临着严峻挑战[43]。SNHG17作为一种新型的lncRNA,参与多种消化系统肿瘤的发生发展。
4.1.1 胃癌 胃癌发病率在全球癌症谱中居第4位,死亡率居第2位[44]。早期胃癌的诊断极为困难,因此,揭示胃癌进展的潜在分子机制,对于人类探索可靠的、新的生物标志物以便进行早期诊断及预后评估至关重要。
韩涛涛[16]研究lncRNA在幽门螺杆菌(H.pylori,Hp)感染相关胃癌中的作用机制发现,SNHG17能与不含POU结构域的八聚核苷酸结合蛋白(NONO)的RRM1及RRM2结构域结合,在Hp感染相关胃癌中发挥重要功能。还有研究发现SNHG17可以通过下调p15、p16的表达而促进胃癌细胞的增殖、迁移;另外,下调SNHG17可促进胃癌细胞凋亡,将细胞周期阻滞在G1/G0期,并可降低细胞周期蛋白依赖性激酶4(CDK4)的表达[15]。Zhang等[14]通过基因芯片分析证实,SNHG17可与EZH2及SUZ12靶向结合介导p15、p57转录的表观遗传抑制。其中,p15、p57是SNHG17介导的胃癌细胞周期及增殖过程的下游调节因子,与胃癌组织中SNHG17的表达呈负相关。SNHG17可能丰富了lncRNA与细胞周期调控途径之间的机制联系,其作为多梳抑制复合物2(PRC2)介导的表观遗传调控的一员,参与了胃癌的发生发展。Han等[13]发现,过量的细胞核SNHG17能募集NONO,加上细胞质SNHG17作为miR-3909的诱饵,可调节Rad51的表达,使DNA双链断裂修复平衡从同源重组转向非同源末端连接。这表明SNHG17/NONO及SNHG17/miR-3909/RING1/Rad51通路可通过改变DNA修复系统促进Hp感染相关胃癌的发生,而DNA修复系统是维持基因组稳定性的关键。该研究为探讨SNHG17作为非编码癌基因在胃癌发生中的作用提供了一个新的视角。SNHG17有望成为胃癌早期诊断的新型标志物及治疗的潜在靶点[13]。
4.1.2 HCC HCC是主要的原发性肝癌,死亡率在全球癌症中居第4位[45]。尽管近年HCC的治疗有了很大的进步,但在临床上肿瘤进展及转移仍然是导致该病治疗失败的主要原因,其病死率仍居高不下。因此,进一步探索SNHG17参与HCC发展的潜在分子机制,从而确定针对HCC的治疗靶点尤为重要。Ma等[17]证实,SNHG17可抑制miR-3180-3p的表达,进而促进HCC细胞的增殖、迁移及侵袭;且miR-3180-3p可靶向并负性调控调节因子X1(RFX1)的表达,而RFX1与肿瘤大小及Edmonson-Steiner分级有关,提示SNHG17/miR-3180-3p/RFX1轴在HCC的进展中发挥着重要作用。
4.1.3 胰腺癌 在所有常见癌症中,胰腺癌的预后最差。因此,识别新的胰腺癌生物标志物有助于创建更准确、可靠的胰腺癌治疗方案。Zhao等[18]发现,SNHG17除了影响胰腺癌细胞的增殖及迁移外,还可作为miR-942的分子海绵直接调节miR-942的表达,进而影响多种癌基因[如过氧化物酶体增殖物激活受体γ(PPARγ)、血管内皮生长因子(VEGF)、锌指结合蛋白1(ZEB1)、骨形态发生蛋白(BMP)、干扰素刺激基因12a(ISG12a)、胶质细胞源性神经营养因子(GDNF)]的表达,从而调控胰腺癌的生物学进程。可见,SNHG17可作为监测胰腺癌进展的新指标。
4.1.4 结直肠癌 结直肠癌是消化道常见的恶性肿瘤之一,其种类繁多,手术及辅助放化疗虽改善了患者的OS,但仍需寻找疗效更好的治疗靶点。Ma等[21]首次利用GEO数据集GSE21510中公开提供的lncRNA表达谱数据,筛选出SNHG17可作为一种与结直肠癌发生及进展相关的候选lncRNA。他们通过亚细胞分离实验发现,SNHG17主要位于细胞核中,其基因敲除后,细胞周期依赖性激酶抑制因子(CKI)中p57基因表达上调最明显,而CKI是细胞周期进程中的关键调节因子。p57也可能是EZH2的一个靶点,敲除SNHG17及EZH2后p57表达均上调,表明SNHG17通过与EZH2相互作用抑制p57的表观遗传表达,部分发挥了致癌作用。该研究首次报道了SNHG17在大肠癌中的潜在致癌机制,但SNHG17的其他可能靶点以及SNHG17与p57之间的其他调控机制尚未见报道,仍需进一步研究。何春华等[22]研究指出,SNHG17及miR-375可能在结直肠癌发病进程中扮演着重要角色,实时监测二者水平对病情诊断及预后评估有帮助,但二者在结直肠癌中的具体调控机制尚未明确。随后,有研究证实了miR-375是SNHG17的潜在靶点,CBX3是miR-375的靶点[19]。CBX3属于异染色质蛋白家族,在癌细胞中表达上调,其过表达可促进结肠腺癌细胞的恶性行为。对其机制进行研究发现SNHG17可通过miR-375/CBX3轴调控结肠腺癌的进展,而对于SNHG17表达上调的上游机制未作探究[19]。同一时期,Liu等[20]发现miR-23a-3p可与SNHG17相互作用,并在大肠腺癌细胞中形成ceRNA网络,调节CXCL12介导的血管生成,从而加速大肠腺癌中的细胞增殖及迁移。这些研究都提示SNHG17可能是治疗结直肠癌的一个新靶点。
4.2 呼吸系统肿瘤——肺癌 近年来,肺癌的发病率及死亡率均明显增高,仍然是全球最常见的恶性肿瘤之一。因此,了解肺癌进展的相关分子机制对于寻找治疗靶点具有重要意义。有研究发现,SNHG17与p57在肺癌中的表达呈负相关,沉默SNHG17可上调p57的表达,并抑制肿瘤细胞的增殖、迁移及侵袭能力,表明SNHG17可能通过调节p57的表达来促进肺癌的进展[33]。这为SNHG17作为新的肺癌诊断标志物提供了理论依据,但二者在肺癌中的具体作用机制仍有待深入探讨。
4.2.1 肺腺癌 Li等[30]研究发现,SNHG17在肺腺癌细胞中定位于细胞质,并通过生物信息学分析证实miR-485-5p可能是SNHG17的潜在靶点,可抑制肺腺癌细胞的生长及迁移,而Wntless(WLS)是miR-485-5p的下游靶点。所有研究数据均证实SNHG17通过靶向miR-485-5p/WLS轴在肺腺癌中作为癌基因发挥作用。这表明SNHG17可能是肺腺癌治疗的新靶点,但目前尚缺乏相关临床研究。为了更准确地证实SNHG17/miR-485-5p/WLS轴在肺腺癌中的作用,后续仍需进一步深入探究。
4.2.2 非小细胞肺癌(non-small cell lung cancer,NSCLC) NSCLC是常见的肺癌类型,尽管目前在外科手术、分子靶向治疗、化疗及放疗等综合治疗方面取得了较多进展,但NSCLC患者的总体5年生存率仍低于15%[46]。因此,深入探讨NSCLC进展的潜在机制及分子通路对NSCLC的精准治疗具有重要意义。
Xu等[31]通过qRT-PCR及Western blotting鉴定了3个潜在的下游基因(FOXA1、XAF1及BIK),它们可能是SNHG17在NSCLC中促进肿瘤细胞增殖及凋亡的潜在靶点。其中FOXA1可通过与非编码RNA相互作用增强NSCLC的化疗耐药性,且其表达在SNHG17敲除后下调[47]。XAF1已经被证实是一种肿瘤抑制因子,可促进癌细胞的凋亡。而BIK是Bcl2家族的一员,因其在促凋亡中具有关键作用,而被认为是一种肿瘤抑制因子[31]。总之,SNHG17可能与3个潜在的下游基因相互作用,调控NSCLC的发生发展,但其具体作用机制尚不清楚。随后,有研究采用生物信息学方法预测并鉴定了与SNHG17相互作用的微小RNA——miR-23b-3p,发现沉默SNHG17可导致NSCLC细胞系中miR-23b-3p水平升高,过表达miR-23b-3p能抑制NSCLC细胞系中SNHG17的表达,表明SNHG17可能通过竞争性结合miR-23b-3p参与NSCLC的发生发展[32]。
4.3 泌尿生殖系统肿瘤 近年来,对泌尿生殖系统恶性肿瘤的发病机制及新治疗策略的研究已经非常广泛,特别是对新治疗靶点的探索已经成为研究热点。最新研究表明,SNHG17在各种泌尿生殖系统癌症的发生发展中起重要作用[48]。
4.3.1 肾透明细胞癌(ccRCC) 谢天琪等[26]利用从ccRCC数据集中筛选的差异表达基因、差异1ncRNA及其上游miRNA探索白草芦醇的可能作用靶点,构建ccRCC的ceRNA网络,最终构建了AL136040.1、SNHG17与hsa-miR-25-3p、hsa-miR-23a-3p及COL1A2、HRG的ceRNA调控网络,发现白草芦醇与2个mRNA均可良好地对接,表明AL136040.1、SNHG17与hsa-miR-25-3p、hsa-miR-23a-3p可能竞争性调控COLIA2、HRG,进而影响ccRCC的预后,这也可能是白草芦醇治疗ccRCC的潜在机制。
4.3.2 前列腺癌 Bai等[27]研究发现,SNHG17主要位于前列腺癌细胞的胞质中,提示其可能具有调控前列腺癌进程的作用。这与之前的报道[16]存在差异,导致这种差异的原因可能是lncRNAs(具有高度组织特异性及肿瘤特异性)的高度异质性基因表达模式及功能。进一步研究发现,在前列腺癌组织中CD51与SNHG17的表达呈正相关,提示已知的前列腺癌症干细胞(pCSC)生物标志物CD51是SNHG17在PCa细胞中的下游靶点及功能介质。更有趣的是,CD51被发现是前列腺癌细胞中miR-144的直接靶点,SNHG17可以直接与miR-144结合,进而靶向CD51来抑制前列腺癌的增殖及侵袭,为其诊断及治疗提供了新的生物标志物[27]。Wu等[29]首次证实了SNHG17及其同系物SNORA71B是前列腺癌的致癌基因,可被信号转导子及STAT5A转录激活,而生物信息学分析显示miR-339-5p与STAT5A及SNHG17均有相互作用。最终,该研究证实SNHG17/miR-339-5p/STAT5A正反馈环可诱导前列腺癌细胞中SNORA71B的表达,从而促进其增殖、迁移、侵袭及上皮-间充质转化(epithelialmesenchymal transition,EMT)过程,并抑制其凋亡。这些发现为临床寻求更好的前列腺癌治疗效果及预后提供了新思路。最近,有研究表明SNHG17诱导前列腺癌肿瘤生长与β-连环蛋白/T细胞因子(TCF)活性相关,这也确定了前列腺癌肿瘤细胞中的SNHG17/β-连环蛋白/TCF轴;然而,不能排除可能还有其他机制的参与[28]。
4.3.3 乳腺癌 乳腺癌是最常见的恶性肿瘤之一,也是全世界女性癌症相关死亡的主要原因[49]。尽管近年来乳腺癌的治疗方式有了明显的改善,但临床预后仍然较差。因此,迫切需要探索乳腺癌进展的分子机制,以开发新的治疗靶点。
Du等[25]发现SNHG17的表达主要集中在乳腺癌细胞的细胞质部分,表明SNHG17可以与miRNA相互作用。生物信息学分析确定了miR-124-3p是乳腺癌细胞中SNHG17的内源性海绵,而其表达与SNHG17呈负相关,并参与了SNHG17介导的乳腺癌进展。这些结果提示SNHG17通过靶向调节miR124-3p的表达而影响乳腺癌的生物学进程,突出了SNHG17作为乳腺癌的生物标志物及临床治疗靶点的潜力。
4.3.4 卵巢癌 卵巢癌是女性常见的生殖系统恶性肿瘤之一,每年可导致全球10万以上女性死亡。由于其发病隐匿、进展迅速、预后不良,已成为导致女性死亡的第五大原因[50]。虽然目前手术治疗及化疗药物已在临床上广泛应用,但患者5年生存率仍然较低。因此,阐明新基因的功能与卵巢癌发病机制之间的关系,对研发治疗药物及预测预后具有重要意义。
Zheng等[23]发现,在卵巢癌组织及细胞系中,FOXA1与SNHG17表达之间存在调节关系:敲除SNHG17后,FOXA1mRNA及蛋白表达水平均明显降低;而当FOXA1表达下调时,SNHG17的表达也显著下降;FOXA1的下调也可以像SNHG17一样减弱细胞的增殖及侵袭能力。因此,SNHG17可能通过上调FOXA1的表达促进细胞增殖及侵袭能力,从而参与卵巢癌的发生、发展。还有研究发现SNHG17主要分布在细胞质中,可作为miR-214-3p的分子海绵上调重要的细胞周期调节因子CDK6的表达,从而促进卵巢癌细胞的细胞周期进程[24]。可见,SNHG17可能是一个有前途的卵巢癌预后生物标志物及治疗靶点。
4.4 其他系统肿瘤
4.4.1 OSCC Tong等[9]通过生物信息学及荧光素酶报告分析证实,miR-375是SNHG17潜在靶点之一,并受其负向调控;还发现miR-375能与PAX6的3'UTR结合,SNHG17可能通过miR-375/PAX6轴调控OSCC细胞的增殖、迁移、侵袭及凋亡。然而,还需要进一步研究证实PAX6在OSCC中的致癌作用。另有研究发现SNHG17/miR-384/ELF1轴可通过调控CTNNB1的表达而激活Wnt/β-catenin信号通路,从而促进OSCC细胞生长[11]。这拓展了对OSCC进展的认识,为其诊断及治疗提供了新的理论依据。此外,舌鳞状细胞癌作为OSCC的一部分,也有研究发现SNHG17可作为其miR-876的分子海绵,从而减弱miR-876对SP1表达的抑制作用,并促进其侵袭性进展[10]。
4.4.2 胶质瘤 胶质瘤是中枢神经系统常见的原发性肿瘤,其复发率及病死率均较高[51]。尽管治疗方式(如手术、放疗、化疗等)取得了很大进步,但大多数患者的OS仍然很短。因此,探索胶质瘤的发病机制、研究其新的治疗靶点至关重要。
L i 等[35]研究发现,转录因子Y Y 1 可通过与SNHG17启动子结合增加SNHG17的表达,促进胶质瘤的发生、发展,推测SNHG17可以调节Wnt/β-catenin信号通路的活性;另外,该研究还发现加入Wnt/β-catenin信号通路抑制剂后胶质瘤细胞增殖受到抑制,细胞凋亡增强,表明YY1诱导SNHG17激活Wnt/β-catenin信号通路促进了胶质瘤的进展。为了探究其原因,Li等[35]研究发现,CTNNB1基因可能激活Wnt/β-catenin信号通路,而其与SNHG17的表达呈正相关。该研究还证实了胶质瘤中lncRNAs通过海绵状miRNAs调节mRNA表达的模式,发现SNHG17通过负调控miR-506-3p影响CTNNB1的表达。总之,YY1诱导的SNHG17通过靶向miR-506-3p/CTNNB1轴激活Wnt/β-catenin信号通路促进胶质瘤的进展。随后,又有研究发现SNHG17/miR-23b-3p/ZHX1轴在胶质瘤中发挥着重要作用[34]。而星形细胞瘤作为一种预后较好的神经胶质瘤,同样也受到SNHG17相关分子机制的调控,后者可通过靶向miR-876-5p/ERLIN2途径促进星形细胞瘤细胞的增殖、迁移及侵袭[36]。上述发现为胶质瘤的诊断及治疗提供了前瞻性的生物标志物及治疗靶点。
4.4.3 其他肿瘤 Gao等[37]发现转录因子STAT3诱导的SNHG17上调可通过激活PI3K/Akt信号通路促进黑色素瘤的进展。而在骨肉瘤中,SNHG17被证实作为miR-324-3p的ceRNA参与其发生发展[38]。
总之,SNHG17在大多数肿瘤中起着调节作用,在未来的研究中可以作为肿瘤靶向治疗的关键因子。
5 总结与展望
近年来对lncRNA的研究方兴未艾。得益于基因测序等技术的快速发展,越来越多的lncRNA被人们所熟悉[52],大量证据表明lncRNA是一种潜在的癌基因或抑癌基因,参与了肿瘤的发生、发展。SNHG17作为一种lncRNA,近年来研究发现其在许多肿瘤中广泛过表达,且其表达水平与肿瘤的病理生理学特征及患者的预后密切相关。然而,其特定的分子机制及在人类肿瘤中选择性上调的原因仍不清楚。SNHG17作为一种致癌因子,参与了肿瘤细胞增殖、迁移、侵袭、凋亡的调控,可能用于癌症的诊断及治疗。据报道,与蛋白质类似,lncRNAs也可以与蛋白质或miRNAs结合,这取决于其亚细胞位置:如果lncRNAs定位于细胞核内,它们通常与蛋白质结合,在转录水平上调控靶基因的表达;如果lncRNAs主要分布在细胞质中,它们很可能通过充当ceRNA在转录后水平增强靶基因的表达[27]。为进一步了解SNHG17的功能特性,有研究使用lncLocator数据库对SNHG17基因序列进行分析,最终得出结论:SNHG17主要作为ceRNA在细胞质中进行基因调控,其次也可与核因子相互作用,在细胞核中进行基因调控[53]。在具体机制上,SNHG17可通过与转录因子相互作用启动转录、直接结合及上调mRNAs、作为ceRNA吸附多种miRNA、激活通常参与癌症发展及进展的信号通路(如β-catenin/TCF等)来调控肿瘤的恶性生物学行为,不同程度地促进肿瘤细胞的增殖、侵袭及迁移,或抑制细胞凋亡,极大影响患者的预后。然而,尽管SNHG17广泛存在于肿瘤组织中,但其在体液中的表达水平及化学稳定性尚未得到验证,因此有必要进行更深层次的临床研究加以证实。
综上所述,SNHG17可能参与人类癌症的发生及发展,并在其中发挥着自己的作用。因此,它很可能成为癌症诊断及治疗中潜在的生物标志物和治疗靶点,并作为一种新的癌症治疗选择应用于未来更多的研究中。
致谢:诚挚感谢甘肃省人民医院普外临床中心、甘肃省人民医院普外质量控制中心、甘肃省外科肿瘤分子诊断与精准治疗重点实验室在本文完成过程中给予的帮助及大力支持。
