续断皂苷VI调控Wnt/β-Catenin通路对骨质疏松的影响机制*
2022-10-15黄志荣胡中立章智华
张 强,张 敏,黄志荣,王 高,胡中立,章智华
(江西中医药大学附属洪都中医院 南昌 330006)
骨质疏松症是一种以骨质流失、骨纤维变性,骨脆性增加为特征的老年常见疾病。骨质疏松症的发病率较高,常见于绝经后妇女和老年男性。目前,全球范围内约有四成的绝经后妇女正在忍受骨质疏松症带来的病痛,随着世界人口老龄化的增加,该数字可能在不久的将来逐年增长[1-2]。骨质疏松会导致骨痛、骨质疏松性骨折等并发症,其中骨质疏松导致的骨折的危害巨大,是老年患者致残和致死的主要原因之一,这严重影响患者的生活质量和生命安全,给患者的经济也带来沉重的负担[3]。骨质疏松症的发病机制复杂多样,且与生活方式、服用药物等多种因素相关。研究表明[4-6],Wnt/β-catenin信号通路中关键蛋白的表达与骨质疏松的发生及缓解密切相关,其异常表达会造成骨形成障碍,进而诱导骨质疏松症发生。
续断皂苷VI(Asperosaponin VI)又名木通皂苷D,提取自续断,为川续断科多年生草本植物川续断Dipsacus asperWall.ex Henry的干燥根,因能“续折接骨”而得名。续断皂苷VI是一种用于止血、促进骨损伤愈合、降低子宫收缩、补肝肾的白色结晶药物。中医医生利用续断皂苷VI,根据经典著作《本经》并结合临床经验研制出温肾强骨丸,其具有强筋壮骨、活血通络的功能。经长期临床应用证实,其对骨质疏松症有很好的临床疗效[7-9],但其作用机制尚不清楚。有研究发现[10]续断皂苷VI治疗处理后相关蛋白质表达谱的变化,并证实续断皂苷VI治疗可以调节骨骼肌能量代谢,物质运输和卵巢切除大鼠骨质疏松症。另一项研究发现,续断皂苷VI治疗可以改变Wnt/β-catenin信号通路表达强度,调高应激因子的表达,从而起到治疗骨质疏松的作用[11],其主要组成成分-木通皂苷D可将骨髓间充质干细胞分化为成骨细胞,这也与Wnt/β-catenin信号通路密切相关[12-13]。因此,在前人研究的基础上,我们通过检测SOST等指标来研究续断皂苷VI治疗对骨质疏松的影响及作用机制。
本实验观察续断皂苷VI对骨质疏松大鼠的作用,并探索其可能的作用机制是否是与Wnt/β-Catenin信号通路的激活相关,为骨质疏松的防治提供实验数据依据,另外,通过动物实验研究续断皂苷VI在治疗骨质疏松症中的潜在应用价值,以及驱动这种效应产生可能的机制,为防治骨质疏松症提供重要参考和依据。
1 实验材料
1.1 实验动物
SPF级的雌性成年Wistar大鼠50只,体质量200±10 g。年龄8周龄。购自常州卡文斯实验动物有限公司。大鼠饲养于SPF级环境下,定时辐照灭菌,实验全程给予所有大鼠便捷自由的饮水和采食设备,随时观察大鼠状态,排除饲养过程中产生的系统误差。适应性喂养1周后,开始实验建模。
1.2 实验用药及引物来源
续断皂苷VI,药片制,每片10 mg总容量,使用时研磨成细粉,每1 g溶解于87 mL水。货号:PU0602-0025,购自美国PhytoUnico公司。Wnt3a、β-catenin、LRP5、Runx2、SOST、Osx引物由Bomedical Engineering公司合成。使用针对β-actin的抗体:Wnt3a、βcatenin、LRP5、Runx2、SOST、Osx作为对照,抗体购自武汉博斯特生物有限公司。
2 实验方法
2.1 分组和药物处理
购置50只SPF级雌性大鼠,先适应性饲养7天,后随机分为4组:续断皂苷VI组,模型组,假手术组和对照组。模型组和续断皂苷VI组大鼠通过切除卵巢以诱发骨质疏松症,建立大鼠骨质疏松模型[14]。假手术组大鼠切除卵巢周围的少量脂肪组织。对照组未接受任何处理。术后续断皂苷VI组的大鼠连续给药12周。根据人类使用续断皂苷VI的日剂量调整大鼠的给药量,不同患者在治疗时使用的临床剂量可通过给药量与体表之比确定,使用相同的方法,测量每只大鼠的体表面积,计算临床给药量。其他组给予等剂量的0.9%生理盐水。
2.2 取样方法
给药84天后,将大鼠禁食1天。经腹主动脉取血,将血清进行分离后,放入-80℃冰箱中保存备用。取大鼠右后肢股骨,将其与肌肉等其他组织剥去并碎化后,放入事先准备好的无菌EP管中,于-80℃冰箱中保存,备用。
2.3 检测方法
2.3.1 骨密度(BMD)测定
应用X线骨密度仪,先在给药前进行检测,测定各组大鼠股骨的BMD,停止给药后,再次继续检测,测定各组大鼠BMD,并根据给药前后时间节点,对大鼠BMD变化情况进行观察[13]。
2.3.2 最大载荷测定
取各组大鼠左后肢股骨,首先剔除股骨上的肌肉,再剔除股骨上的其他组织,最后进行称重。将取好的各组大鼠去除组织的股骨置于生物力学测定仪基座上并固定。当测定仪前端自动挤压股骨断裂时,记录数值。
2.3.3 免疫组织化学法
使用蛋白免疫组织化学染色法观察成骨细胞的形态,检测Wnt3a、β-catenin、LRP5、Runx2、SOST和Osx蛋白的表达。通过DAB显色反应,进行所要检测蛋白抗原的半定量。并且拍照成骨细胞的形态。
2.3.4 RT-PCR
将保存的各组大鼠股骨立即浸入液氮中,在液氮保护下,迅速研磨至细粉。应用Trizol法提取各组大鼠骨组织中的总RNA。取适量RNA按照试剂盒说明进行反转录实验。以β-actin作为内参基因,分析各组样品mRNA的相对表达量,进行差异比较。引物序列见表1。

表1 RT-PCR引物碱基序列
2.3.5 Western blot分析
检测Wnt3a、β-catenin、LRP5、Runx2、SOST和Osx蛋白的表达。本研究中使用的抗体是:Wnt3a、βcatenin、LRP5、Runx2、SOST、Osx。使用针对β-肌动蛋白的抗体作为对照(Bomedical Engineering公司)。
2.4 统计结果策略
统计实验结果并将每个结果以均值±标准差(x—±s)统计差异。统计学有意义的差异的判定为P<0.05。实验数据使用SPSS统计软件22.0版本进行数据分析,实验数据的组间比较使用t检验进行。
3 结果
3.1 骨质疏松组织形态学观察
如图1所示,续断皂苷VI治疗组的骨小梁结构比模型组更完整,排列更整齐,稍薄一些,只有少量的空骨缺损,没有明显的骨折和吸收。模型组小梁结构缺损排列不规则,变薄,复位,骨孔大量,轻度骨折。假手术组与对照组相似。骨小梁结构完美,骨小梁没有被吸收,穿孔和折断。对照组的股骨HE染色显示小梁的结构排列良好,直径小,间隔小。

图1 HE染色组织学观察
组织形态学变量包括小梁分离度(TbSp,Trabecular separation),小 梁 数 钼(TbN,Trabecular number),小梁厚度(TbTh,Trabecular thickness)和小梁面积百分比(TbAr,Trabecular Area)。模型组与假手术组,对照组相比有显著差异(P<0.05)。续断皂苷VI治疗治疗12周后,续断皂苷VI治疗组的四项指标与模型组相比有差异(*P<0.05)。续断皂苷VI治疗组的骨小梁数目及厚度与假手术组和对照组的实验结果有显著差异(#P<0.05,&P<0.05)(表2、图2)。
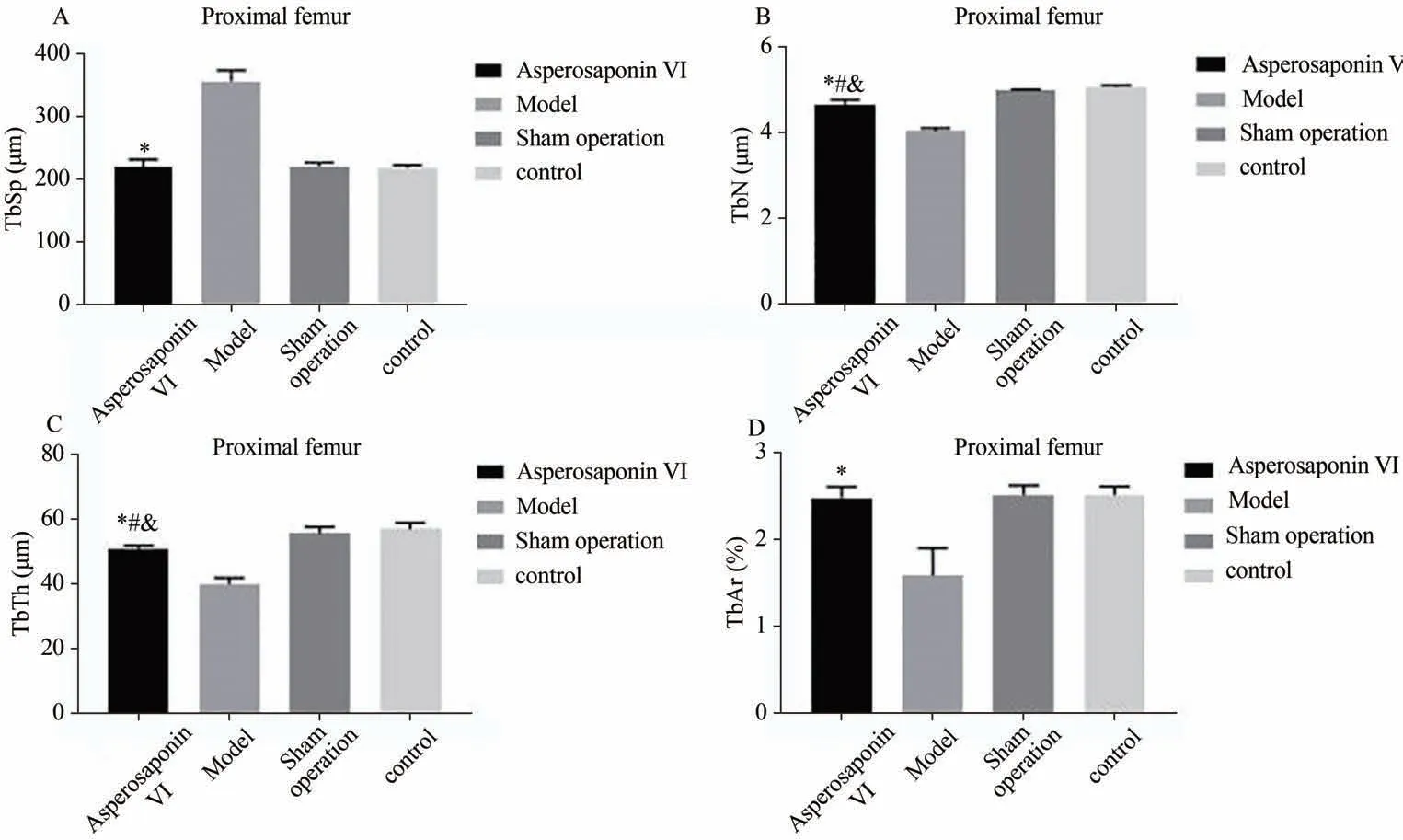
图2 病理评分比较

表2 病理评分比较
3.2 检测股骨生物学的抗弯曲力和抗挤压力
续断皂苷VI组进行药物处理12周后,模型组与假手术组,对照组相比有显著差异(P<0.05),续断皂苷VI组与模型组的最大负荷(ML,maximum load)和弹性模量(EM,elasticity modulus)显著不同(*P<0.05),与空白对照组与假手术组之间无明显差异(表3、图3)。

表3 L2椎体的最大负荷和弹性模量

图3 L2椎体的最大负荷和弹性模量
如图4所示,使用蛋白免疫组织化学染色观察成骨细胞的形态。除SOST外,续断皂苷VI治疗组,对照组和假手术组的Wnt3a、β-catenin、LRP5、Runx2和Osx蛋白的表达比模型组低,其他组比模型组高(表4)。其中,假手术组中LRP5和Osx蛋白染色最深,对照组中Wnt3a、β-catenin和Runx2染色最深,模型组SOST蛋白表达水平高于其他组。续断皂苷VI治疗组,假手术组和模型组的β-catenin染色程度均较对照组轻(图4)。续断皂苷VI治疗组,假手术组和对照组中Wnt3a、β-catenin、LRP5、Runx2和Osx蛋白的表达均高于模型组(图5)。

图5 免疫组织化学法染色半定量

表4 免疫组织化学法染色蛋白表达差异

图4 免疫组织化学法染色蛋白表达差异
3.4 RT-PCR中Wnt3a、LRP5、β-catenin、Runx2和Osx mRNA的表达
如图6所示,第6天,含续断皂苷VI治疗的血清中Wnt3a、LRP5、β-catenin、Runx2和Osx mRNA的表达高于其他各组,尤其是模型组(*P<0.05,#P<0.05,&P<0.05)。续断皂苷VI治疗组的SOST mRNA水平明显低于模型组,略高于假手术组和对照组(*P<0.05,#P<0.05,&P<0.05)(表5)。

表5 Wnt3a、LRP5、β-catenin、Runx2和Osx mRNA的表达

图6 RT-PCR mRNA的表达差异
3.5 Wnt/β-Catenin信号通路的蛋白表达对比
与假手术组与空白对照组相比,模型组SOST表达明显上调,Wnt3a、β-catenin、Runx2、Osx表达明显降低(表6)。与模型组相比,续断皂苷VI治疗组SOST表达明显下调,Wnt3a、β-catenin、Runx2、Osx表达明显升高。与假手术组相比,续断皂苷VI治疗组SOST的表达略有差异,Wnt3a、β-catenin和Osx的表达较弱,Runx2的表达较弱。与对照组相比,结果与假手术组相似。各组中LRP5的表达水平变化不大(图7-图8)。

图7 Wntβ-Catenin信号通路的蛋白表达对比

图8 Wntβ-Catenin信号通路的蛋白表达对比

表6 Wnt/β-Catenin信号通路的蛋白表达对比
4 讨论
Wnt信号通路的触发机制为Wnt蛋白家族的成员与卷曲蛋白(Fz,G蛋白偶联受体样蛋白)和LRP5或LRP6的共受体复合物结合。通过募集几种蛋白质到激活的Fz和LRP5和LRP6共受体的C末端细胞内部分来传输信号。修饰蛋白质后,可基于Wnt-LRP5和LRP6-Fz配合物的特异性,激活3个独立的途径:经典Wnt信号传导,Wnt/PCP途径和Wnt/Ca2+途径。这三种途径均调节LRP5和LRP6下游骨形成,而经典的Wnt信号途径是目前研究最多的途径。经典的Wnt信号通路需要活性LRP5和LRP6,以及许多细胞外激动剂,拮抗剂和细胞内酶调节剂来调节[15-18]。Wnt信号的细胞外调节剂主要包括2种天然抑制剂,每种都靶向一种Wnt共同受体的信号转导[19]。第一种(Fz相关分泌蛋白)结合并中和Wnt蛋白,溶剂化Fz受体并阻止Wnt与Fz的结合。另一个包括可导致信号转导的LRP5和LRP6受体结合的dickkopf(Dkk)和SOST。在细胞中,Wnt信号通路最典型的抑制剂是GSK-3β和支架蛋白axin[20]。这些蛋白质可形成β-catenin的磷酸化复合物,导致β-catenin降解,最后在细胞核中,β-catenin/Tcf复合物具有转录活性,或者也严格控制了核的ar定位。例如,研究表明Ctnnbip1/Icat或Cby/Chibby分别与β-catenin结合并抑制其与Tcf的相互作用并转移到细胞质中的过程[21]。转录阻遏物(例如Groucho)能够与Tcf的特定主体结合,从而中和其在β-catenin下游的活性。本研究结果显示,与假手术组与空白对照组相比,续断皂苷VI治疗组nt3a,βcatenin表达明显升高,与模型组相比,Wnt3a、βcatenin表达明显升高。
Runx2是经典WNT信号通路的直接靶点,对于成骨细胞的分化至关重要。先前的研究表明,小鼠和人类内Runx2基因的突变会导致颅骨发育不良和骨骼形成中的关键缺陷。成骨细胞含有一种名为Osx的特定转录因子,这种因子可在成骨细胞分化为成熟成骨细胞和骨细胞的过程中进行基因表达的调节,所以当发生Osx突变时,胚胎将不能形成骨骼并且不会表达特异性的成骨细胞标记基因。Runx2基因对于Osx表达至关重要[22-23],在骨形成过程中,只有在表达Runx2的前体中表达Osx才能诱导这些细胞分化为成熟的功能正常的成骨细胞。本研究结果显示,续断皂苷VI治疗组,假手术组和对照组中Runx2和Osx蛋白的表达均高于模型组。
SOST是Wnt信号通路的拮抗剂,与另一种Wnt拮抗物同源:Wise和Sclerotin是CCN蛋白家族的成员,其被认为具有结合、抑制BMP信号传导的能力。研究表明,CCN蛋白可通过结合LRP5和LRP6来抑制Wnt信号通路的表达[24]。此外,SOST几乎仅在骨细胞中表达,尽管在心脏,肝脏和肾脏等部位都可以表达SOST mRNA,但这些位点并未检测到SOST,表明SOST的表达具有高度的组织特异性。SOST可通过其与LRP5的结合起到负调节骨形成作用,一旦该过程被抑制,将导致高骨量综合症。本研究结果显示,与模型组相比,续断皂苷VI治疗组SOST表达明显下调,与假手术组和对照组相比,续断皂苷VI治疗组SOST的表达略有差异。骨质疏松性假性神经胶质瘤综合症(OPS)是一种常染色体显性遗传疾病,是因LRP5突变,与SOST结合失败,从而阻止了Wnt/β-catenin信号通路的激活,最终导致骨形成减少,从而导致骨质疏松。突变组中有范布赫姆病和硬化,它的骨密度要高得多,并且临床表现很明显,例如颅内压升高和耳聋。遗传分析表明,硬化症是由于SOST基因产物功能的丧失而引起的,而范布赫姆病则与SOST下游调控区的部分缺失有关。此外,研究表明,SOST基因敲除小鼠的骨矿物质密度和骨形成率增加了[26]。SOST不仅可以促进成骨成骨细胞的形成,而且还可以破坏骨骼。实验表明,SOST可以促进碳酸酐酶mRNA和蛋白的表达,降低细胞内pH值,并促进钙在矿化基质中的释放[27]。近年来,已经发现SOST可以通过剂量依赖的方式减少OPG mRNA的表达,增加RANKL mRNA的表达,增加RANKL/OPG的表达比。这表明,破骨细胞可使用依赖RANKL促进破骨细胞因子的方式被激活[28-29]。研究人员认为,嵌入骨最小化基质中的细胞是骨骼中的主要机械传感器,参与骨骼形成的调节并通过骨骼重塑确定骨骼质量和形状[30]。尽管尚未完全阐明SOST在骨细胞中的确切生理作用,但最近的数据表明SOST的表达受机械负荷和PTH的影响,可以局部缓解内源性Wnt抑制并激活骨形成。目前,研究人员已开发出SOST中和性单克隆抗体,并显示出强大的骨骼代谢活性。在灵长类动物研究中,它还具有强大的药代动力学特性和显著的代谢活性。另一项研究发现,SOST基因与骨质疏松可能与其表达产物有关。SOST可以抑制成骨细胞诱导的成骨细胞增殖和异位骨形成[31]。这表明,中国汉族妇女的SOST基因多态性与骨质疏松性骨折密切相关。
本研究中,续断皂苷VI治疗组的小梁骨密度显著高于对照组,并且束骨髓比增加,表明续断皂苷VI治疗对骨质增生有明显作用。续断皂苷VI治疗组股骨组织中SOST蛋白的含量明显低于对照组,β-catenin蛋白的含量明显高于对照组,Wnt信号通路的直接靶标Runx2和成骨细胞特异性转录因子明显增加,表明续断皂苷VI治疗可以降低SOST的含量,使Wnt/βcatenin途径顺利进行,促进骨骼形成。对照组中SOST蛋白的升高和β-catenin含量的降低也证实了SOST蛋白在骨质疏松症的形成中起着重要作用——阻止SOST表达,促发骨形成,抑止骨吸收,为治疗各种病因引起的骨质流失提供了一种新途径。由于Wnt途径参与多种代谢途径,因此该途径的激活可能与其他疾病的复发有关,并且,由于SOST具有成骨细胞特异性,这也使SOST其自身成为治疗骨质疏松症的潜在靶标。另外,本文通过科学严谨的实验探索续断皂苷VI调控Wnt/β-Catenin通路对骨质疏松的影响机制,推动了课题的发展,为课题提供了有理有据的实验依据,对于课题的发展具有不可替代的重要意义。相信随着分子遗传学和免疫学技术的进一步发展以及人们对SOST基因的深入了解,骨质疏松症的发病原因及断皂苷VI治疗骨质疏松症的机制通路将被明确阐述。
