奥美拉唑原料药微生物限度检查法的方法学验证
2022-10-15王琪黄臻辉
王琪 黄臻辉
(上海上药第一生化药业有限公司 上海 200240)
奥美拉唑作为质子泵抑制剂,有较强的抑制胃酸作用,主要用于治疗十二指肠溃疡和卓-艾综合征,也可用于胃溃疡和反流性食管炎[1]。其疗效优于H2受体拮抗剂及前列腺素E2、硫糖铝、胶体铋及大剂量抗酸剂,可迅速改善消化性溃疡和反流性食管炎的症状。由于中国药典2020年版中尚未收入其微生物限度检查项,故通过验证确立其微生物检查方法。
1 材料和方法
1.1 仪器
Sanyo MIR253恒温培养箱、SANYO MLS-3750高压蒸汽灭菌柜(三洋电机株式会社);JY-5002型电子天平(上海花潮电器有限公司);HTY-601集菌仪(浙江泰林生物技术股份有限公司);ESCO ClassⅡBSC生物安全柜(新加坡艺思高科技有限公司);HWS-24电热恒温水浴锅(上海一恒科学仪器有限公司)。
1.2 样品、培养基与试剂试液
奥美拉唑原料药(批号YF1203003、YF1203008、YF1112017,分别简称Ⅰ、Ⅱ、Ⅲ,浙江金华康恩贝生物制药有限公司);胰酪大豆胨琼脂培养基(TSA批号201119)、沙氏葡萄糖琼脂培养基(SDA批号201119)(上海中科昆虫生物技术开发有限公司);胰酪大豆胨琼脂对照培养基(TSA批号135025-201804)、沙氏葡萄糖琼脂对照培养基(SDA批号135013-201703)(中国食品药品检定研究院); 胰酪大豆胨液体培养基(TSB批号201112,默克化工技术(上海)有限公司);0.2、0.1和0.01 mol/L无菌NaOH溶液,0.9%无菌NaCl溶液,pH 7.0无菌氯化钠-蛋白胨缓冲液(均为实验室自配,经121 ℃、15 min灭菌后使用)。
1.3 菌种与菌液制备
金黄色葡萄球菌(Staphylococcus aureus)CMCC(B)26003、铜绿假单胞菌(Pseudomonas aeruginosa)CMCC(B)10104、枯草芽胞杆菌(Bacillus subtilis)CMCC(B)63501、白色假丝酵母(Candida albicans)CMCC(F)98001、黑曲霉(Aspergillus niger)CMCC(F)98003菌种均由上海市食品药品检验所提供。参照中国药典2020年版四部通则1105的方法培养菌种,制备成菌悬液或孢子悬液。
1.4 验证方法
1.4.1 培养基适用性检查
采用涂布法,分别将1×103CFU/mL的金黄色葡萄球菌、铜绿假单胞菌、枯草芽胞杆菌、白色假丝酵母和黑曲霉0.1 mL涂布在胰酪大豆胨琼脂培养基及其对照培养基上,将1×103CFU/mL的白色假丝酵母和黑曲霉0.1 mL涂布在沙氏葡萄糖琼脂培养基及其对照培养基上,按中国药典2020年版四部通则1105规定的温度和时间培养[2-5],每株试验菌平行制备2个平皿。
1.4.2 供试品稀释剂的选择及供试液的制备
由于奥美拉唑不溶于水,分别选择0.01、0.1、0.2 mol/L三个浓度的无菌NaOH溶液做溶解性试验,挑选出适宜浓度的NaOH溶液作为稀释剂,并确定该浓度溶液不会对试验造成干扰[2-5]。按平皿法,取溶解性试验确定后的浓度的无菌NaOH溶液10 mL,分别加入上述5种1×104CFU/mL的试验菌株0.1 mL,混匀作为稀释剂组。然后取1 mL分别倾注15~20 mL胰酪大豆胨琼脂培养基或沙氏葡萄糖琼脂培养基,平行制备2个平皿。同法测定,用0.9%无菌NaCl溶液替代稀释剂,加入相应的试验菌,作为菌液组。按中国药典2020年版四部通则1105规定的温度和时间培养后,取均值并计算回收率。
回收率=稀释剂组菌落数/菌液组菌落数。
取每批供试品10 g加入到0.1 mol/L无菌NaOH溶液200 mL中,混匀后,作为1∶20供试液,进行3次独立平行微生物限度检查试验。
1.4.3 平皿法
取供试液10 mL,分别加入上述5种1×104CFU/mL的试验菌株0.1 mL,混匀。然后取1 mL分别倾注15~20 mL胰酪大豆胨琼脂培养基或沙氏葡萄糖琼脂培养基,平行制备2个平皿,按中国药典2020年版四部通则1105规定的温度和时间培养作为试验组。同法测定,用0.9%无菌NaCl溶液替代供试液,加入相应的试验菌,作为菌液组;测定供试液本底菌菌落数,作为供试液对照组。培养后对菌落计数,取均值并计算回收率[5-9]。
回收率=(试验组-供试液对照组)/菌液组。
1.4.4 薄膜法
取1∶20供试液20 mL过滤(滤膜孔径为0.45 μm),用pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,冲洗量分别为50、100、150 mL,然后分别加入上述5种1×103CFU/mL的试验菌0.1 mL,抽滤,取膜,贴于相应的培养基上作为试验组;同法测定,用pH 7.0无菌氯化钠-蛋白胨缓冲液替代供试液,加入相应的试验菌,作为菌液组。按3个冲洗量测定供试液本底菌菌落数,作为供试液对照组。按中国药典2020年版四部通则1105的规定的温度和时间培养,平行制备2个平皿。培养后对菌落计数,取均值并计算回收率[5-9]。
回收率=(试验组菌落数-供试液对照组菌落数)/菌液组菌落数。
2 结果
2.1 培养基适用性检查
5种试验菌在两种培养基上的回收率均在0.5~2范围内(表1、2),符合药典规定,可用于供试品的方法适应性试验。
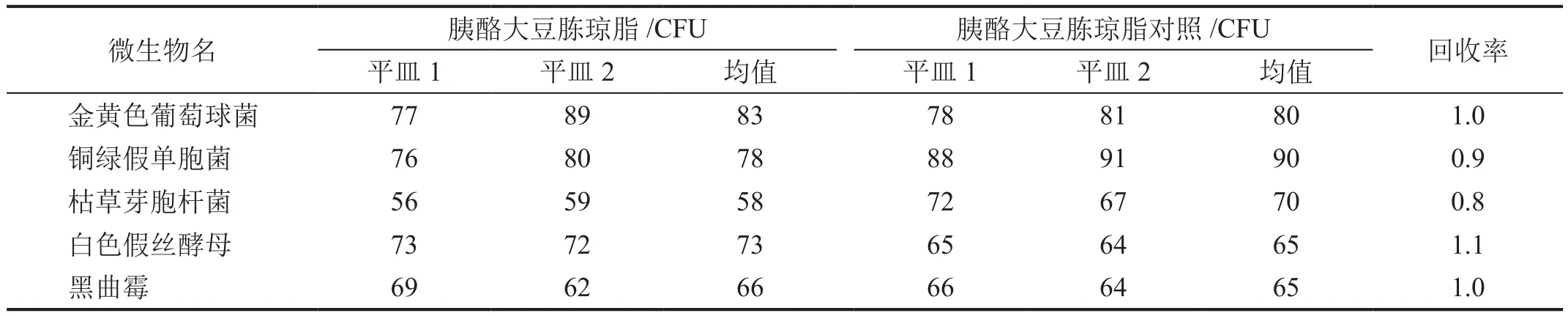
表1 培养基适用性检查1
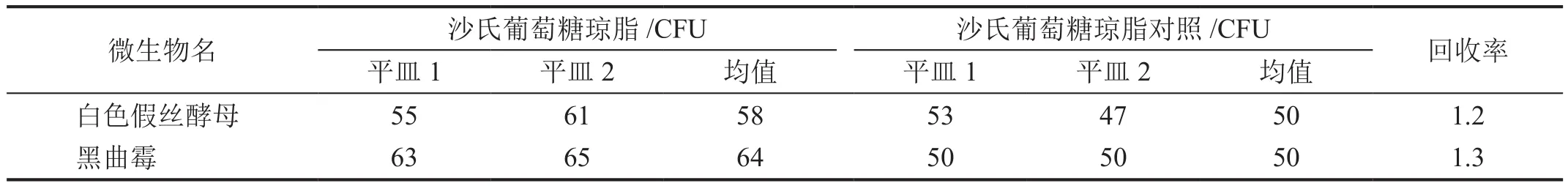
表2 培养基适用性检查2
2.2 稀释剂的选择
选取批号为YF1203003的奥美拉唑1 g进行溶解性试验,结果表明,其在0.1 mol/L的无菌NaOH溶液20 mL中溶解良好(表3),可作为奥美拉唑稀释剂;各试验菌在此浓度稀释剂中的回收率均在0.5~2范围内,并确认其对各微生物均无生长抑制作用(表4)。

表3 奥美拉唑在不同浓度、不同体积NaOH溶液中的溶解性
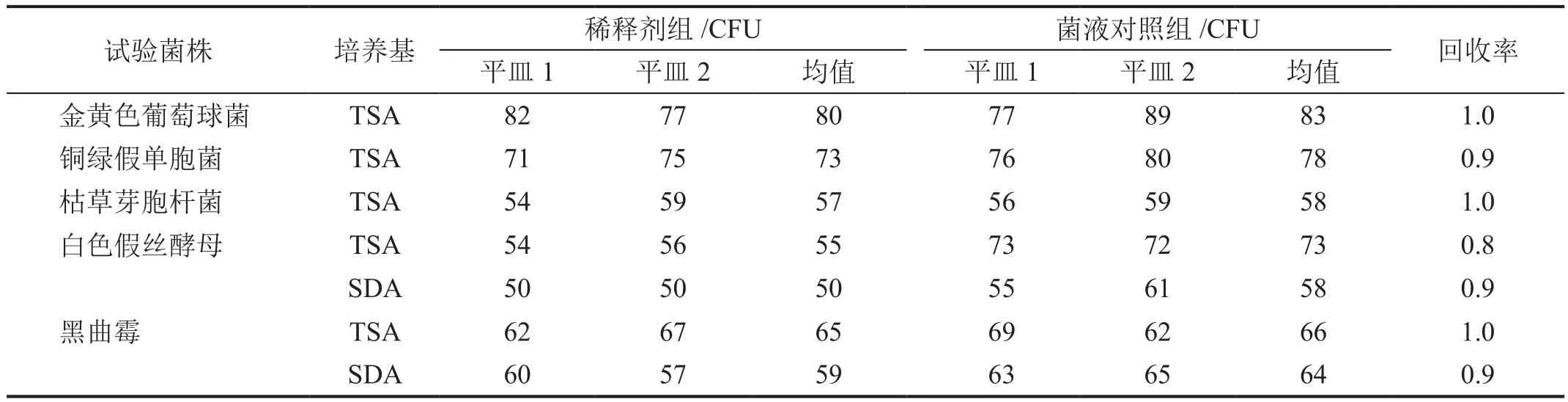
表4 各试验菌在稀释剂中的回收率
2.3 平皿法试验
采用平皿法进行验证时,单从需氧菌总数方法适用性试验结果发现奥美拉唑原料药供试液对铜绿假单胞菌和白色假丝酵母的生长有明显的抑制作用,而对其余3种试验菌的生长均无抑制作用(回收率均在0.5~2的范围内)(表5),故需采用薄膜过滤法再次进行验证。
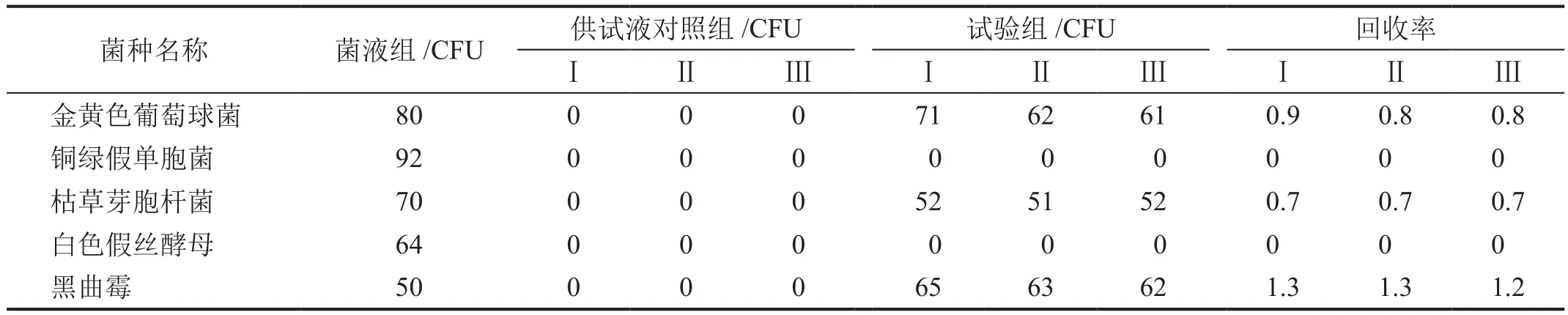
表5 平皿法检测各试验菌在供试液中的回收率
2.4 薄膜法试验
采用3种不同体积的pH 7.0氯化钠-蛋白胨缓冲液冲洗滤膜后,5种受试微生物的回收率均在0.5~2的范围内(表6~8),表明薄膜法对微生物的生长均无影响。为尽量避免滤膜上的微生物可能受损伤,最终选择最小冲洗量即50 mL/膜作为奥美拉唑微生物限度检查的冲洗量。
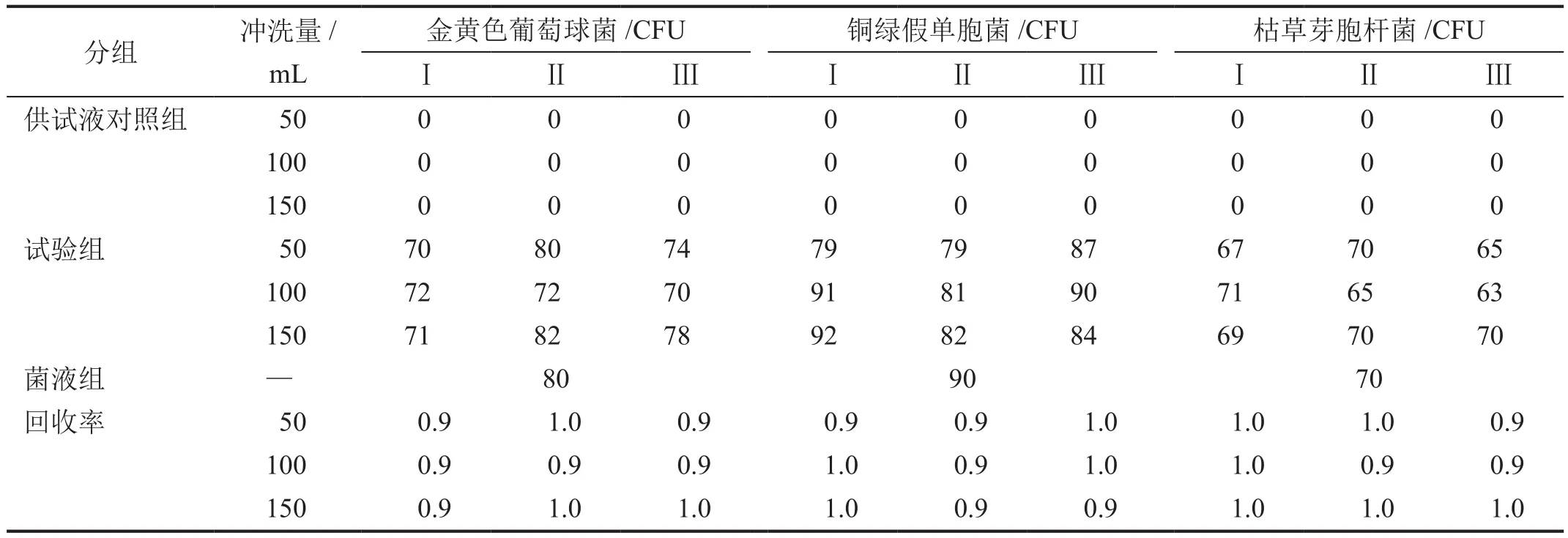
表6 需氧菌(细菌)在胰酪大豆胨琼脂培养基上的方法适用性试验
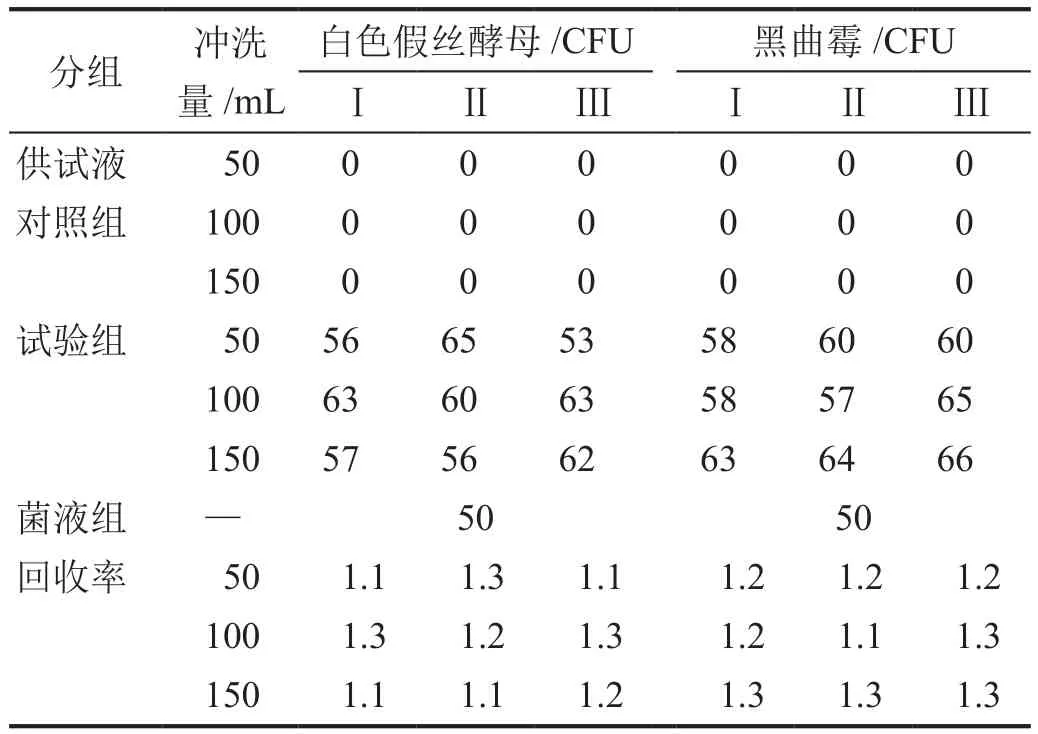
表7 需氧菌(真菌)在胰酪大豆胨琼脂培养基上的方法适用性试验
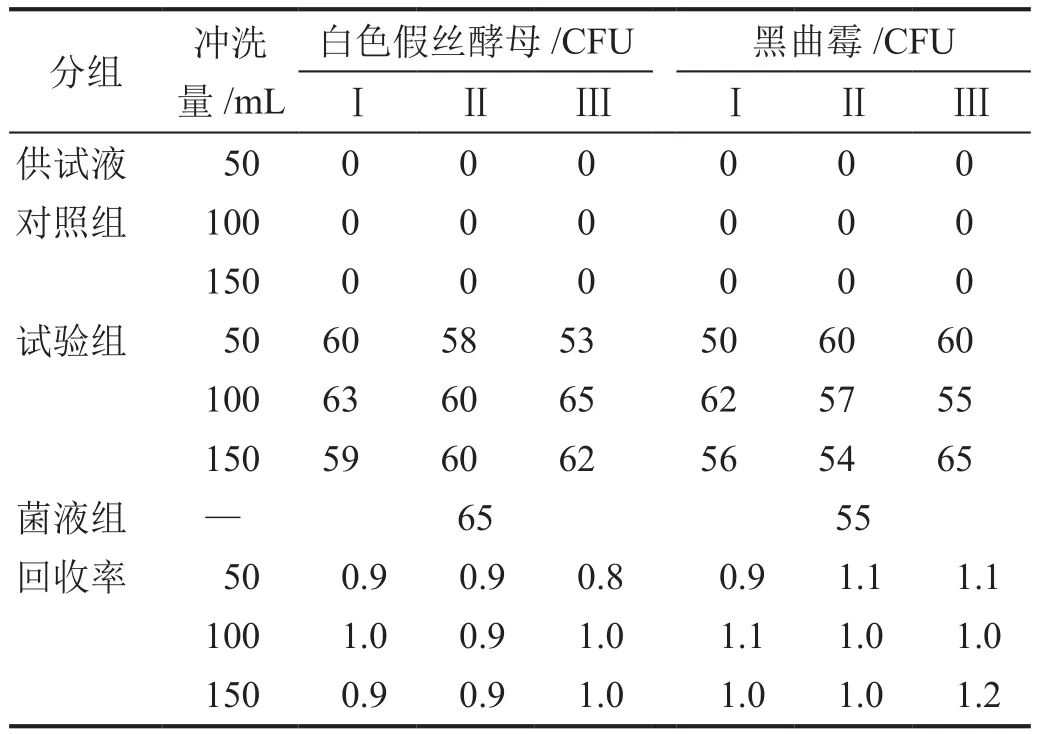
表8 真菌在沙氏葡萄糖琼脂培养基上的方法适用性试验
3 讨论
经两次试验验证,从平皿法试验结果可以看出奥美拉唑对金黄色葡萄球菌、枯草芽胞杆菌和黑曲霉的生长均无抑制作用,但对铜绿假单胞菌和白色假丝酵母的生长有一定的抑制作用。采用薄膜法可消除其对一些微生物生长的抑制作用,表明薄膜法适用于奥美拉唑原料药的微生物限度检查[10]。
日常检验中,可用10 g奥美拉唑原料药溶解于200 mL 0.1 mol/L的无菌NaOH溶液中,制成1∶20的供试液,取供试液20 mL,过滤,用pH 7.0无菌氯化钠-蛋白胨缓冲液50 mL冲洗滤膜,可去除奥美拉唑对铜绿假单胞菌和白色假丝酵母生长的抑制作用,使微生物限度试验能正常进行。
我们的研究结果显示,奥美拉唑对铜绿假单胞菌和白色假丝酵母生长有一定的抑制作用,但其确切的作用机理尚不明确,还有待继续研究探索。
