基于全基因组分析的肺炎克雷伯菌耐药性与流行病学特征分析*
2022-10-15熊流新黄志伟钟建辉陆丽苗梁启兰潘朝勇李淑英苏乐斌肇庆市第二人民医院a检验科重症监护室广东肇庆56060肇庆市疾病预防控制中心微生物检验科广东肇庆56060
熊流新,黄志伟,钟建辉,陆丽苗,梁启兰,潘朝勇,李淑英,苏乐斌(1. 肇庆市第二人民医院a. 检验科,b. 重症监护室,广东肇庆 56060;. 肇庆市疾病预防控制中心微生物检验科,广东肇庆 56060)
肺炎克雷伯菌(Klebsiellapneumoniae,KP)是临床上常见的条件致病菌之一,可引起患者肺炎、尿路感染、血流感染等一系列感染性疾病[1]。该菌对多种抗菌药物有着广泛的耐药机制,近几十年来多重耐药KP和泛耐药KP相继出现,使得在治疗医院获得性感染时选择适当的抗菌药物越来越难[2-3]。研究表明此类“超级细菌”感染人体后,会引起严重的并发症,病情严重者会引起死亡[4]。而具有泛耐药表型的耐碳青霉烯肺炎克雷伯菌(carbapenem-resistantKlebsiellapneumoniae,CRKP)更是为临床用药带来了巨大的挑战[5]。近年来,基于全基因组测序(whole gene sequencing, WGS)的分子流行学分析技术已被广泛应用于病原细菌的遗传进化、种群迁移和流行分析中[6],同时在爆发疫情的调查、菌株分子特征鉴别、传播途径识别等方面均发挥了重要的作用[7]。因此,本研究基于WGS技术对肺炎患者和外环境分离的KP进行测序与分析,以探明其分子病原学和流行病学特征,揭示种群发育进化关系和优势型别的流行趋势,为本地区KP分子数据库的建立提供必要数据。
1 材料与方法
1.1菌株来源和病例信息分析 根据《中国成人社区获得性肺炎诊断和治疗指南(2019版)》、《儿童社区获得性肺炎指南(2019版)》标准,收集2021年肇庆市第二人民医院临床肺炎患者KP分离株49株和怀疑院感爆发病例相关的医院外环境KP分离株2株,同时对患者进行流行病学调查。
1.2试剂与仪器 肠道菌群药敏试剂A1板(珠海迪尔公司),QIAamp DNA Mini Kit(德国凯杰公司)。Vitek 2 Compact全自动细菌鉴定及药敏分析系统(法国生物梅里埃公司),全自动飞行质谱仪(重庆中元汇吉公司),NanoDrop1000超微量分光光度计、Qubit DNA-HS(美国赛默飞世尔公司),Miseq、Nextera XT DNA Libray Preparation Kit(美国因美纳公司)。
1.3菌株鉴定及药敏试验 所有收集的菌株分离培养后使用Vitek 2 Compact全自动细菌鉴定及药敏分析系统和全自动飞行质谱仪进行鉴定。使用商品化肠道菌群药敏试剂A1板测定菌株对23种抗菌药物的最低抑菌浓度(minimum inhibitory concentration, MIC),结果按照美国临床和实验室标准协会(CLSI)2021 M100进行折点判断。生化鉴定和药敏试验的质控菌株为大肠埃希菌ATCC25922和肺炎克雷伯菌ATCC700603。
1.4菌株DNA提取、测序和组装 菌株基因组的DNA提取采用QIAamp DNA Mini Kit,按说明书操作,使用NanoDrop1000超微量分光光度计测定基因组DNA纯度,用Qubit DNA-HS检测试剂盒进行定量,基因组DNA的平均浓度为135 ng/μL,最终体积为100 μL。提取好的基因组测序在Miseq基因测序仪平台上完成,构建文库采用Nextera XT DNA Libray Preparation Kit,按说明书操作,获得的测序reads在CLC Genomics Workbench version 9.5.3新一代测序数据分析软件(德国凯杰公司)平台上进行质控和去除重复reads,并按de novo方式拼接、组装,获取contings。
1.5质粒、分子血清型的鉴定和多位点序列分型(multilocus sequence typing,MLST) 将菌株全基因组提交至Pathogenwatch(https://pathogen.watch/)[8]进行质粒、分子血清型的鉴定,并对KP的7个管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)进行匹配对比,以获得株菌的序列型别(sequence type,ST)。
1.6毒力基因和耐药基因 将菌株全基因组提交至VFBD(http://www.mgc.ac.cn/VFs/)[9]和CARD(https://card.mcmaster.ca/home)[10],对菌株的基因组进行毒力因子、耐药基因的鉴定与分析。
1.7全基因组进化分析 使用kSNP 3.0软件[11]对KP肺炎患者分离株中的优势流行血清型和ST的菌株和全球该型的参考对比菌株构建core-SNPs发育进化树。首先使用kSNP 3.0的Kchooser工具采用kmer算法,其他参数默认,对42株菌株的全基因组进行计算,得出k-mer值为k19,再以k19为计算参数,鉴定出core-SNPs,同时以core-SNPs组成序列,采用最大似然法构建进化树,并分析菌株的进化发育特征。
1.8统计学分析 采用SPSS 21.0对菌株进行统计分析,计数资料以百分比(%)表示,使用Graphad prism 9.0对整理好的数据作统计图。
2 结果
2.1流行病学资料分析 49例感染KP的肺炎患者中,87.76%(43/49)的患者有基础病,89.80%(44/49)的患者年龄大于50岁,好转出院者占95.21%(47/49)。感染来源方面,属于院内感染的患者占61.22%(30/49),属于社区感染的患者占38.78%(19/49)。
2.2药物敏感性试验 51株KP中有27株为CRKP,8株产超广谱β-内酰胺酶肺炎克雷伯菌,12株其他类型的多重耐药肺炎克雷伯菌。耐药谱以氯霉素+萘啶酸+复方磺胺甲噁唑+头孢噻肟+美罗培南+头孢他啶+厄他培南+环丙沙星+阿米卡星+氨苄西林/舒巴坦+四环素为优势谱型(24株)。有4株KP(ZQKP012、ZQKP033、ZQKP037和ZQKP038)对替加环素中介,51株KP全部对多黏菌素E敏感。见图1。
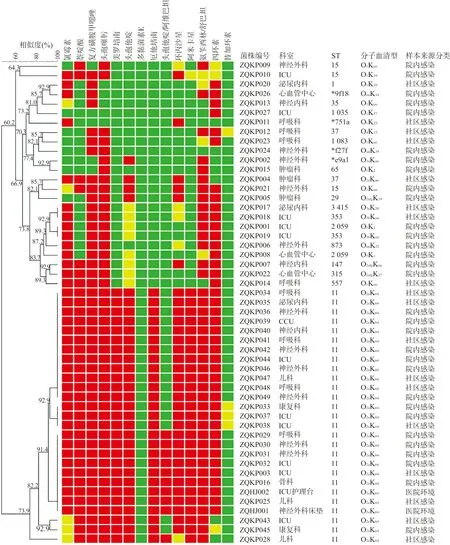
注:耐药;中介;敏感。图1 51株KP药物敏感性试验耐药谱热力图
2.3质粒、分子血清型的鉴定和MLST 共检出20种质粒,分别属于Col质粒家族、incF质粒家族、IncH质粒家族、IncB质粒、IncR质粒、IncX质粒、IncY质粒和pSM22质粒。51株KP中incF质粒家族的携带率最高,为94.11%(48/51),而且该质粒家族检测的亚型质粒也最多(7种)。在这20种质粒中,携带率最高的质粒是IncR和ColRNAⅠ(均为58.82%,30/51),其次为IncFⅡ(pHN7A8)(携带率为52.94%,27/51),其他质粒的携带率并不高,在1.96%~15.69%之间(见图2)。进一步对IncFⅡ(pHN7A8)进行质粒多位点序列分型(pMLST),结果均为F33:A-:B-型。分子血清型和MLST结果显示,共检测到19种血清型和19个ST,其中主要的优势血清型和ST分别为O2aK64(27株)、ST11(27株)。最小生成树显示,19个ST呈多态性分布,而组成优势ST(ST11)的菌株分离自9个科室,以神经外科(12株)和ICU(12株)分离的菌株为主,见图3。
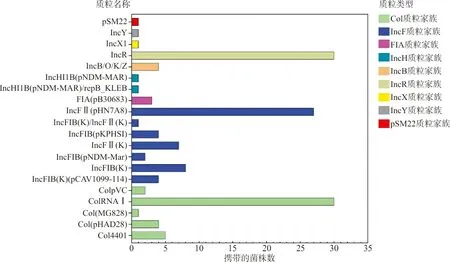
图2 51株KP质粒携带情况
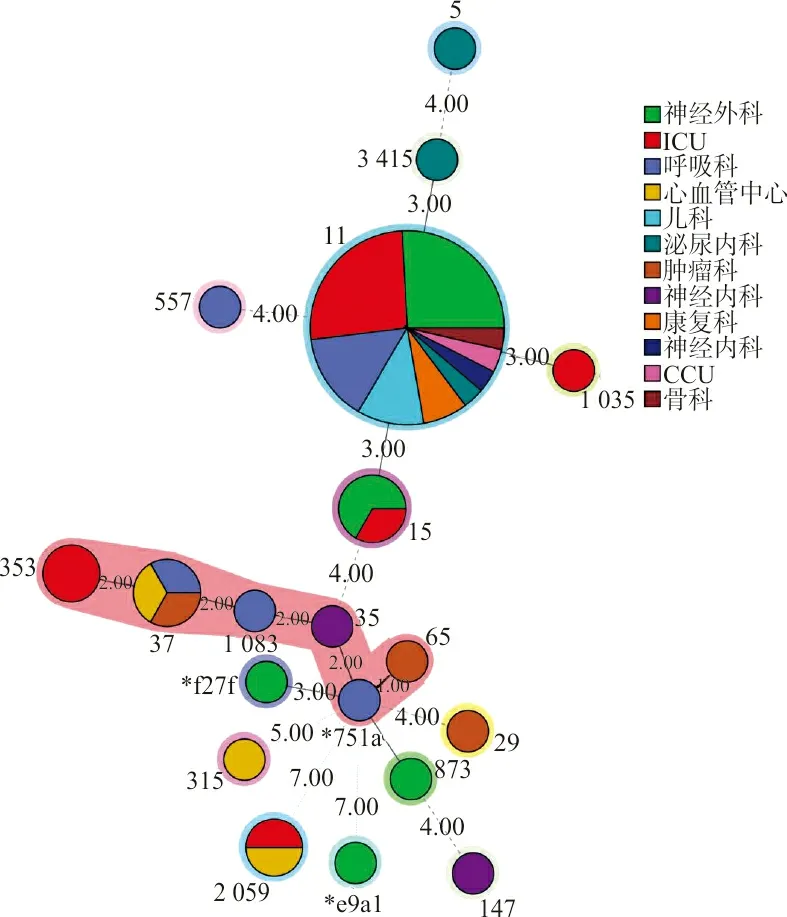
图3 51株KP MLST最小生成树
2.4毒力基因和耐药基因鉴定 51株KP菌株共携带61个毒力基因,彼此都携带的毒力基因有60个。存在携带差异的基因为脲酶基因ureB(有2株菌株携带,分别为ZQKP045、ZQKP052)。根据VFBD上对编码蛋白的注释,所有毒力基因编码的蛋白质产物分属7个功能组,分别为依附功能组(adherence)、抗吞噬功能组(antiphagocytosis)、外排泵功能组(efflux pump)、铁摄取功能组(iron uptake)、调节功能组(regulation)、分泌系统功能组(secretion system)和抗酸功能组(acid resistance)。在51株KP中未检出黏液表型调控基因rmpA和大肠杆菌素基因组(colibactin)。耐药基因的结果显示,51株KP共检出60个耐药基因,分属于14个抗菌药物耐药性(AMR)基因家族(见图4A)。在这些耐药基因中,菌株携带最多的基因是属于对β-内酰胺类渗透性降低的一般细菌性孔蛋白基因家族的KlebsiellapneumoniaeOmpK37和OmpA基因(49株携带),而检测的耐药基因最多家族则是β-内酰胺酶基因家族,有24个耐药基因(占40%,24/60)(见图4B),分属于10种不同亚型的β-内酰胺酶基因家族(blaCTX-M,blaampC,blaOXA,blaLAP,blaKPC,blaLEN,blaSHV,blaSRT,blaTEM,blaOKP)。耐药表型为CRKP的菌株均全部检出blaKPC-2基因,同时所有菌株也检出6种blaCTX-M基因和9种blaSHV基因。
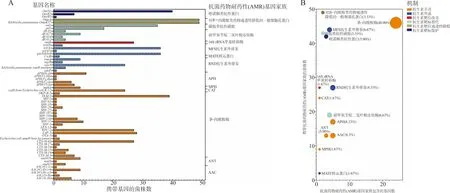
注: A,AMR基因家族的AAC为氨基糖苷乙酰转移酶;ANT为氨基糖苷核苷酸转移酶;CAT为氯霉素乙酰转移酶;MPH为大环内酯类磷酸转移酶;APH为氨基糖苷类磷酸转移酶;RND抗生素外排泵为耐药性结节细胞分裂抗生素外排泵;MATE转运蛋白为多药和有毒化合物挤出转运蛋白;MFS抗生素外排泵为主要促进剂超家族抗生素外排泵。图中颜色代表耐药机制。B,汽泡大小表示AMR基因家族包含的基因在全部检出基因中的占比(%)。图4 51株KP耐药基因携带情况
2.5基于core-SNPs的菌株发育进化分析 有26株菌株与我国泸州、衡阳的分离株在一个进化分支上,亲缘关系十分密切,属于一个克隆体。与北京、成都、巴黎的分离株处于一个大进化节点上,属于一个克隆群。见图5。
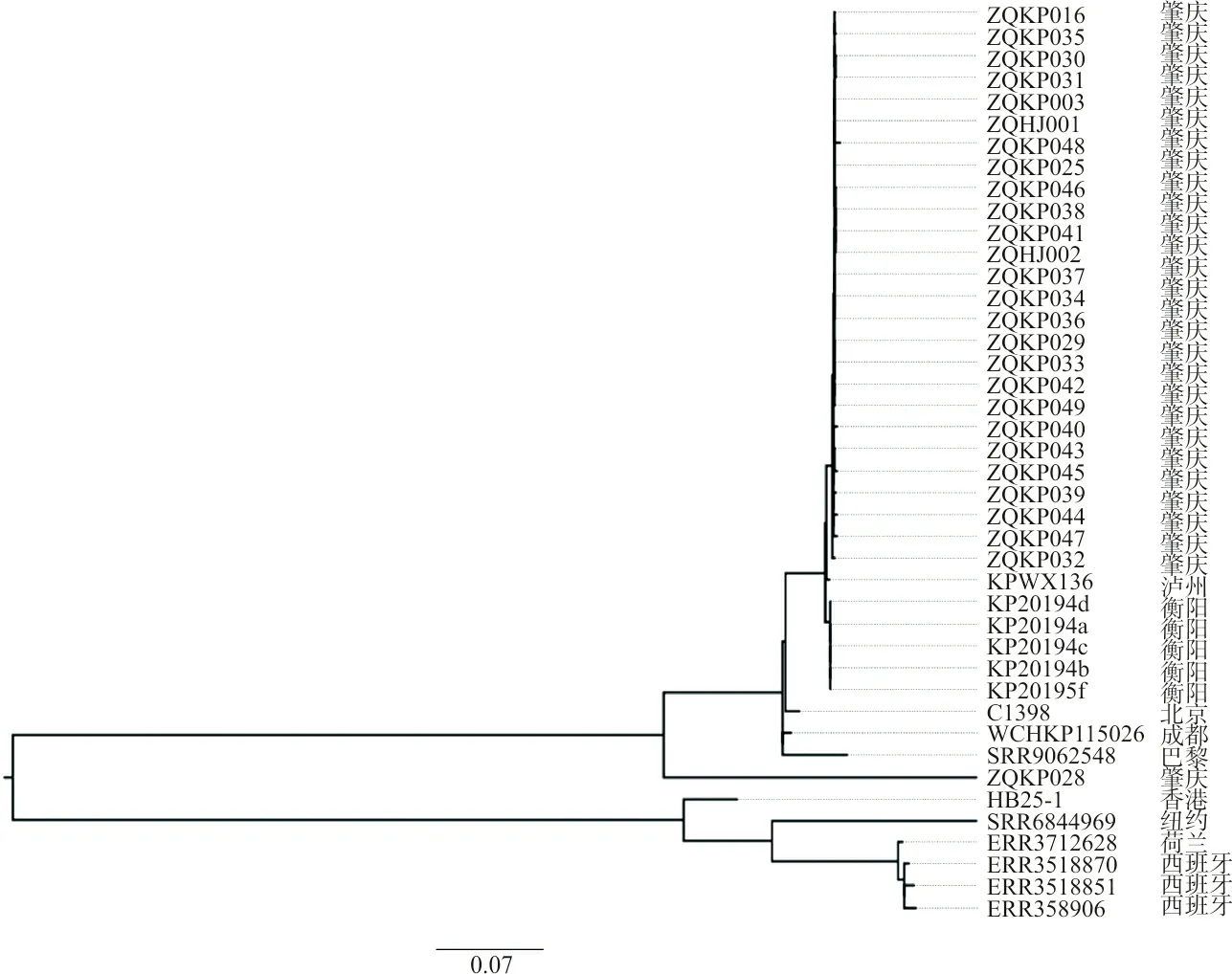
图5 O2aK64-ST11 CRKP与不同地区来源 O2aK64-ST11 CRKP的core-SNPs系统进化树
3 讨论
KP是常见的条件致病菌,该菌在机体免疫力低下或长期大量使用抗菌药物导致菌群失调时,容易引起机会性感染。出现的感染症状主要为肺炎、菌血症、泌尿系统和尿路发炎等[12]。在本研究中,通过收集感染KP的肺炎患者的临床资料可知,存在基础病和中老年人(>50岁)非常容易感染该菌。而从院内感染的患者人数和社区感染的患者人数对比表明,感染该菌的肺炎患者主要来自院内感染,这于我国其他地区的感染情况一致[13]。
通过Pathogenwatch分析,肺炎患者的KP菌株中IncF质粒家族的质粒携带率最高,而该质粒家族广泛存在于肠杆菌科中,主要携带超广谱β-内酰胺酶基因和碳青霉烯酶基因,这揭示了为何引起肺炎的KP耐药情况严重,且感染者抗菌药物治疗效果不佳的一个重要原因。同时,我们通过对IncFⅡ(pHN7A8)质粒进一步进行pMLST发现,该质粒为F33:A-:B-型,是我国FⅡ质粒流行传播的主要型别,可携带blaTEM-1(β-内酰胺类耐药基因)、emrE(红霉素耐药基因)、aadA2(氨基糖苷类耐药基因)、dfrA12(甲氧苄啶耐药性)等耐药基因[14]。IncR质粒主要存在于沙门菌中,能携带多种耐药基因且赋予宿主多个耐药表型[15]。该质粒的高携带性现象说明这些质粒在该院中已经出现跨菌种水平转移的现象,且IncR质粒已广泛存在KP中,并赋予菌株多个耐药表型。分子血清型和MLST显示,该院KP肺炎患者分离株已经出现了优势流行菌株,为O2aK64-ST11,而该型常见的耐药表型为耐碳青霉烯类抗菌药物。而药敏试验的结果也证明该院的优势流行菌株O2aK64-ST11全部为CRKP。
药敏试验的结果结合毒力、耐药基因分析发现,该院肺炎患者检出的KP耐药情况严重,所有菌株除对多黏菌素E敏感外,对其他抗菌药物存在不同程度的中介或耐药。在药敏试验中,我们发现4株KP对替加环素中介。替加环素是治疗CRKP的最后手段[16],若出现耐替加环素的菌株,这会使患者在进行临床治疗时陷入无药可用的窘境。而在这51株KP中存在优势耐药谱型,其耐药表型为CRKP,且拥有该耐药谱型的CRKP菌株彼此间分子血清型和ST高度一致,为O2aK64-ST11 CRKP。根据病例临床质料显示,在感染O2aK64-ST11 CRKP的患者来源分类上,院内感染的只比社区感染的多5例,这就提示O2aK64-ST11 CRKP菌株可能已经在院内和社区相互散播。进一步对所有菌株进行耐药基因分析发现,本研究的菌株耐药基因分属8种抗性机制,与菌株展示的耐药谱表型特征相符。值得注意的是,51株KP检出10种不同亚型的β-内酰胺酶基因家族的基因,其中又以blaCTX-M基因亚家族和blaSHV基因家族发现的子基因种类最多,该两种基因家族的基因主要在IncF质粒上,可水解第三代头孢菌素及单环β-内酰胺类,因此携带这两种基因的KP存在引起院内严重爆发感染的风险[17]。而在所有O2aK64-ST11 CRKP菌株中,检测到的碳青霉烯水解A类β-内酰胺酶基因均是blaKPC-2基因,这与我国其他地方CRKP的检测情况相符[18]。菌株毒力基因的携带情况表明,由于该院KP肺炎患者分离株全部缺乏调控高黏液型荚膜的rmpA基因和大肠菌素基因,因此优势流行型O2aK64-ST11 CRKP菌株的毒力较其他地区高毒力 ST11-K64型菌株弱[19]。除此之外,还发现2株菌株(ZQKP017、ZQKP020)携带ureB基因,该基因一种重要的定植因子主要存在于螺杆菌中[20]。携带该基因的KP定植能力是否会因为该基因的携带和表达而提升,这需要后续进一步研究。
基于core-SNPs的菌株发育进化树显示,27株本地的O2aK64-ST11 CRKP菌株与香港、纽约、荷兰和西班牙分离的菌株进化距离较远,不属于同一个克隆群。而在所有的27株菌株中,亲缘关系高度一致,其中26株菌株(包含24株患者分离株和2株外环境分离株)属于同一个克隆体,只有ZQKP028与其他26株不在同一进化分支上。根据MLST的最小生成树图显示,神经外科和ICU是该型菌株感染的高风险科室,2株外环境株分别是来自神经外科床垫和ICU护士工作台,提示该科室的外环境中已经存在该型菌株的污染。进一步分析发现该院26株O2aK64-ST11 CRKP与2019年3月至5月衡阳院感染事件分离的菌株和2021年2月泸州分离的菌株亲缘高度接近,只是前者分离的菌株毒力较弱,后2个地方的分离株均为高毒力型菌株,但都同属于1个基因克隆体,提示该克隆体菌株已在全国局部地区传播流行。从克隆群的菌株分离地点来看,侧面印证了越来越多的感染O2aK64-ST11 CRKP的病例有在更大的地理范围内成为优势流行株的趋势[21]。本研究中O2aK64-ST11 CRKP与泸州和衡阳分离株毒力的差别,揭示出该克隆体的菌株可能在传播过程中存在毒力缺失的现象,这个需要后期的持续研究来印证。
综上所述,本研究发现该院的KP肺炎患者分离株中存在1种优势流行的强耐药克隆体菌株(O2aK64-ST11 CRKP),且该型菌株已经出现了在院内爆发和社区相互散播的趋势。该O2aK64-ST11 CRKP菌株虽然毒力较弱,但其广泛的抗菌药物抵抗能力让患者感染该型菌株后临床治疗变得非常困难。基于WGS的core-SNPs发育进化树分析提示了该型菌株目前在全国局部地区已传播流行,并有在更大的地理范围内成为优势流行株的趋势。
