国产MALDI-TOF MS系统Smart MS 5020对临床微生物的鉴定性能评估*
2022-10-15金丽黄永禄李佳萍蒋陈晨周宏伟张嵘胡燕燕临海市第一人民医院检验科浙江台州17000浙江大学医学院附属第二医院检验科杭州10009浙江大学医学院附属口腔医院检验科杭州10006
金丽,黄永禄,李佳萍,蒋陈晨,周宏伟,张嵘,胡燕燕(1. 临海市第一人民医院检验科,浙江台州 17000;. 浙江大学医学院附属第二医院检验科,杭州 10009;. 浙江大学医学院附属口腔医院检验科,杭州 10006)
基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF MS)通过检测待检病原菌株蛋白质以获取其质谱峰结果,同时对比庞大的菌株数据库内标准菌株的蛋白质谱峰从而实现对不同菌株的鉴定[1]。MALDI-TOF MS技术给微生物检验带来最大的变革是细菌的鉴定能力大大提高,使得微生物检验跨入一个飞速发展的新时代。大量文献报道,MS技术对临床细菌的鉴定准确率可达95%以上[2-3]。目前国内外市场上商品化的微生物鉴定MS仪主要是德国布鲁克公司的Biotyper MS和法国生物梅里埃公司的Vitek MS。近年来国产MS仪的发展也非常迅速,质谱市场上新兴的国产MS仪主要包括Clin-TOF MS(北京毅新博创生物有限公司)、M-Discover 100(珠海美华科技有限公司)以及Autof ms1000(安图生物公司)、microTyper MS(江苏天瑞仪器股份有限公司)、ATSA MicroIDSys(上海复星长征医学科学有限公司)等。Smart MS 5020型MALDI-TOF MS是珠海迪尔生物工程有限公司于2021年上市的国产质谱系统,目前在国内还缺乏全面的临床微生物鉴定性能评估。本研究对其在临床细菌真菌方面的鉴定效能进行评估,以期为今后临床使用提供一定的指导。
1 材料与方法
1.1材料
1.1.1菌株来源 共纳入2016—2020年浙江大学医学院附属第二医院留存的临床分离菌株913株,包括革兰阴性菌、革兰阳性菌以及酵母样真菌,覆盖18个属,48个种或复合群,包含临床上难区分的链球菌、嗜血杆菌以及常见的复合群等。其中,包括革兰阴性菌20种456株,革兰阳性菌26种387株,以及酵母菌6种70株。并选取浙江大学医学院附属第二医院保存的13株室内质控菌株用于重复性评估,包括革兰阴性菌5株,革兰阳性菌6株以及酵母菌2株。
1.1.2试剂与仪器 Biotyper MS型MALDI-TOF质谱仪及搭载的DB2969数据库及其配套试剂(德国布鲁克公司),Smart MS 5020型MALDI-TOF 质谱仪及搭载的临床微生物菌种鉴定数据库(2 630种)及其配套试剂(珠海迪尔公司),基因组提取试剂盒(美国Axygen公司),PCR配套相关试剂(上海生工生物公司和日本TaKaRa公司),ABI 3730型DNA自动测序仪(美国ABI公司),Illumina HiSeqX10测序平台(美国Illumina公司)。
1.2方法
1.2.1复苏培养 所有保存菌株复苏后,根据菌种要求分别转种哥伦比亚血琼脂培养基(郑州安图生物公司)、巧克力培养基(郑州安图生物公司)或沙氏培养基(郑州安图生物公司),35 ℃温育18~24 h,生长缓慢细菌需适当延长培养时间。
1.2.2实验设计 2种质谱系统的准确性评估方法采用直接涂抹法平行使用2套质谱系统对研究菌株进行菌种鉴定。取少量纯培养菌直接涂抹于靶板,滴加1 μL基质液(即α-氰基-4-羟基肉桂酸,CHCA);酵母菌先滴加1 μL 70%甲酸溶液,干燥后再加1 μL基质液。自然干燥后上机采集图谱并鉴定分析。13株室内质控菌株在Smart MS 5020系统进行重复性测试,每株菌平行检测3次。
1.2.3结果判定 根据产品使用说明。Biotyper MS系统鉴定分值≥2.000为鉴定至种水平可信;分值在1.700~1.999之间为鉴定属水平可信;分值<1.700无鉴定结果。Smart MS 5020系统鉴定分值≥2.00为鉴定种水平结果可信;分值在1.70~1.99之间为鉴定属水平结果可信;分值<1.700为鉴定结果不可信。
当某一种或2种MS系统鉴定失败或2种质谱鉴定结果不一致时,进行16S rRNA基因测序进行确认,反应条件及体系参考文献[4]进行。基因提取按照基因组提取试剂盒说明书进行,PCR扩增产物行琼脂糖凝胶电泳,成像仪分析,并将阳性扩增产物送生工生物工程(上海)公司进行Sanger测序,测序结果与基因文库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,确定菌种类型。
针对复合群,本次评估包括鲍曼不动杆菌复合群、阴沟肠杆菌复合群以及肺炎克雷伯菌复合群,采用二代测序方法确认鉴定结果。基因提取按照基因组提取试剂盒说明书进行,将提取的基因组DNA送至北京诺禾致源科技股份有限公司,采用Illumina HiseqX10测序平台通过双末端150 bp测序读长策略进行高通量测序,原始序列用SPAdes v3.12.0软件进行基因组组装[5]。拼接好的基因组序列与基因文库(https://pubmlst.org/software/bigsdb)比对,确定菌种类型。以此作为复合群鉴定结果的金标准。
1.3术语定义
1.3.1准确鉴定 Smart MS 5020系统鉴定分值≥2.00,系统鉴定结果可信,并与参考方法鉴定结果种水平一致。针对某些菌复合群内各种蛋白质指纹图谱极相似,因此种鉴定正确和复合群鉴定正确均认定为“准确鉴定”。本研究涉及的菌复合群:(1)鲍曼不动杆菌复合群[6]:鲍曼不动杆菌(A.baumannii)、醋酸钙不动杆菌(A.calcoaceticus)、医院不动杆菌(A.nosocomialis)、赛氏不动杆菌(A.seifertii)以及皮氏不动杆菌(A.pittii);(2)阴沟肠杆菌复合群[7]:阴沟肠杆菌(E.cloacae)、阿氏肠杆菌(E.asburiae)、霍氏肠杆菌(E.hormaechei)、神户肠杆菌(E.kobei)、路氏肠杆菌(E.ludwigii)、超压肠杆菌(E.nimipressuralis)以及桑肠杆菌(E.mori);(3)肺炎克雷伯菌复合群[8]:肺炎克雷伯菌(K.pneumoniae)、变栖克雷伯菌(K.variicola)、类肺炎克雷伯菌(K.quasipneumoniae)、密歇根克雷伯菌(K.michiganensis)等。
1.3.2鉴定至属水平 Smart MS 5020系统鉴定分值为1.70~1.99,或提供菌属名称,并且结果与参考方法属水平一致。
1.3.3鉴定失败 Smart MS 5020系统鉴定分值<1.700,为不可信结果,认为鉴定失败。
1.3.4鉴定错误 系统认为鉴定结果可信,但与参考方法鉴定结果不一致。
1.4统计学分析 采用SPSS 22.0软件进行统计分析。组间比较均采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.12种系统的鉴定准确率比对 经16S rRNA和二代测序方法鉴定,913株临床菌株具体分类见表1。Biotyper MS系统种水平鉴定准确率为100%(913/913,95%CI:99.48%~99.58%),Smart MS 5020系统种水平鉴定准确率为99.78%(911/913,95%CI:99.12%~99.20%),2株表皮葡萄球菌鉴定为柯氏葡萄球菌。在临床微生物的鉴定能力方面,2种方法差异无统计学意义(χ2=0.501,P=0.479)。
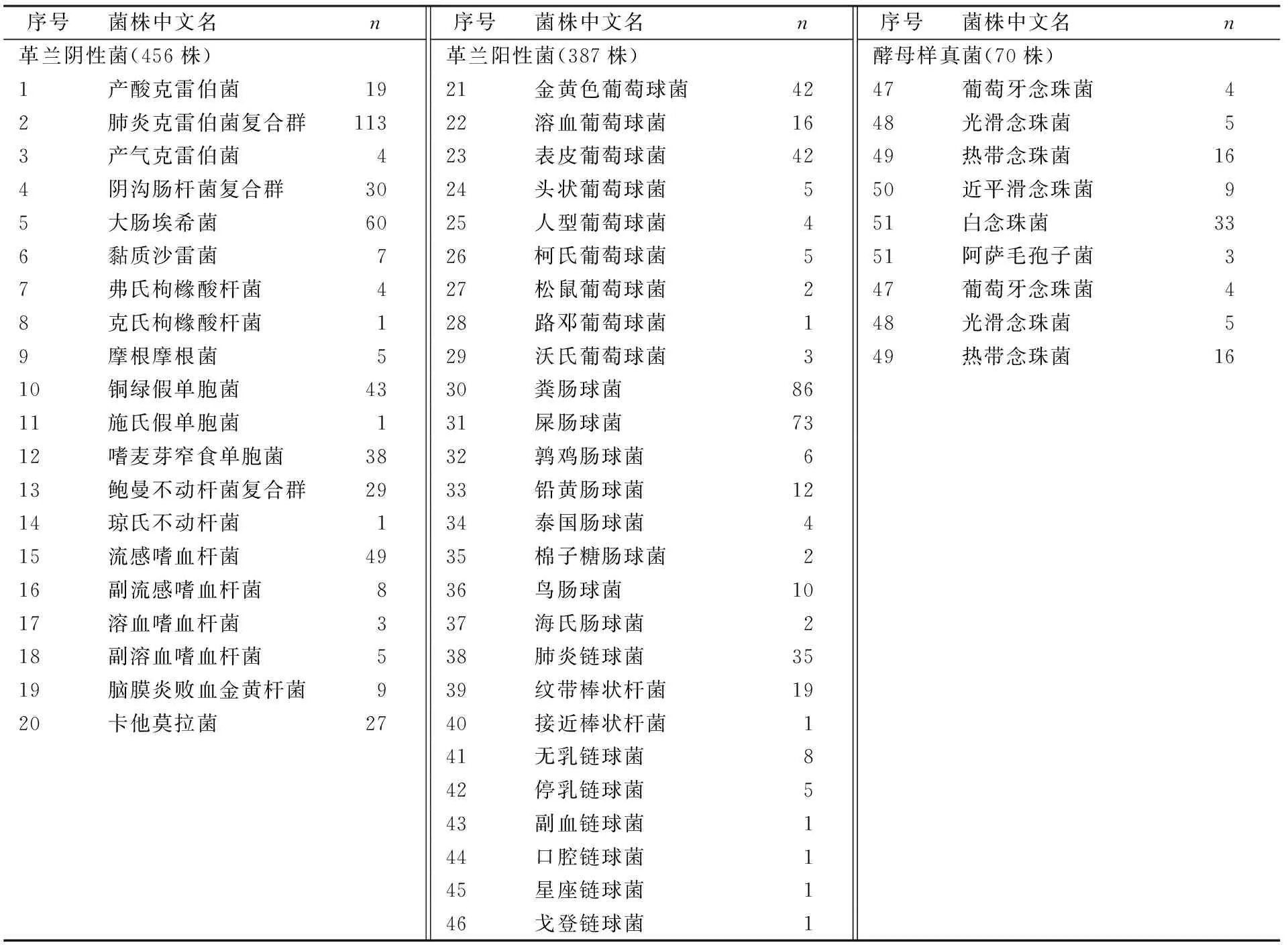
表1 菌株信息
2.1.1革兰阴性菌 Smart MS 5020系统对12个属20种细菌共456 株革兰阴性菌的鉴定准确率均达到100%(456/456,95%CI:98.96%~99.16%),其中鲍曼不动杆菌复合群(29株),阴沟肠杆菌复合群(30株)和肺炎克雷伯菌复合群(113株)在本次评价中均鉴定到种或复合群水平。
2.1.2革兰阳性菌 Smart MS 502系统对4个属26种共387 株革兰阳性菌的鉴定准确率达到99.4%(385/387,95%CI:97.93%~98.13%),其中2株表皮葡萄球菌鉴定错误,鉴定为柯氏葡萄球菌。
2.1.3酵母样真菌 Smart MS 5020系统对临床常见70株酵母样真菌的种水平鉴定准确率均为100%(70/70,95%CI:93.52%~94.8%)。
2.1.4复合群 2种质谱系统对鲍曼不动杆菌复合群的19株鲍曼不动杆菌和10株皮氏不动杆菌均能准确鉴定到种。质谱对阴沟肠杆菌复合群中具体菌种的鉴定能力存在一定缺陷,虽然2种质谱系统的数据库中均包含5种常见的阴沟肠杆菌复合群具体种(阿氏肠杆菌、阴沟肠杆菌、霍氏肠杆菌、神户肠杆菌和路氏肠杆菌),此次纳入鉴定的共30株阴沟肠杆菌复合群(5株阿氏肠杆菌、8株阴沟肠杆菌、10株霍氏肠杆菌、6株神户肠杆菌和1株路氏肠杆菌),Smart MS 5020仅7株准确鉴定到种,Biotyper MS系统10株能准确鉴定到种。113株肺炎克雷伯菌及其亚种包含109株肺炎克雷伯菌、4株类克雷伯菌及1株密歇根克雷伯氏菌,均鉴定为肺炎克雷伯菌(表2),这是由于两者质谱数据库存在缺失(仅包含有肺炎克雷伯菌和变栖克雷伯菌)以及种内亲缘性太近导致。
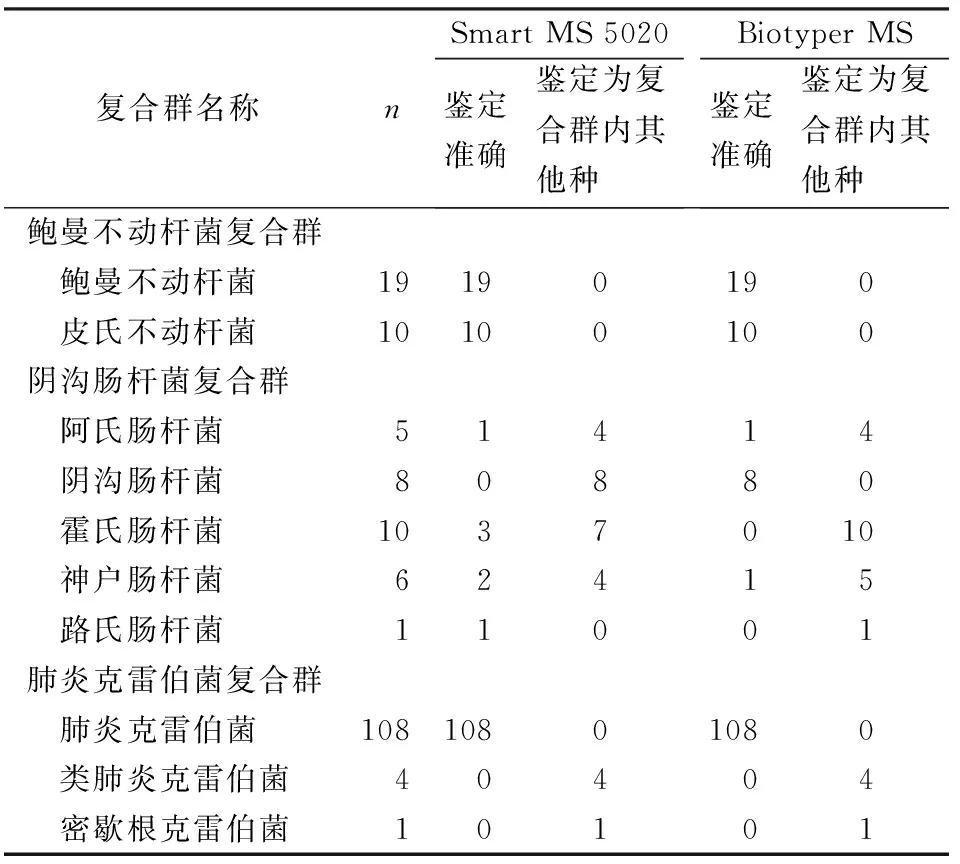
表2 2种质谱系统对复合群鉴定结果比较
2.2重复性评估 选取ATCC25922(大肠埃希菌)、ATCC700603(肺炎克雷伯菌)、ATCC 27853(铜绿假单胞菌)、ATCC25923(金黄色葡萄球菌)、ATCC29213(金黄色葡萄球菌)、ATCC29212(粪肠球菌)、ATCC700327(铅黄肠球菌)、ATCC49619 (肺炎链球菌)、ATCC19615(化脓链球菌)、ATCC19424(脑膜炎奈瑟菌)、ATCC49247(流感嗜血杆菌)、ATCC14053(白色念珠菌)和ATCC60032(光滑念珠菌)共13 株室内质控菌株和临床分离菌株进行重复性测试,每株菌经3次平行试验后,鉴定结果100%符合。
3 讨论
随着近几年国产质谱的崛起,对于国产质谱的性能评估也多有报道[9-12]。Smart MS 5020型质谱搭载2 630种数据库,是珠海迪尔公司在2021年注册上市的质谱系统,目前暂无该质谱对临床菌株的鉴定效能评估。本实验结果显示其鉴定准确率可达99.78%(911/913),性能相当优异。仅2株表皮葡萄球菌被错误鉴定为柯氏葡萄球菌,可能是由于挑取细菌量、涂板厚薄差异等,导致细菌蛋白质峰出现微弱变化而被错误鉴定。文献显示质谱鉴定嗜血杆菌属时容易发生混淆,如Vitek MS将42%(21/50)的溶血嗜血杆菌鉴定为流感嗜血杆菌[13];布鲁克Biotyper MS DB2371数据库对流感嗜血杆菌的鉴定错误率为13.1%(47/358),通过将更多参考菌株纳入Biotyper数据库中,可将鉴定准确率提高至100%[14]。Smart MS 5020系统对此次纳入鉴定的65株嗜血杆菌均能准确鉴定到种。国产质谱系统数据库的构建起步较晚,在数据库方面还需进一步完善。但随着技术的不断改进,相信其数据库不断扩增将带来更优异的鉴定性能。
对于临床常见的复合群,有不少文献评估了质谱对复合群内具体种的区分能力。鲍曼不动杆菌复合群各菌种因表型相似,生化试验无法区分,但目前有研究发现,鲍曼不动杆菌复合群不同菌种对抗菌药物的耐药性存在差异[15],且预后也有所差别,因此若能将该复合群准确鉴定至种对临床用药有一定的指导意义。有报道评估了Vitek MS和Biotyper MS对144株鲍曼不动杆菌复合群的区分能力,两者分别准确识别129株(89.6%)和143株(99.3%),显示对鲍曼不动杆菌复合群具体种的区分能力较高,但文献也提出需要扩大其数据库以达到更好的区分能力[16]。本研究共纳入29株鲍曼不动杆菌复合群,包括19株鲍曼不动杆菌和10株皮氏不动杆菌,Smart MS 5020系统均准确鉴定到种,但由于未包含复合群中其他种,因此对群内其他种的鉴定能力还有待评估。阴沟肠杆菌复合群可导致多种感染,常存在于环境以及人和动物的共生肠道菌群中,是重要的条件致病菌之一[17]。阴沟肠杆菌复合群的分类也在不断变化,以hsp60基因测序作为区分复合群内具体种的参考方法[18]。阴沟肠杆菌复合群内种类多,亲缘关系近,Biotyper MS自带商业化数据库对阴沟肠杆菌内具体种鉴定准确率仅为25%[19],与本实验Biotyper MS鉴定准确率[33.3%(10/30)]相当,Smart MS 5020系统鉴定准确率也仅为23.3%(7/30)。目前采用质谱方法区分阴沟肠杆菌复合群还需进一步补充数据库及更精密的算法。肺炎克雷伯菌复合群是近几年提出的概念,肺炎克雷伯菌是全球与抗生素耐药性相关最严重的的病原体之一,其在系统发育上与变栖克雷伯菌(K.variicola)、类肺炎克雷伯菌(K.quasipneumoniae)、密歇根克雷伯菌(K.michiganensis)密切相关,并与其他几类未命名亚型共同构成了肺炎克雷伯菌复合群[20]。目前,关于肺炎克雷伯菌复合群具体种的临床意义还没有精确定义,现有商业化质谱数据库中仅包含肺炎克雷伯菌复合群中少量菌种,如Biotyper MS包含肺炎克雷伯菌和变栖克雷伯菌,Vitek MS仅包含肺炎克雷伯菌,因此采用商业化数据库对肺炎克雷伯菌复合群进行具体种区分存在困难。文献报道可采用特征峰方法[21],如类肺炎克雷伯菌在m/z为4 136和8 271处存在特征峰,变栖克雷伯菌在m/z为7 768处存在特征峰,通过该方法区分肺炎克雷伯菌复合群具体种的敏感性和特异性范围为80%~100%和97%~100%。另外,文献报道黏液性肺炎克雷伯菌和黏液性铜绿假单胞菌难以用MALDI-TOF MS方法鉴定[22],而本文中肺炎克雷伯菌和铜绿假单胞菌均被准确鉴定,可能与本研究中黏液性菌株纳入较少,以及质谱数据库更新有关。由于数据库存在缺失和种内亲缘关系近,Smart MS 5020将类肺炎克雷伯菌和密歇根克雷伯菌鉴定为肺炎克雷伯菌。对于这类复合群,需要进一步更新数据库。
Smart MS 5020在种水平鉴定准确率高,对临床常见及易混淆菌种均可快速给出可靠的鉴定结果,但对复合群具体种数据库还存在缺陷,需要进一步扩充数据库以期获得更好鉴定性能。
