猫传染性腹膜炎病毒荧光定量RT-PCR 检测方法的建立
2022-10-14韩佃刚杨云庆叶玲玲周思佳信吉阁
杨 妮,韩佃刚,杨云庆,叶玲玲,李 静,周思佳,宿 放,艾 军,信吉阁
(1.云南农业大学动物医学院,云南昆明 650201;2.昆明海关技术中心,云南昆明 650200)
猫传染性腹膜炎(feline infectious peritonitis,FIP)是一种由猫传染性腹膜炎病毒(feline infectious peritonitis virus,FIPV)感染引起的病毒性传染病,主要临床症状表现为腹膜炎、腹腔积液及各类脏器肿大[1],是影响养猫业发展的重要疾病之一。FIPV 属于冠状病毒科冠状病毒属,为不分节段的RNA 病毒,基因组全长29.2 kb,其病毒蛋白包括4种结构蛋白[棘突蛋白(S)、包膜蛋白(E)、膜蛋白(M)、核衣壳蛋白(N)],5 种辅助蛋白(3a、3b、3c、7a、7b)及2 种非结构蛋白(1a 和1b)[2]。其中,编码M 蛋白和N 蛋白的基因相对保守,适合作为FIPV 检测的分子靶标[3]。
FIP 常用的诊断方法有临床诊断和实验室诊断。临床诊断取决于诊断者经验及患病猫的临床表现,患病猫初期临床症状不明显,病程进展有较大差异,常因误诊而贻误治疗,最终导致病猫死亡。实验室诊断包括病理学检查、血清学检测和病原学检测等[4]。病理学检测耗时较长,制作复杂;血清学检测适合于渗出型FIP,对于非渗出型FIP 存在一定的局限性;常规RT-PCR 检测灵敏度低,容易出现假阴性,荧光定量RT-PCR 方法与常规RT-PCR 检测方法相比,具有准确性好、灵敏度高和特异性强等优点[5-6]。本研究以FIPVN基因为靶序列,设计合成特异性引物及TaqMan 探针,建立了一种FIPV 实时荧光定量RT-PCR 检测方法,并对该方法的特异性、灵敏度和重复性进行了试验,以期为提高FIPV 检测效率和FIPV 精准防控提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 病毒 狂犬病毒(RV)、猫疱疹病毒(FHV)、猫杯状病毒(FCV)、猫细小病毒(FPV)、犬流感病毒(CIV)、犬瘟热病毒(CDV),由昆明海关技术中心动检实验室提供。
1.1.2 主要试剂和仪器 病毒RNA/DNA 提取试剂盒,购自宝日医生物技术有限公司;One step qRT-PCR Probe Kit,购自南京诺唯赞生物科技股份有限公司;StepOne Plus Real-Time PCR System,购自ABI 公司;PUC57-FIPV-N重组质粒,由昆明擎科生物科技有限公司合成;5430R 高速台式离心机,购自德国Eppendorf 公司;-80 ℃冰箱,购自日本SANYO 公司。
1.1.3 引物和探针设计 下载GenBank 公布的FIPVN基因序列,利用DNAMAN 生物学信息软件分析其保守区域,用Primer 5 软件设计特异性引物和TaqMan 探针(表1),送至昆明擎科生物科技有限公司合成。
1.2 方法
1.2.1 病毒核酸提取 按照RNA/DNA 提取试剂盒操作说明书分别提取FIPV、RV、FCV、CIV、CDV 的RNA 和FHV、FPV 的DNA,置于-20 ℃保存备用。
1.2.2 反应体系优化及扩增条件 以阳性重组质粒为模板,最低检测Ct 值为标准,优化荧光定量RT-PCR 反应条件。反应体系20.0 μL:上下游引物各0.4 μL,TaqMan 探针0.2 μL,2×RT-PCR Buffer 10.0 μL、25×RT-PCR Enzyme Mix 1.0 μL、50×Rox 0.4 μL、模板1.0 μL,用ddH2O 补充总体积至20.0 μL。参照酶的说明书设置引物浓度为10 pmol/μL,调整探针浓度分别为2、5、10 μmol/L。扩增条件:55 ℃ 15 min;95 ℃ 30 s;95 ℃ 10 s,60 ℃ 30 s(此步骤收集荧光信号),45 个循环。
1.2.3 特异性试验 采用建立的荧光定量RT-PCR 检测方法,分别对FIPV、RV、FCV、CIV、CDV、FHV、FPV 核酸进行检测,评价方法的特异性。
1.2.4 标准曲线建立和灵敏度试验 使用微量核酸蛋白分析仪测定标准阳性重组质粒浓度,根据公式计算拷贝数(拷贝数=6.02×1023×DNA浓度/质量MW,MW=DNA 碱基数×330),得到拷贝数浓度为3.4×1011copies/μL。对阳性重组质粒进行10 倍梯度稀释,使浓度范围为3.4×108~3.4×101copies/μL。采用建立的荧光定量RT-PCR 检测方法,对上述系列稀释样品进行测定,绘制标准曲线并评价方法的灵敏度。
1.2.5 重复性试验 选取拷贝数浓度为3.4×108、3.4×106、3.4×104、3.4×102copies/μL的阳性质粒,采用同批次配制的荧光定量RT-PCR反应体系进行检测,每个模板设置3 个重复,计算批内变异系数;采用不同批次配制的荧光定量RT-PCR 反应体系进行检测,每个模板设置3 个重复,计算批间变异系数,评价方法的稳定性。变异系数计算公式为CV=(标准偏差SD/平均值Mean)×100%。
2 结果与分析
2.1 反应体系优化
结果(图1)显示,最终确定探针浓度为10 μmol/L。优化后的反应体系:2×RT-PCR Buffer 10.0 μL,25×RT-PCR Enzyme Mix 1.0 μL,上 下游引物(10 pmol/μL)各0.4 μL,TaqMan 探针0.2 μL,50×Rox 0.4 μL,模板1.0 μL,用ddH2O补充总体积至20.0 μL。
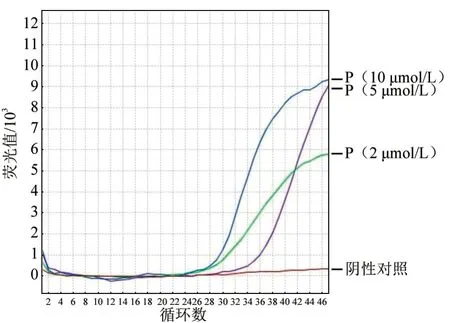
图1 探针浓度优化结果
2.2 特异性试验 利用建立的荧光定量PCR 检测方法分别对FIPV、RV、FCV、CIV、CDV、FPV、FHV 核酸进行检测。结果(图2)显示,该方法仅对FIPV 有特异性扩增,而对上述其他病毒均无扩增,表明该方法具有较强的特异性。

图2 特异性试验结果
2.3 标准曲线建立和灵敏度试验 采用荧光定量RT-PCR 方法检测系列稀释的阳性重组质粒,以标准品拷贝数的对数值为横坐标,以测得的Ct 值为纵坐标,绘制标准曲线。得到标准曲线方程为y=38.445 0 -3.308 3x,可信度(R2)为0.998 9,扩增效率(E)为100.5%(图3)。对阳性重组质粒进行10 倍梯度稀释,评价方法的灵敏度,结果(图4)显示,当阳性质粒拷贝数浓度为3.4 copies/μL 时,仍可见明显扩增曲线,表明本检测方法对FIPV 的检测灵敏度为3.4 copies/μL。

图3 标准曲线
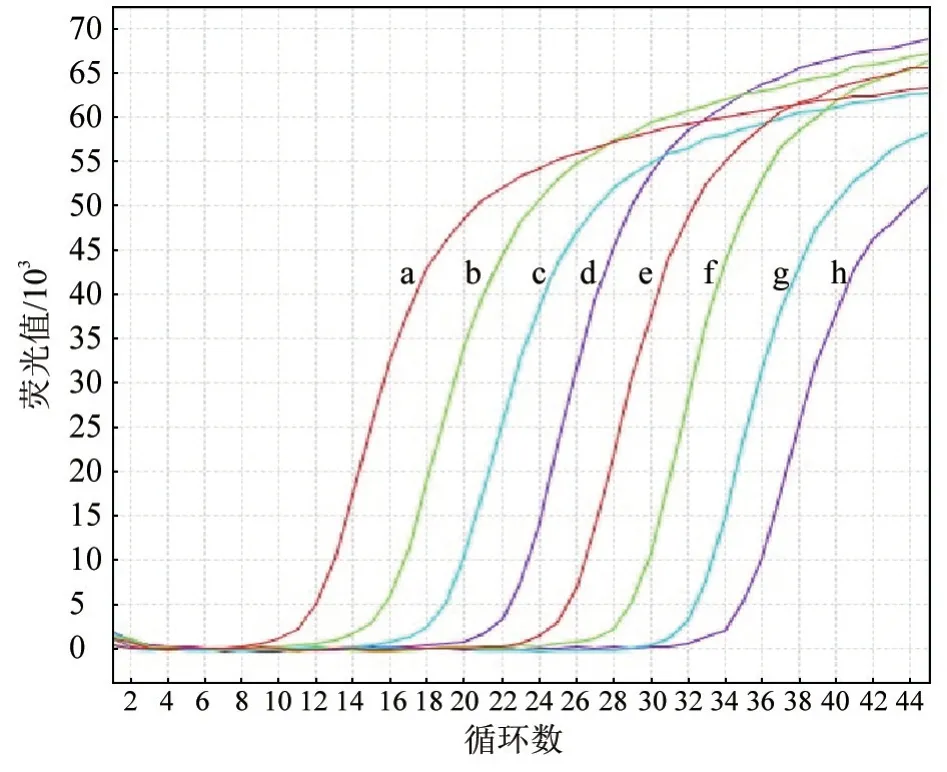
图4 灵敏度试验结果
2.4 重复性试验 选取3.4×108、3.4×106、3.4×104、3.4×102copies/μL 的阳性质粒模板,用本试验建立的荧光定量RT-PCR 方法进行批内、批间重复性测试。结果(表2)显示,该方法的批内变异系数为0.99%~4.13%,批间变异系数为1.29%~4.64%,表明该方法重复性较好。

表2 重复性试验结果
3 讨论
FIPV 于1963 年被首次报道,目前其检测方法仍在不断发展中,特别是在猫没有出现体腔积液的情况下[7]。FIP 常用的诊断方法包括病理学检测、血清学检测、免疫组织学检测和RT-PCR 检测等[8]。RT-PCR 方法是扩增和检测核酸的技术,但其灵敏度低,当腹腔积液中FIPV 含量较少时,容易造成漏检,导致假阴性结果。实时荧光定量RT-PCR 技术具有高效、快速、定量检测病原核酸等优势[9],已广泛应用于多种病原的检测工作。荧光定量RT-PCR 分为染料法和探针法,荧光染料如SYBR Green I 能直接与DNA 双链结合,结合后产生的荧光信号可被仪器监测,荧光强度与DNA 含量成正比,但由于荧光染料能够结合反应体系里所有的dsDNA 双螺旋小沟区域,因此特异性不如探针法强,且对引物的特异性要求很高[10]。探针法是在上下游引物之间插入一条荧光标记探针,荧光探针与目的模板特异性结合,可大幅提高检测特异性和灵敏度。
目前已有相关学者建立了FIPV 荧光定量RT-PCR 检测方法。如:王元红等[11]针对FIPVN基因设计1 对特异性引物,通过条件优化,建立了一种FIPV 的SYBR Green I 实时荧光定量RT-PCR方法,其最低检出量为102copies/μL,灵敏度低于本研究建立的探针法;Dunbar 等[12]建立了一种从肠系膜淋巴结、细针抽吸物中检测非渗出性FIPV的荧光定量RT-PCR 检测方法,敏感性为90.0%,特异性为96.1%,使非渗出性FIPV 检测成为可能;Fish 等[3]用双标记寡核苷酸TaqMan 探针荧光定量RT-PCR 方法对205 只猫样本进行检测,结果发现了1 例阳性病例;Doenges 等[5]评估了荧光定量RT-PCR 方法检测猫外周血单个核细胞、血清和无细胞体腔积液的灵敏性和特异性,结果显示该方法特异性为100%。
本研究建立的TaqMan 荧光定量PCR 方法灵敏度高,最低检测限为3.4 copies/μL;特异性强,与RV、FHV、FCV、FPV、CIV、CDV等均无交叉反应;重复性好,批内变异系数为0.99%~4.13%,批间变异系数为1.29%~4.64%,可成为FIPV 快速有效的检测手段。
