浙江省猪群塞内卡病毒感染流行病学调查
2022-10-14张红丽王雅婷董建斐赵灵燕
张红丽,王雅婷,黄 靖,张 璐,董建斐,赵灵燕,徐 辉
(浙江省动物疫病预防控制中心,浙江杭州 311199)
塞内卡病毒(Senecavirus A,SVA)为小RNA病毒科(Picornavirdae)塞内卡病毒属(Senecavirus)唯一成员,最早由美国遗传治疗公司科研人员在人胚胎视网膜细胞系的污染物中被发现,并分离出SVV-001 原型毒株[1]。早期研究[2-3]发现,SVA 对人和动物没有明显致病性;但因其具有溶瘤特性,被用于不同类型肿瘤的治疗。2007 年,加拿大首次报道了猪群感染SVA[4]。随后,美国(2012 年)[5]、巴西(2014 年)[6]等国家相继暴发猪群SVA 感染疫情,引起原发性猪水疱病和严重的新生仔猪发病死亡,给养猪业造成了较大经济损失[7-8]。随后,中国(2015 年)[9]、泰国(2016 年)[10]、越南(2018年)[11]皆有猪SVA 感染的报道。
张志等[12]对我国辽宁、福建等7 个省份进行猪SVA 感染回顾性监测发现,我国SVA 流行可追溯到2016 年,2018 年湖南、云南、新疆、辽宁、福建、湖北、广西等7 个省(自治区)猪群中均有不同程度的SVA 污染。高春柳等[13]2019 年对华东、华中、华北、西北、东北6 个地区16 个省(自治区、直辖市)屠宰场临床健康猪群与养殖场非健康猪群的组织及血清样品分别进行了SVA 病原学和血清学检测,发现SVA 感染强度虽有所下降,但流行范围仍然较广,且存在隐性感染。吉林[14]、海南[15]等省份也在养殖场、屠宰场中检出SVA 阳性样品。上述研究提示,我国猪群SVA 感染较为广泛。为了解SVA 在浙江省猪群中的感染程度和分布规律,2017—2020 年对全省养殖场、屠宰场、无害化处理场开展了持续性流行病学调查和监测,以期为SVA 感染防控提供参考。
1 材料与方法
1.1 样品采集
1.1.1 血清样品 2018—2020年,每年5月、10月,采集全省部分猪养殖场、屠宰场血清样品共5 145份,其中养殖场覆盖全省东、西、南、北、中5 个区域,根据每年区域内养殖量适时调整。采用分层随机抽样策略,按估计流行率方式抽样。场群层面,按照年度养殖场数量,确定需抽样的养殖场群数量;个体层面,在每个场群,按存栏量确定需抽样的个体数量。按N/n=1.962×p(1-p)/d2计算抽样场群数或个体数。式中:N为场群数,n为个体抽样数,p为预期流行率(设为15%),d为可接受误差(设为15%)。区域内,按照确定的养殖场数量,随机选择,屠宰场全部抽样。场点内,根据计算得出的理论采样数量随机选择。2018 年采集83 个养殖场群、17 个屠宰场群的2 402 份猪血清样品;2019年采自51 个养殖场群、13 个屠宰场群的1 627 份猪血清;2020 年采集60 个养殖场群、19 个屠宰场群的2 486 份猪血清。具体见表1。

表1 不同年份SVA 抗体检测场点分布及样品数量统计
1.1.2 组织样本 根据国家和浙江省定点监测方案要求,结合全省养殖场、屠宰场、无害处理场分布特点,在全省11 个地市,共采集屠宰场屠宰猪群淋巴结混样1 215 份,养殖场及无害化处理场病死猪病料混样1 158 份(表2)。其中,2019 年对7 个屠宰场群,2020 年对15 个养殖场群同步采集了血清与淋巴结样品。

表2 SVA 核酸检测场点分布及样品采集数量统计
1.2 主要试剂
组织样品磁珠法RNA/DNA提取试剂(LabServ Viral Total NA Kit),购自赛默飞世尔科技有限公司;SVA 间接ELISA 抗体检测试剂盒、SVA-FMDV 双重荧光定量RT-PCR 检测试剂盒,购自兰州兽研生物科技有限公司。
1.3 组织样品处理
淋巴结样品采取混样方式检测,同一场群的3~4 份淋巴结混成1 份,同一头猪的脏器样品混成1 份。取适量组织样品,用手术剪剪碎,放入带有研磨珠的研磨管中,加入1 mL PBS,于研磨器上研磨,待匀浆后置于-40 ℃或-80 ℃反复冻融3 次,8 000 r/min 离心2 min 后,取上清,按照磁珠法病毒RNA/DNA 提取试剂盒说明书进行核酸提取。
1.4 主要仪器设备
酶标仪,Multiskan FC,赛默飞世尔科技公司产品;磁珠法核酸提取仪,KingFisher Flex,赛默飞世尔科技公司产品;荧光定量PCR 仪,型号7500,赛默飞世尔科技公司产品。
1.5 样品检测
按照SVA 间接ELISA 抗体检测试剂盒说明书检测血清样品抗体,荧光定量RT-PCR 试剂盒说明书检测组织样品核酸。
1.6 统计学分析
所有数据均采用SPSS 22.0 软件进行卡方处理分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 血清样品检测
2.1.1 时间分布 不同年份统计结果显示(表3),2018—2020 年SVA 抗体个体阳性率分别为21.86%、9.83%、12.79%,场群抗体阳性率分别为83.00%、56.06%、70.89%。经统计分析,场群及个体抗体阳性率波动变化明显(P<0.01),2019年显著下降后,2020 年又有明显提高。
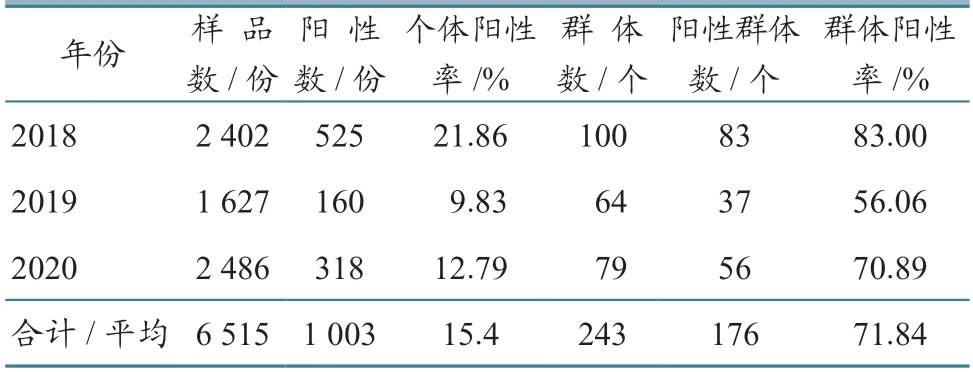
表3 2018—2020 年血清样品SVA 抗体检测结果时间分布
2.1.2 场点分布 不同场点统计结果(表4)显示,屠宰场连续3 年SVA 抗体个体阳性率均高于养殖场,群体抗体阳性率除2018 年外也高于养殖场。屠宰场群与养殖场群阳性率统计对比结果(表4)显示,屠宰场群与养殖场群的个体阳性率差异极显著(P<0.01),而群体阳性率无统计学差异。阳性屠宰场群来源统计结果(表5)显示,2018 年71.43% 的阳性群体来源于省外,显著高于省内(P<0.01),2019—2020 年省内来源阳性场群占比升高,显著高于省外(P<0.01)。
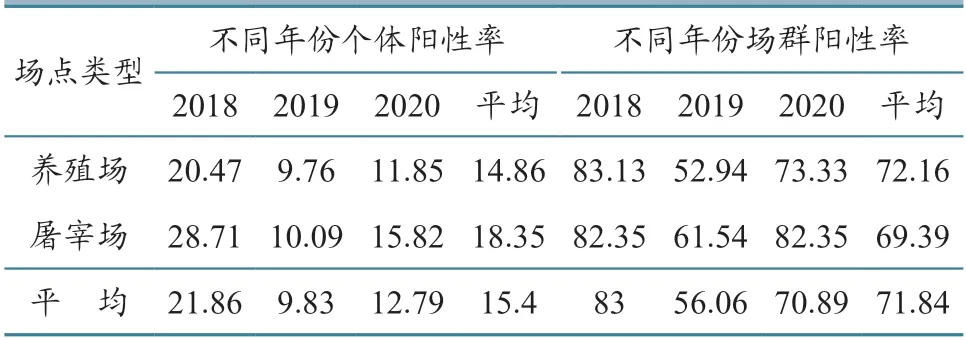
表4 2018—2020 年不同场点SVA 抗体分布 单位:%

表5 2018—2020 年屠宰场SVA 抗体阳性群体来源分布
2.1.3 区域分布 不同区域统计结果(表6)显示,2018—2020 年,全省不同区域的SVA抗体个体阳性率分别为11.08%~27.51%、3.42%~13.89%、8.09%~16.07%,群体阳性率分别为70.37%~90.00%、33.33%~72.73%、60.00%~85.00%。总体来看,除浙东外,其他区域均呈现2019 年下降、2020 年上升的趋势。对3 年各区域的平均个体阳性率及场群阳性率统计比较发现,浙北、浙南之间的个体阳性率无显著性差异,但它们显著高于其他区域(P<0.05),提示浙北、浙南SVA 感染较严重。

表6 2018—2020 年SVA 抗体阳性率空间分布 单位:%
2.1.4 阳性场群个体阳性率分布 本次调查共检测到176 个抗体阳性场群,包括152 个养殖场群、34 个屠宰场群。养殖场群抗体平均个体阳性率为19.30%,中位数为13.81%,标准差为19.18%;屠宰场群平均个体阳性率为25.50%,显著高于养殖场(P<0.01),中位数为15.84%,标准差为25.79%。由分析结果(图1)可以看出:50%的养殖场阳性群体抗体个体阳性率低于15.00%,75%低于30.00%;50%的屠宰场阳性群体抗体个体阳性率低于16.00%,75%低于35.00%。

图1 SVA 抗体阳性场群个体阳性率分布
2.2 组织样品检测
2.2.1 时间分布 不同年份统计结果(表7)显示,2017—2020 年SAV 核酸个体阳性率与群体阳性率呈逐年下降趋势。统计分析显示,4 年间个体阳性率与群体阳性率差异均极显著(P<0.01)。

表7 2017—2020 年组织样品SVA 核酸检测结果统计
2.2.2 场群分布 将样品来源分为临床健康猪群与非健康猪群,其中临床健康猪群样品来源于屠宰场,非健康猪群样品来源养殖场与无害化处理场病死猪。从检测统计结果(表8~9)来看,临床健康猪群的SVA 平均个体阳性率与群体阳性率均显著高于非健康猪群(P<0.01)。2017—2020 年,临床健康猪群核酸个体阳性率和群体阳性率分别为3.32%~23.83%和4.88%~42.86%,非健康猪群分别为0.59%~8.13%和2.63%~13.64%。2019—2020 年22 个屠宰场同一群体来源的血清及组织样品检测结果(表10)显示,15 个抗体阳性场群中,包含1 个核酸阳性场,占6.7%;7 个抗体场阴性场群中,包含1 个核酸阳性场,占14.3%。

表8 2017—2020 年屠宰场生猪淋巴结SVA核酸检测结果统计

表9 2017—2020 年养殖场与无害化处理场病死猪病料的SVA 核酸检测结果统计

表10 2019—2020 年屠宰场同一来源群体SVA 抗体与核酸检测结果对比 单位:个
2.2.3 区域分布 区域统计结果(图2)显示:2017 年全省5 个区域均有组织样品检出SVA 核酸阳性,其中个体阳性率浙南和浙东较高,分别为27.52%、28.33%,与其他区域存在显著差异(P<0.05),而区域间的场群阳性率均无显著性差异。2018—2020 年SVA 核酸阳性只在浙南和浙北被检出,且这两个区域不同年份间的阳性率变化较大,2018 年浙南个体阳性率和场群阳性率显著高于浙北,而2019 年又显著低于浙北(P<0.05),2020 年两个区域间又差异不明显。
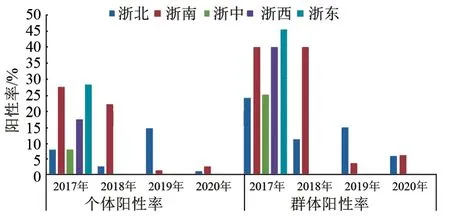
图2 2017—2020 年SVA 病原样品阳性率及群体阳性率区域分布
3 讨论
本研究对浙江省2017—2020 年SVA 时间与空间分布进行了血清学调查,发现平均71.84%的群体为SVA 抗体阳性,表明SVA 在浙江省猪群中流行较为广泛。
抗体检测结果显示:从时间分布看,2018—2020 年SVA 抗体阳性率呈波动状变化趋势,2019年抗体个体阳性率与群体阳性率较2018 年显著下降,2020 年又显著回升。从区域分布看,各区域的抗体阳性率有一定差异,2018—2019 年浙南、浙北抗体阳性率较高,2020 年浙东、浙南较高,但总体看,浙南、浙北较高,需要重点加强对这些地区的SVA 监测。经调查分析,引起区域间差异的主要原因可能与各区域的养殖量与调入量有关。从场点分布看,2018—2020 年屠宰场平均抗体个体阳性率显著高于养殖场,这可能与屠宰场样品来源复杂有关,也提示浙江省调入的生猪存在不同程度的SVA 感染。
核酸检测情况显示:时间分布上,2017—2020 年核酸个体阳性率与群体阳性率总体呈显著下降趋势。区域分布上,2017 年浙江省5 个区域均有阳性检出,但2018 年后只在浙南、浙北区域被检出。场点分布上,来源于屠宰场临床健康猪群的SAV 核酸检出率显著高于来源于养殖场与无害化处理场的病死猪群,表明SVA 感染多表现为隐性感染,这与张志等[12]对我国部分省份猪群的SVA 调查结果一致。另外,该结果也与屠宰猪群包含一定的省外调入猪群有关,说明外省份调入生猪存在SVA 感染,这与全国多个省份报道的SVA分布较广的结果相符[12-19]。
比较全省总体SVA 抗体阳性率与病毒核酸阳性率可以发现,抗体阳性率明显高于核酸阳性率。同时,抗体阳性场群内SVA 感染率较低,75%的阳性养殖场群感染率低于30%,屠宰场阳性群感染率低于35%。这可能与该病毒在健康猪群中代谢周期短,导致发生隐性一过性感染有关。15 个屠宰场检测到SVA 抗体阳性,却只有1 个场检测到病毒核酸阳性,也进一步说明猪群感染后排毒时间较短。这也与相关报道[12]的多数血清阳性样品中病毒含量较低的结果相一致。
总体来看,浙江省近几年SVA 污染范围有所下降,这可能与非洲猪瘟疫情传入后,生猪流通监管力度加大,猪场规模化程度提高,猪场和屠宰场更加重视生物安全以及提高消毒频率等因素有关。但2020 年感染抗体水平有所回升,说明防控有所松懈,应引起重视,仍需持续监测。考虑到浙江省养猪密度大,流通范围广,特别是SVA 传入我国后,已在美国株的基础上进化出5 个遗传分支[20],甚至已重组形成新的重组病毒[21-23],浙江省需继续加强SVA 监测,密切关注其流行特点变化。
4 结论
调查发现,浙江省猪群的SVA 感染强度有所下降,但污染面仍然较广,临床健康猪群中SVA隐性感染较严重,需重视并持续加强外省调入猪群及本地养殖猪群的SVA 感染监测。
