三种不同血清型肺炎球菌多糖国家参考品的研制
2022-10-13王珊珊陈琼许美凤李亚南徐颖华叶强
王珊珊,陈琼,许美凤,李亚南,徐颖华,叶强
·技术与方法·
三种不同血清型肺炎球菌多糖国家参考品的研制
王珊珊*,陈琼*,许美凤,李亚南,徐颖华,叶强
102629 北京,中国食品药品检定研究院,卫健委生物技术产品检定方法及其标准化重点实验室
肺炎球菌感染是导致老年人死亡的主要原因之一,WHO 将其列为 12 种造成严重疾病负担的重点致病菌之一,且耐药性肺炎球菌的出现对当前临床治疗造成很大的挑战[1]。大量研究证实疫苗的免疫接种是预防和控制肺炎球菌感染最经济、最有效的措施。当前针对成人肺炎球菌感染的预防性疫苗主要为覆盖了已报道的 65% ~ 91% 血清型分离菌株的 23 价肺炎球菌多糖疫苗(PPV23)[2-3]。多糖作为 PPV23 中有效组分,与疫苗的免疫原性密切相关。因此,疫苗中不同血清型多糖的含量是确保 PPV23 质量有效、稳定的最重要质控指标之一[4-5]。
2020 年版《中国药典》推荐应用特异性速率比浊方法对PPV23 中所含有各型多糖含量检测[6],当前有四款PPV23 产品在国内上市,使用各自企业研制的内控品进行多糖含量检测,因此,为了加强不同企业生产的疫苗中多糖含量的质量控制,本研究研制了2、8 和 10A 三种血清型肺炎球菌多糖国家参考品,以期为后续PPV23 产品质量控制提供物质基础。
1 材料与方法
1.1 材料
1.1.1 试剂 2、8 和 10A 血清型多糖候选参考品由成都生物制品研究所有限责任公司提供;10 μg/ml 型的肺炎球菌多糖标准品(批号:PN-PV-01Mar2016)、内部质控品(批号:00118241.0000393)由 Merck Sharp & Dohme Corp. 惠赠;不同血清型因子血清标准品购自丹麦血清研究所;IMMAGE800 缓冲液、IMMAGE800 稀释液和 IMMAGE800 洗液购自美国 Beckman 公司;其他试剂为国产分析纯。
1.1.2 仪器与设备 免疫化学分析系统(IMMAGE800)购自美国 Beckman 公司;AVANCE-600 型超导核磁共振波谱仪(包括自动进样器和 TopSpin 工作站)购自德国布鲁克公司。
1.2 方法
1.2.1 不同血清型多糖候选参考品的血清型别鉴定 参考文献[7]方法,采用1H 核磁共振法对不同血清型多糖候选参考品的型别鉴定。采用 zg30 脉冲序列采集1H-NMR 数据,脉冲角度为 30°,实验温度为 50 ℃,采样谱宽为 6000 Hz,中心频率位于 δH3.0,采样点数为 64 K 以及采样次数为 128 次。
1.2.2 不同血清型多糖候选参考品的质量分析 根据《中国药典》2020 年版三部的 23 价肺炎球菌多糖疫苗各论对不同血清型多糖候选参考品包括蛋白质、核酸等杂质含量检测、氨基己糖、糖醛酸和(或)甲基戊糖基团含量检测以及分子大小和内毒素含量进行检测分析。
1.2.3 不同血清型多糖候选参考品分装均匀性分析 随机抽取不同血清型候选参考品 50 瓶,应用速率比浊法进行检测分析,计算不同样品多糖浓度的相对标准偏差(RSD),评价三种不同血清型多糖候选参考品的分装均匀性。
1.2.4 不同血清型多糖候选参考品稳定性分析 将长期放置–70 ℃冰箱保存的三种血清型候选参考品取出,在室温 25 ℃反复冻融 3 次,并将候选参考品分别于 2 ~ 8 ℃放置 7、14、28 和 60 d,25 ℃放置 3、7、14、21 和 28 d,37 ℃放置 3、7、14、21 和 28 d,同时与放置–70 ℃冰箱保存的各自候选参考品进行相同稀释度平行测定,所有样品均重复测定 3 次,系统评价候选参考品的稳定性。
1.2.5 不同血清型多糖候选参考品协作标定 按照拟定协作标定方案,组织成都生物制品研究所有限责任公司、北京民海生物科技有限公司及中国食品药品检定研究院 3 家实验室进行候选参考品的多糖含量标定。每个实验室至少获得 5 个独立数据,每次实验有效性前提为标准曲线相关系数(2)不小于 0.99,且两次平行测定值 RSD 应不大于 15%,内部质控品的多糖含量在 35 ~ 65 μg/ml,最终将所有原始结果提交中国食品药品检定研究院统一分析。
1.3 统计学处理
应用 SPSS 20 统计分析软件对稳定性实验数据进行单因素方差分析,以< 0.05 为差异有统计学意义。
2 结果
2.1 候选参考品的血清型别鉴定结果
2、8 和 10A 血清型多糖候选参考品的1H 核磁谱图端基质子区各峰的化学位移与各自型别肺炎球菌多糖核磁指纹特征图谱一致[7],表明这三种候选参考品分别为 2、8 和 10 A 型肺炎球菌多糖(图 1)。

图 1 三种不同血清型多糖候选参考品的核磁共振法分析结果
2.2 候选参考品的质量检测结果
按照 2020 版中国药典推荐的方法,对三种不同血清型多糖候选参考品相关限度质量检测,结果显示 2、8 和 10 A 型肺炎球菌多糖各项质量检测项目结果均符合质量标准要求(表 1),表明三种不同血清型多糖候选参考品的质量良好。
2.3 分装均匀性分析结果
分装均匀性分析结果显示,除 8 型多糖候选参考品偶尔几个样品略高一些,其他随机抽取 50 瓶候选参考品的多糖含量检测结果基本维持固定浓度水平(图 2),50 瓶多糖含量检测结果的 RSD(%)分别为 3.9%、9.8% 和 3.5%,均低于 10%,表明这三种不同血清型多糖候选参考品的分装均匀性较好。
2.4 稳定性分析结果
三种不同血清型多糖候选参考品经反复冻融 3 次后,与长期–70 ℃保存的各候选参考品检测结果相比,2、8 和 10A 型多糖样品的 RSD 值分别为 4.2%、1.9% 和 2.2%,均在10% 以内,统计学分析均无显著差异(2、8 和 10A 型多糖样品比较统计学分析的值分别为 0.079、0.245 和0.317,均大于 0.05)。同时,将各候选参考品分别于 2 ~ 8、25 和37 ℃放置不同时间后,与–70 ℃保存的候选参考品检测相比较,2、8 和 10A 型多糖候选参考品浓度在不同温度放置后无显著性变化(图 3),差异无统计学意义(2、8 和 10A 型多糖样品比较统计学分析的值分别为 0.226 ~ 0.505、0.265 ~ 0.641 和 0.245 ~ 0.426,均大于 0.05),2、8 和 10A 型多糖样品检测结果的 RSD 值分别为 4.2%、2.6% 和 5.5%,表明三种不同血清型多糖候选参考品的具有良好稳定性。
2.5 多糖含量协作标定结果
协作标定分析结果 3 个不同实验室检测标准曲线相关系数(2)均大于 99%,各自使用的内部控制品的多糖含量均在规定范围之间,符合实验成立标准。不同实验室获得的 2、8 和 10A 型三种不同血清型多糖含量 RSD 分别为 7.6%、9.1% 和 6.1%,平均浓度分别为 465、467 和 509 μg/ml。
3 讨论
应用统一的检测用相关国家参考品,可促进不同企业生产疫苗产品质量控制的结果准确性和可溯源性[5]。为了保证研制参考品的质量,从标准物质原材料制备就开始严格按照PPV23 疫苗生产的要求,获得不同血清型多糖,并应用核磁共振法对 2、8 和 10A 型多糖的型别鉴定,确保所用多糖参考品的血清型别的特异性。同时,按照 2020 年版《中国药典》推荐的方法,对 2、8 和 10A 型候选参考品的多项质量参数进行验证分析,结果均符合《中国药典》质量标准与国家药品标准物质的要求[6, 8]。

表 1 三种不同血清型多糖候选参考品的质量分析结果
注:N/A 表示不适用;*2 和 8 型多糖采用琼脂糖 CL-2B 凝胶过滤法测定分子大小,10A多糖采用琼脂糖 CL-4B 凝胶过滤法测定。

图 2 三种不同血清型多糖候选参考品的均匀性分析结果
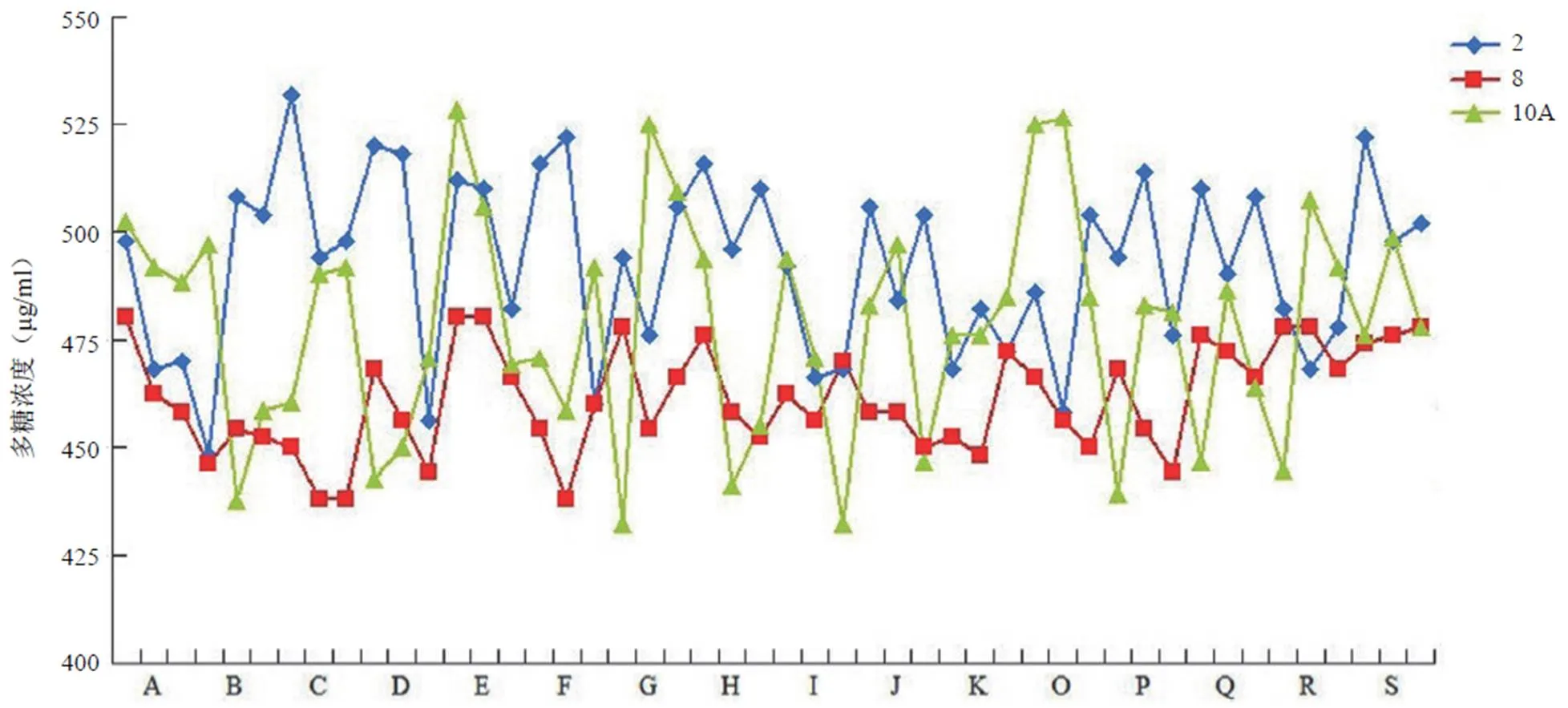
图 3 三种不同血清型多糖候选参考品的稳定性分析结果(A:–70 ℃保存;B、C、D 和 E 分别代表 2 ~ 8 ℃放置 7、14、28 和 60 d;F、G、H、I 和 J 分别代表 25 ℃放置 3、7、14、21 和 28 d;K、O、P、Q 和 R 分别代表 37 ℃放置 3、7、14、21 和 28 d;S 代表反复冻融 3 次的样品,所有样品均平行重复测定 3 次)
作为评价国家标准物质的最关键参数,候选参考品的均匀性和稳定性直接与其质量密切相关[8-10]。本研究通过随机抽取 50 瓶不同血清型候选参考品进行均匀性分析,结果显示 2、8 和 10A 型候选参考品含量检测的 RSD 均低于 10%,表明这三种不同血清型多糖候选参考品的分装均匀性较好,也进一步支持速率比浊法用于 PPV23 的多糖含量检测的适用性。同时,参考《国家药品标准物质技术规范》要求[8],并综合考虑未来候选参考品在运输、分发以及实际使用过程中存在反复冻融、保存条件等温度变化等因素,将 2、8 和 10A 型候选参考品反复冻融 3 次,以及分别于 4 ℃、25 ℃、37 ℃放置不同时间后进行检测分析,结果发现与–70 ℃保存的样品分析结果无显著性差异,结果表明这三种不同血清型候选参考品的稳定性良好。
免疫速率比浊法是基于抗原抗体特异性结合反应,形成抗原抗体复合物,增加反应液的浊度,通过与系列稀释的标准品进行比较,获得待检物的含量[11]。由于其快速、特异、灵敏,已被广泛用于多糖类疫苗的质量控制,尤其适合于多种血清群或型疫苗中不同多糖抗原含量检测[12-13]。然而,当前在国外只有 1 ~ 2 家企业生产 PPV23,且产品原研国也不尽相同,缺乏肺炎球菌多糖的国际标准品,所以这些企业均采用自行研制多糖参考品进行质量控制。在我国前几年,仅 1 ~ 2 家企业生产的 PPV23 产品上市时,也是使用企业自行研制多糖参考品进行质量控制,但随着国内生产 PPV23 产品的厂家数量增加,使用统一的多糖参考品用于疫苗关键有效组分的质量控制,有利于保持产品质量的一致性,促进疫苗监管。在本研究中,选用其中一家使用时间长且可溯源的企业自制参考品作为检测和协作标定结果的参考品,结果证实速率比浊法检测多糖含量重复性好,不同实验室多糖含量 RSD 均小于 10%,符合国家标准物质的相关要求[8]。
综上所述,本研究研制的 2、8 和 10A 型肺炎球菌多糖国家参考品的各项检测指标均符合规定,具有良好的均匀性和稳定性,可用于肺炎球菌多糖疫苗质量控制。
志谢 感谢成都生物制品研究所有限责任公司、北京民海生物科技有限公司给予的帮助!
[1] World Health Organization. Pneumococcal conjugate vaccines in infants and children under 5 years of age: WHO position paper-February 2019. Weekly Epidemiol Rec, 2019, 94(8):85-103.
[2] Suzuki M, Dhoubhadel BG, Ishifuji T, et al. Adult Pneumonia Study Group-Japan (APSG-J). Serotype-specific effectiveness of 23-valent pneumococcal polysaccharide vaccine against pneumococcal pneumonia in adults aged 65 years or older: a multicentre, prospective, test-negative design study. Lancet Infect Dis, 2017, 17(3):313-321.
[3] Lawrence H, Pick H, Baskaran V, et al. Effectiveness of the 23-valent pneumococcal polysaccharide vaccine against vaccine serotype pneumococcal pneumonia in adults: a case-control test-negative design study. PLoS Med, 2020, 17(10):e1003326.
[4] Chinese Preventive Medicine Association, Chinese Preventive Medicine Association Vaccine and Immunization. Expert consensus on immunization for prevention of pneumococcal disease in China (2017). Chin Prev Med, 2018, 19(3):161-191. (in Chinese)
中华预防医学会, 中华预防医学会疫苗与免疫分会. 肺炎球菌性疾病免疫预防专家共识(2017版). 中国预防医学杂志, 2018, 19(3): 161-191.
[5] Wang JZ. Vaccine quality control and evaluation. Beijing: People’s Medical Publishing House, 2013:720-734. (in Chinese)
王军志. 疫苗的质量控制与评价. 北京: 人民卫生出版社, 2013: 720-734.
[6] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China. Volume 3, 2020. Beijing: China Medical Science Press, 2020:91-94. (in Chinese)
国家药典委员会. 中华人民共和国药典. 2020年版三部. 北京: 中国医药科技出版社, 2020:91-94.
[7] Abeygunawardana C, Williams TC, Sumner JS, et al. Development and validation of an NMR-based identity assay for bacterial polysaccharides. Anal Biochem, 2000, 279(2):226-240.
[8] Chen YF, Xiao XY, Li B. Introduction of quality management of international pharmaceutical reference materials and their implication in China. Chin Pharm Aff, 2013, 27(12):1258-1261. (in Chinese)
陈亚飞, 肖新月, 李波. 国外药品标准物质质量管理介绍及对我国的启示. 中国药事, 2013, 27(12):1258-1261.
[9] Chen YF, Xiao XY, He P, et al. Interpretation of reference material stability investigation requirements and study on expiry date management methods. Chin Pharm Aff, 2018, 32(3):317-322. (in Chinese)
陈亚飞, 肖新月, 何平, 等. 标准物质稳定性考察规范解读和有效期管理方式的研究. 中国药事, 2018, 32(3):317-322.
[10] Ma LY, Ning BM, Chen GQ, et al. Introduction of general guidance for the national pharmaceutical reference standards. Chin J Pharm Anal, 2010, 30(10):1990-1992. (in Chinese)
马玲云, 宁保明, 陈国庆, 等. 国家药品标准物质研制技术要求的介绍. 药物分析杂志, 2010, 30(10):1990-1992.
[11] Lee CJ. The quantitative immunochemical determination of pneumococcal capsular polysaccharide by light scattering quantitative rate nephelometry. J Biol Stand, 1983, 11(1):55-64.
[12] Li YN, Zhu XG, Mao QQ, et al. Development and verification of immune rate turbidimetric method for quantitative determination of polysaccharide content in groups A and C meningococcus and Haemophilus influenzae type b combined vaccine. Chin J Biol, 2017, 30(6):645-648. (in Chinese)
李亚南, 朱向国, 毛琦琦, 等. AC群脑膜炎球菌与b型流感嗜血杆菌联合疫苗多糖含量免疫速率比浊检测方法的建立及验证. 中国生物制品学杂志, 2017, 30(6):645-648.
[13] Jones C, Currie F. Control of components of bacterial polysaccharide vaccines by physical methods. Biologicals, 1991, 19(1):41-47.
10.3969/j.issn.1673-713X.2022.05.009
“重大新药创制”国家科技重大专项(2018ZX09738006-006)
叶强,Email:qiangyee@nifdc.org.cn;徐颖华,Email:xuyh@nifdc.org.cn
2021-12-16
*共同第一作者
