白蛋白美登素偶联物的制备及其体外抗胰腺癌活性研究
2022-10-13胡尚玖王莹张国宁朱梅王明华王菊仙
胡尚玖,王莹,张国宁,朱梅,王明华,王菊仙
·论著·
白蛋白美登素偶联物的制备及其体外抗胰腺癌活性研究
胡尚玖,王莹,张国宁,朱梅,王明华,王菊仙
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所有机合成室
制备人血清白蛋白(HSA)与美登素衍生物 mertansine(DM1)的偶联物,评价其体外抗胰腺癌细胞活性。以安丝菌素为原料经还原、酯化等反应制得美登素衍生物 DM1,以 N-羟基琥珀酰亚胺与马来酸酐为原料反应制得连接子 SMCC,通过连接子 SMCC 将 DM1 与人血清白蛋白偶联制得偶联物 HSA-DM1,采用 HPLC、MALDI-TOF 对其进行表征并计算平均偶联比。采用 CCK-8 法测定偶联物对 MIA PaCa-2、PANC-1 和 BxPC-3 三种胰腺癌细胞系的增殖抑制作用;利用流式细胞术和 Western blot 法测定其对 MIA PaCa-2 和 PANC-1 细胞的促凋亡能力。成功制备偶联物 HSA-DM1,其平均偶联比为 3.32,对MIA PaCa-2、PANC-1 和BxPC-3 三种细胞系的 IC50值分别为(48.2 ± 6.5)、(55.0 ± 4.7)、(84.0 ± 11.8)nmol/L,同时其对 MIA PaCa-2 和 PANC-1 细胞的促凋亡作用呈剂量依赖。偶联物 HSA-DM1 具有显著抑制胰腺癌细胞增殖的活性,具有潜在的临床应用前景。
人血清白蛋白; 美登素衍生物; 偶联物; 胰腺癌
胰腺癌作为最致命的癌症之一通常在晚期才会被确诊,同时它具有极强的侵袭性,导致大多数患者无法通过手术实现根除性切除,且对大多数常规治疗方案具有显著抗性[1],这些特性致使胰腺癌患者五年内生存率仅有大约 8%[2]。
基因编码的 Ras 蛋白质是一种小型 GTP 酶,是细胞多个调控过程中的分子开关[3]。90% 的胰腺癌是胰腺导管癌,而其中 95% 的胰腺导管癌都存在突变[4]。研究表明,突变会增强细胞的巨胞饮作用[5],这是一种内吞作用,其机制是细胞外液经细胞膜内陷包裹形成囊泡(巨胞饮体)进入细胞内,摄入的物质会在溶酶体中降解,以支持新陈代谢和大分子的合成。研究证明突变的癌细胞,例如胰腺导管癌细胞会通过巨胞饮作用吞噬白蛋白来获得谷氨酰胺等氨基酸以维持癌细胞的增殖[5],通过该方法癌细胞可以绕过一些氧依赖性的关键代谢途径,以提高在缺氧条件下的生长能力。
Kratz[6]发现白蛋白及白蛋白相关药物会特异性聚集于突变的胰腺癌细胞及组织。实际上不仅是突变的胰腺癌细胞,对于其他实体瘤,白蛋白也会在肿瘤中积累[7],因此白蛋白能够作为抗肿瘤药物的运输载体,改变有效载荷在体内的分布[8]。纳米粒白蛋白结合紫杉醇 Abraxane®在2005 年首次被 FDA 批准用于乳腺癌治疗,此后于 2012 年被批准用于治疗无法进行化疗或治愈性治疗的转移性非小细胞肺癌患者,于 2013 年 6 月被批准与吉西他滨联合用于治疗转移性胰腺癌。该结合物解决了紫杉醇溶解性差的问题并使其能够靶向作用于肿瘤部位,明显降低毒性的同时提高了疗效[9-11]。
此外,白蛋白作为一种天然的递药系统拥有许多其他的优点,它是血浆中最丰富的蛋白质;其结构对温度、pH 的变化稳定;具有较长的循环半衰期(约 19 d)[12-13],作为递药系统时可以改善有效载荷的药代动力学特征,例如 Levemir®将胰岛素与对内源性白蛋白具有高结合亲和力的肉豆蔻酸连接,成功延长有效载荷的半衰期[14]。
美登素及其衍生物 DM1 是有效的微管蛋白抑制剂[15],在有丝分裂期间抑制细胞增殖,它们具有强大的细胞杀伤作用,但狭窄的治疗窗口阻碍了这些分子的临床应用[16]。迄今为止,只有曲妥珠单抗与 DM1 的抗体药物偶联物(antibody-drug conjugate,ADC)Kadcyla®(T-DM1)被 FDA 批准用于治疗乳腺癌。
利用白蛋白对胰腺癌细胞及组织的特异性聚集及其药代动力学特性,将美登素衍生物DM1 与白蛋白偶联有可能获得新型抗胰腺癌活性的偶联物。我们通过不可裂解型接头 4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(SMCC)将美登素衍生物 DM1 与重组人血清白蛋白的赖氨酸残基结合,合成了偶联物 HSA-DM1,并评价了其体外抑制胰腺癌细胞增殖的活性,为靶向抗肿瘤药物的研发提供思路。
1 材料与方法
1.1 材料
1.1.1 主要仪器 400 MHz、500 MHz、600 MHz 核磁共振仪购自德国 Bruker 公司;旋转蒸发仪套装(旋转蒸发仪 B-100、真空泵 V-100、界面 I-100)购自瑞士 Buchi 公司;CF311C 型冷却水循环装置购自日本 Yamato 公司;RCT Basic 磁力搅拌器购自德国 Ika 公司;LS 320A scs 分析天平购自瑞士 Precisa 公司;DHJF-8005 低温恒温搅拌反应浴购自郑州长城科工贸有限公司;Quiksep 制备型中高压层析系统购自北京慧德易科技有限责任公司;Ultimate 3000 UHPLC 购自美国 Thermo Fisher Scientific 公司;MALDI-TOF/TOF 5800 型质谱仪购自美国 AB Sciex 公司;Centrifuge 5804 R 离心机购自德国 Eppendorf 公司;KYXY-70 全自动雪花制冰机购自北京科誉兴业科技发展有限公司;Amicon Ultra-10K 蛋白超滤管购自美国 Millipore 公司;HisTrap Desalting 凝胶色谱柱购自美国 GE 公司。
1.1.2 主要试剂 束丝放线菌发酵产生的安丝菌素由中国医学科学院医药生物技术研究所武临专课题组提供;甲基磺酸甲酯、3-巯基丙酸、N-羟基琥珀酰亚胺等试剂均为市售分析纯或者化学纯;BCA 检测试剂盒和蛋白分子量标准购自美国 Thermo Fisher Scientific 公司;人重组白蛋白 HSA 购自北京索莱宝科技股份有限公司;CCK-8、Annexin V-FITC 凋亡检测试剂盒购于东仁化学科技(上海)有限公司;Apoptosis Antibody SamplerKit 购自美国 Cell Signaling Technology 公司;抗b-actin 抗体购自武汉爱博泰克生物科技有限公司。
1.1.3 细胞 人胰腺癌 MIA PaCa-2、PANC-1 和 BxPC-3 细胞系由中国医学科学院医药生物技术研究所保存。
1.2 方法
1.2.1 偶联物 HSA-DM1 的制备 美登素衍生物 DM1 与连接子 SMCC 的合成路线如图 1 所示。甲基磺酸甲酯与 3-巯基丙酸为原料反应得到中间体 a,在 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI)介导下与 N-羟基琥珀酰亚胺酯化得到中间体 b,随后与 N-甲基-L-丙氨酸发生缩合反应得到中间体 c。三甲基氢化铝锂还原安丝菌素得到美登醇 P0,在 N,N'-二环己基碳二亚胺(DCC)介导下与中间体 c 酯化反应分离得到 L-DM1-SMe,随后由二硫苏糖醇(DTT)还原得到化合物 DM1。反式-4-氨甲基环己甲酸与马来酸酐反应后,再与经三氟乙酸酐活化后的 N-羟基琥珀酰亚胺反应生成化合物 SMCC。
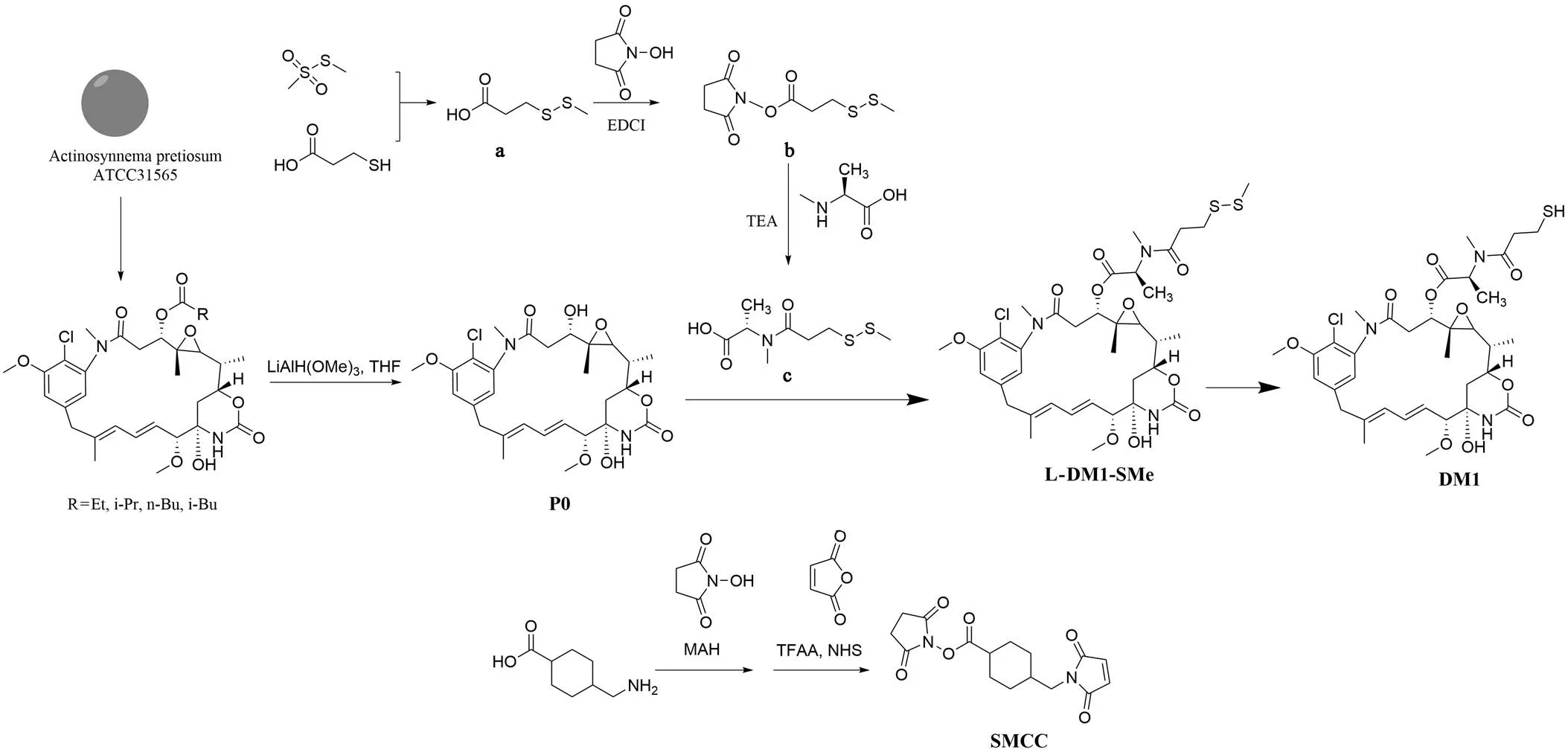
图 1 化合物 DM1 与 SMCC 的合成路线
Figure 1 Syntheses of compounds DM1 and SMCC
偶联物 HSA-DM1 的合成路线如图 2 所示,采用“两步法”策略,连接子 SMCC 的N-羟基琥珀酰亚胺活性酯部分与人血清白蛋白上的赖氨酸残基反应形成酰胺键,马来酰亚胺部分与 DM1 的巯基发生迈克尔加成反应得到偶联物 HSA-DM1。
称取 7.4 mg SMCC 溶于 1 ml 二甲基亚砜得到 22.16 mmol/L SMCC 的二甲基亚砜溶液,称取4.4 mg 重组人血清白蛋白溶于 4 ml 0.01 mol/L PBS缓冲溶液(pH 7.2 ~ 7.4)。取 45.2 μl 22.16 mmol/LSMCC 的二甲基亚砜溶液稀释于 900 μl 0.01 mol/L PBS 缓冲溶液(pH 7.2 ~ 7.4),将其滴加至重组人白蛋白溶液中(100 μl × 9 + 45.2 μl,每次间隔10 min),室温搅拌 20 h。将反应液离心(1000 r/min,4 ℃,20 min),离心结束取上清液用 0.2 μm 滤膜过滤,取滤液超滤离心(10 kD MWCO,3500 ×,4 ℃,20 min),离心完成后取截流液,加入 2 ml0.01 mol/L PBS 缓冲溶液稀释,重复 3 次后取截留液,加入 0.01 mol/L PBS 缓冲溶液将反应液稀释至 4 ml。
称取 3.7 mg DM1 溶于 0.5 ml N,N-二甲基乙酰胺得到 10.04 mmol/L DM1 的 N,N-二甲基乙酰胺溶液,取 32.05 μl 该溶液稀释于 900 μl 0.01 mol/L PBS 缓冲溶液(pH 7.2 ~ 7.4),将其滴加至反应液中(100 μl × 9 + 32.05 μl,每次间隔 10 min),室温搅拌 5.5 h。将反应液用 0.2 μm 滤膜过滤,滤液通过凝胶色谱柱纯化,用 0.01 mol/L PBS 缓冲溶液(pH 7.2 ~ 7.4)洗脱产物。收集目标组分超滤离心(10 kD MWCO,3500 ×,4 ℃,20 min 两次),将截流液用 0.2 μm 滤膜过滤,得 1.550 ml 滤液,用 BCA法测定蛋白浓度。
1.2.2 BCA 法测定样品浓度 将 2 mg/ml 的牛血清白蛋白(BSA)标准品用纯净水稀释得到 BSA 标准溶液 1500、1000、750、500、250、125、25 μg/ml。取上述 8 个浓度的 BSA 标准溶液、纯净水和待测蛋白质样品各 10 μl 加入到微孔板中,向每个孔加入 200 μl 工作液,在振荡器上振荡 30 s 后,再将微孔板置于 37 ℃孵育 30 min。孵育结束后,将微孔板冷却至室温,使用酶标仪检测样品在570 nm 波长的吸光度。将各个标准溶液和待测样品在 570 nm 波长的吸光值减去空白溶液在 570 nm 波长的平均吸光值。将 BSA 标准溶液在 570 nm 波长经过空白校正的平均吸光值对其浓度作图,绘制标准曲线。将待测样品经过空白校正的平均吸光值依据标准曲线换算出待测蛋白质样品的浓度。
1.2.3 HPLC 检测偶联物 HSA-DM1 样品纯度
⑴HPLC 检测 HSA-DM1样品中游离的DM1。色谱柱:ACQUITY UPLC Protein BEH SEC Column(200 Å 1.7 μm,4.6 mm × 150 mm);流动相 A:100 mmol/L 磷酸钠水溶液,pH 6.8;流动相 B:20% 甲醇水溶液;HSA-DM1 及 DM1 的洗脱条件:初始流动相为流动相 A,15 min 内梯度变换至流动相 B,并以流动相 B 继续洗脱0 min;流速:0.3 ml/min;检测波长:230 nm。
⑵HPLC 检测 HSA-DM1 样品中蛋白质杂质占比。仪器:Thermo Scientific Ultimate 3000 UPLC;色谱柱:ACQUITY UPLC Protein BEH SEC Column(200 Å 1.7 μm,4.6 mm × 150 mm);流动相:100 mmol/L 磷酸钠水溶液,pH 6.8;流速:0.3 ml/min;检测波长:280 nm。
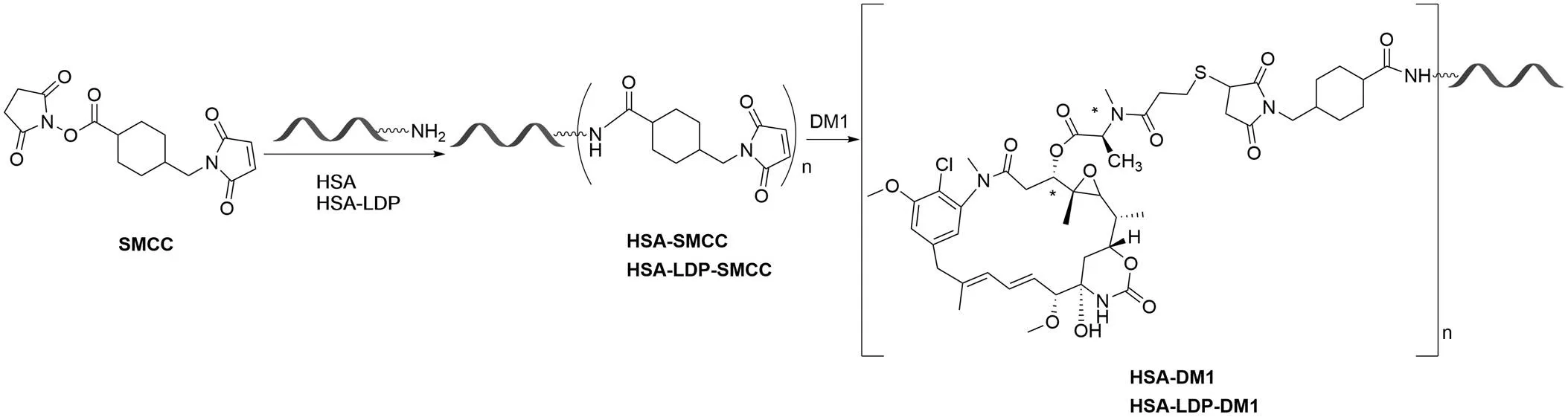
图 2 偶联物 HSA-DM1 的合成路线
Figure 2 Syntheses of HSA-DM1 conjugate
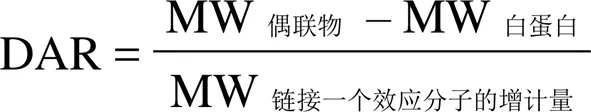
1.2.4 MALDI-TOF 测定偶联物 HSA-DM1 的分子量与平均偶联比 将保存在 PBS 溶液中的偶联物 HSA-DM1 脱盐后与芥子酸饱和溶液 1:1 混合,取 1 μl 点至 384 靶板上,室温条件下自然晾干,置于 MALDI-TOF/TOF 中检测分子量。通过测定重组人血清白蛋白和偶联物 HSA-DM1 的平均分子量,计算出制备的偶联物 HSA-DM1 的药物白蛋白偶联比(DAR),计算公式如下:
1.2.5 CCK-8 法检测 HSA-DM1 对胰腺癌细胞增殖抑制作用 取对数生长期的人胰腺癌MIA PaCa-2、PANC-1 和 BxPC-3 细胞经 0.25% 的胰蛋白酶消化后,制成单细胞悬液,计数,稀释成适宜浓度接种于96 孔板,细胞密度为 4000 个/孔,37 ℃、5% CO2培养 24 h,待细胞贴壁生长后,加入不同浓度的药物培养 72 h。血清饥饿组细胞接种 24 h 后更换无血清的培养液,然后加入不同浓度的药物培养 72 h。每孔加入 CCK-8 溶液 10 μl 培养 1 ~ 3 h,酶标仪测定 450 nm 处的吸光值(450)。实验设置无药对照组和无细胞空白对照组,SPSS 软件计算药物 IC50值。
1.2.6 Annexin V-FITC/PI 双染结合流式细胞仪分析 HSA-DM1 诱导胰腺癌细胞凋亡作用 取对数生长期的 MIA PaCa-2 和 PANC-1 细胞计数后稀释成适宜浓度接种于 6 孔板, 24 h 后给药,继续培养 24 或 48 h,然后小心收集细胞培养液到离心管内备用。0.25% 胰蛋白酶消化细胞,终止消化后细胞悬液与前面收集的上清液混合,1000 r/min离心5 min,弃上清,然后加入 PBS 洗涤 2 次。加入预先配置好的 Annexin V 结合缓冲液,制成细胞数为1 × 106个/ml 的细胞悬液,取出细胞悬液 100 μl 加入到新的 EP 管中,向细胞悬液中加入 Annexin V-FITC 结合物 5 μl,再加入碘化丙啶(PI)溶液 5 μl,室温下避光放置 15 min,加入预先配置好的 Annexin V 结合缓冲液,制成细胞数为1 × 106个/ml 的细胞悬液,取出细胞悬液 100 μl 加入到新的 EP 管中,向细胞悬液中加入 Annexin V-FITC 结合物 5 μl,再加入PI 溶液 5 μl,室温下避光放置 15 min 后加入 Annexin V 结合缓冲液 400 μl,用 200 目滤网过滤样品后上机检测。FlowJo 软件绘制并统计实验结果。
1.2.7 Western blot 法分析 HSA-DM1 诱导胰腺癌细胞凋亡作用 将对数生长期的 MIA PaCa-2 和 PANC-1 细胞计数后稀释成适宜浓度接种于6 孔板,24 h 后给药,继续培养 48 h。收集细胞,经 PBS 洗涤 2 次后,加入 150 ~ 250 μl 细胞裂解液,冰上裂解 30 min,离心 15 min(4 ℃,11 000 r/min),收集上清液并用 BCA 法测定样品中的蛋白浓度。样品变性处理后进行 SDS-PAGE 电泳,上样量为 20 μg,转至聚偏二氟乙烯(PVDF)膜,膜经封闭液作用后,与一抗抗体 4 ℃孵育过夜,膜漂洗后加入辣根过氧化物酶(HRP)标记二抗孵育 60 min,利用 ProteinSimple 凝胶成像系统成像。
2 结果
2.1 DM1 与 SMCC 的合成
合成化合物 DM1 与 SMCC,中间体化合物 c 与化合物 SMCC 经过1H-NMR 和 MS 确证,中间体化合物 P0、L-DM1-SMe 与化合物 DM1 经过1H-NMR、13C-NMR 和 MS确证,数据如下。
2.1.1 (S)-2-(N-甲基-3-(甲基二磺酰基)丙氨基)丙酸(c) 白色固体,收率 29.2%;mp:103.4 ~105.4 ℃;1H-NMR(500 MHz,Chloroform-)δ 5.17(q,= 7.2 Hz,1H),3.00(s,3H),3.00 – 2.95(m,2H),2.85 – 2.75(m,2H),2.41(s,3H),1.44(d,= 7.2 Hz,3H);HRMS-ESI(m/z):238.0576(C8H16NO3S2+,[M+H+],Calc. 238.0566)。
2.1.2 美登醇(P0) 白色固体,收率50.7%;mp:167.2 ~ 169.9 ℃;1H-NMR(400 MHz,Chloroform-)δ 7.07(s,1H),6.80(s,1H),6.46(s,1H),6.41(dd,= 15.2,11.0 Hz,1H),6.13(d,= 10.8 Hz,1H),5.51(dd,= 15.2,9.2 Hz,1H),5.29(s,1H),4.36(t,= 11.0 Hz,1H),3.97(s,3H),3.49 – 3.46(m,1H),3.45(s,1H),3.34(s,3H),3.20(s,3H),3.11(d,= 12.7 Hz,1H),2.58(d,= 9.8 Hz,1H),2.28 – 2.19(m,1H),2.11(d,= 12.4 Hz,1H),1.67(s,3H),1.32 – 1.27(m,4H),1.25(s,3H),0.83(s,3H);13C-NMR(101 MHz,Chloroform-)δ 172.1,155.7,152.9,142.3,140.3,139.0,133.4,125.2,123.7,118.6,112.8,89.0,81.2,75.8,75.3,66.8,63.3,56.8,56.7,47.1,37.8,36.2,35.7,35.5,15.9,14.7,11.3;HRMS-ESI(m/z):565.2336(C28H38ClN2O8+,[M+H+],Calc.565.2311)。
2.1.3 N2'-去乙酰基-N2'-[3-(甲基二硫基)-1-氧代丙基]美登素(L-DM1-SMe) 白色固体,收率40.3%;mp:169 ~ 171 ℃;1H-NMR(600 MHz,Chloroform-)δ 6.81(d,= 1.8 Hz,1H),6.70(d,= 11.1 Hz,1H),6.62(d,= 1.8 Hz,1H),6.45 – 6.39(m,1H),6.34(s,1H),5.65(dd,= 15.4,9.1 Hz,1H),5.39(q,= 6.8 Hz,1H),4.29 – 4.23(m,1H),3.97(s,3H),3.67(s,1H),3.50 – 3.48(m,1H),3.34(s,3H),3.22(s,3H),3.09(d,= 12.8 Hz,1H),3.02 – 3.00(m,1H),2.85(s,3H),2.83 – 2.78(m,2H),2.71 – 2.64(m,1H),2.63 – 2.56(m,1H),2.25(s,3H),2.19 – 2.14(m,1H),1.67(d,= 5.6 Hz,1H),1.62(s,3H),1.56 – 1.52(m,1H),1.30 – 1.26(m,8H),0.79(s,3H);13C-NMR(151 MHz,Chloroform-)δ(ppm) 170.8,170.7,168.8,155.9,152.4,142.0,141.0,139.3,133.3,127.6,125.3,122.1,118.7,113.1,88.4,80.8,78.1,74.1,67.2,59.9,56.6,56.5,52.4,46.5,38.8,36.1,35.5,33.4,32.4,32.0,30.7,22.5,15.5,14.5,13.3,12.1;HRMS-ESI(m/z):784.2715(C36H51ClN3O10S2+,[M+H+],Calc.784.2699)806.2542(C36H50ClN3O10S2Na+,[M+Na+],Calc.806.2518)。
2.1.4 Mertansine(DM1) 白色固体,收率44.2%;mp:190 ~ 192 ℃;1H-NMR(500 MHz,Chloroform-)δ 6.82(s,1H),6.71(d,= 11.3 Hz,1H),6.67(s,1H),6.43(t,= 13.0 Hz,1H),6.27(s,1H),5.64(dd,= 15.3,9.1 Hz,1H),5.42(q,= 6.4 Hz,1H),4.77(d,= 10.8 Hz,1H),4.29(q,= 11.0 Hz,1H),3.98(s,3H),3.67(d,= 12.7 Hz,1H),3.50(d,= 9.0 Hz,1H),3.36(s,3H),3.21(s,3H),3.11(d,=12.7 Hz,1H),3.02(d,= 9.6 Hz,1H),2.84(s,3H),2.77 – 2.69(m,2H),2.66 – 2.53(m,2H),2.18(d,= 14.9 Hz,1H),1.73 – 1.67(m,1H),1.65(s,3H),1.57(d,= 13.9 Hz,1H),1.50 – 1.41(m,1H),1.30(t,= 8.0 Hz,8H),1.27 – 1.20(m,2H),0.80(s,3H);13C-NMR(126 MHz,Chloroform-)δ 170.9,170.8,168.9,156.1,152.4,142.3,141.1,139.6,133.5,127.7,125.4,122.4,119.0,113.3,88.7,81.0,78.3,74.3,67.4,60.1,56.8,56.7,52.5,46.7,39.1,37.9,36.3,35.6,32.6,30.8,19.9,15.7,14.7,13.6,12.3;HRMS-ESI(m/z):738.2857(C35H49ClN3O10S+,[M+H+],Calc.738.2822)760.2670(C35H48ClN3O10SNa+,[M+Na+],Calc.760.2641)。
2.1.5 4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺酯(SMCC) 白色固体,收率52.1%;mp:176.2 ~ 178.2 ℃;1H-NMR(500 MHz,Chloroform-)δ 6.69(s,2H),3.37(d,= 7.0 Hz,2H),2.80(s,4H),2.60 – 2.52(m,1H),2.14(d,= 11.9 Hz,2H),1.77(d,= 13.6 Hz,2H),1.74 – 1.66(m,1H),1.58 – 1.47(m,2H),1.10 – 0.99(m,2H);MS-ESI(m/z):357.2000(C16H18N2O6Na+,[M+Na+],Calc.357.1057)。
2.2 HPLC 检测偶联物 HSA-DM1 样品纯度
2.2.1 HPLC 检测偶联物 HSA-DM1 样品中游离 DM1 样品中游离的效应分子 DM1 会对后续药理学评价造成假阳性结果,选择效应分子 DM1 的最大吸收波长 230 nm 进行 HPLC 检测来判断样品中是否有游离的 DM1 存在。在尺寸排阻色谱 SEC 中,分子量大的成分在孔穴中滞留时间短,洗脱路径短;分子量小的成分在孔穴中滞留时间长,洗脱路径长。图 3 为游离 DM1 对照组与偶联物 HSA-DM1 样品的色谱图,对比可得偶联物 HSA-DM1 样品只存在大分子杂质。
2.2.2 HPLC 检测偶联物 HSA-DM1 样品中蛋白质杂质占比 选择蛋白质分子的特征吸收波长 280 nm 进行 HPLC 检测来判断样品中蛋白质杂质的占比与样品的纯度。经面积归一化法检测得偶联物 HSA-DM1 样品纯度为 94.52%,蛋白质杂质占比为 5.48%,结果如图 4 所示。
2.3 MALDI-TOF 测定偶联物 HSA-DM1 的分子量与平均偶联比
人血清白蛋白与偶联物 HSA-DM1 的分子量如图 5 所示。
通过偶联物与白蛋白的分子量差值计算得到药物白蛋白平均偶联比为 3.32,处于文献报道的合理偶联比范围内[17]。
2.4 CCK-8 法检测HSA-DM1 对胰腺癌细胞增殖抑制作用
在正常培养基条件以及血清饥饿条件评估了游离药物 DM1 和偶联物 HSA-DM1对三种人胰腺癌细胞系 MIA PaCa-2、PANC-1 和 BxPC-3 的增殖抑制作用,结果如图 6 所示。在两种培养条件下,偶联物 HSA-DM1 均表现出了较高的杀伤肿瘤细胞能力,IC50值均在纳摩尔水平,且对三种细胞系的增殖抑制作用强弱体现了一致的趋势,对MIA PaCa-2 的增殖抑制作用最强,对 BxPC-3 的增殖抑制作用最弱。
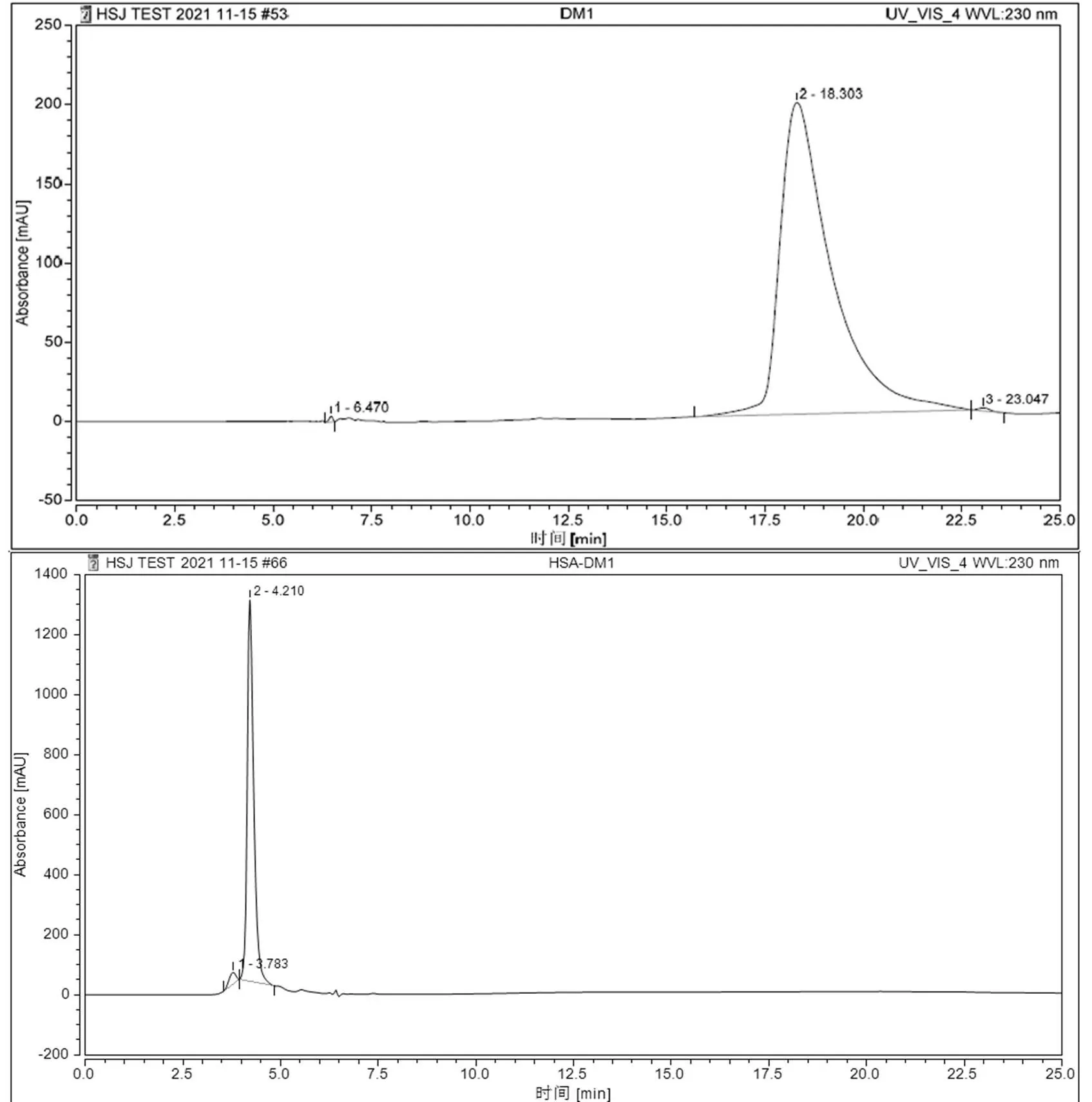
图 3 DM1 与偶联物 HSA-DM1 的色谱图
Figure 3 Chromatogram of DM1 and HSA-DM1 conjugate
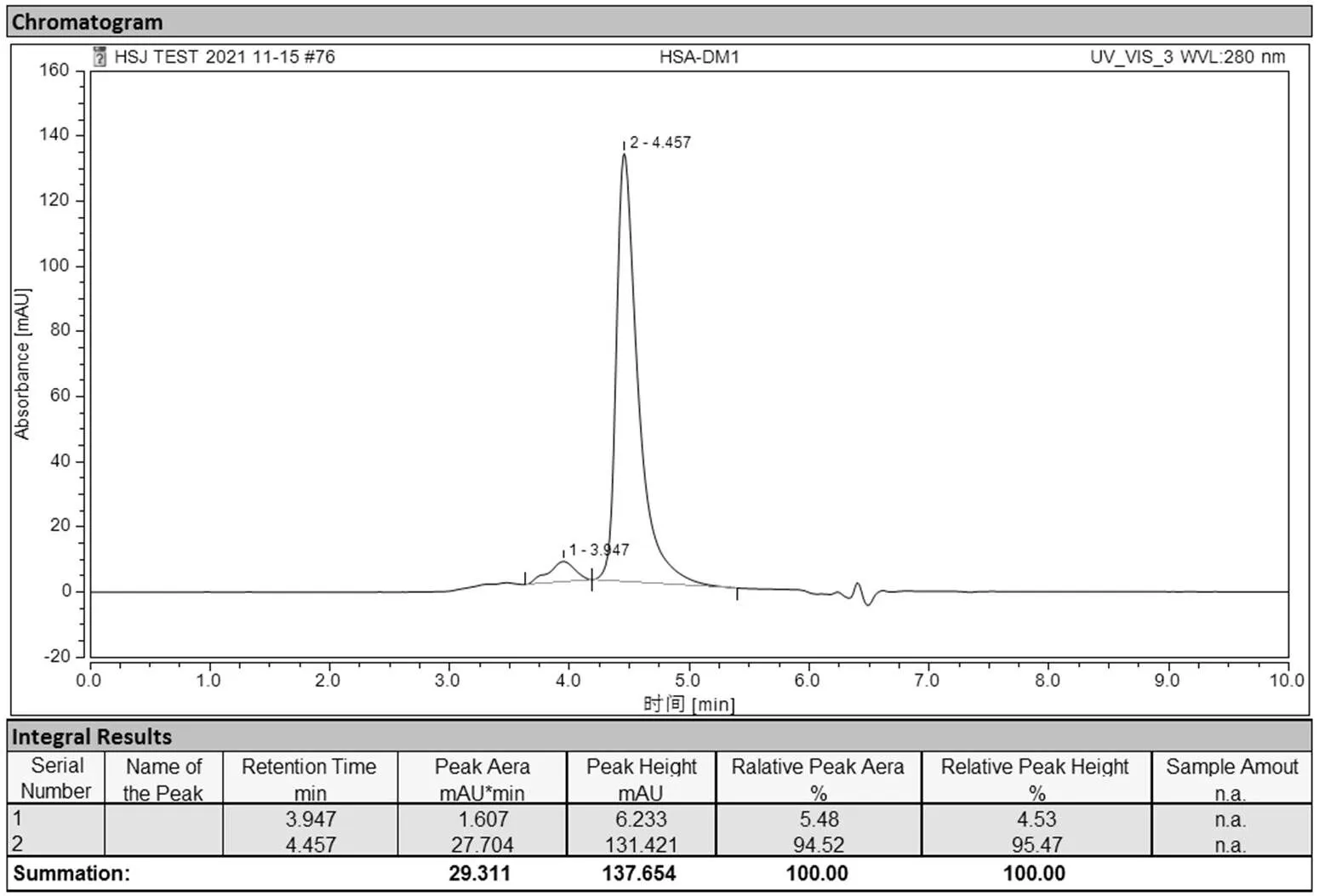
图 4 HSA-DM1 纯度
Figure 4 Purity of HSA-DM1 conjugate
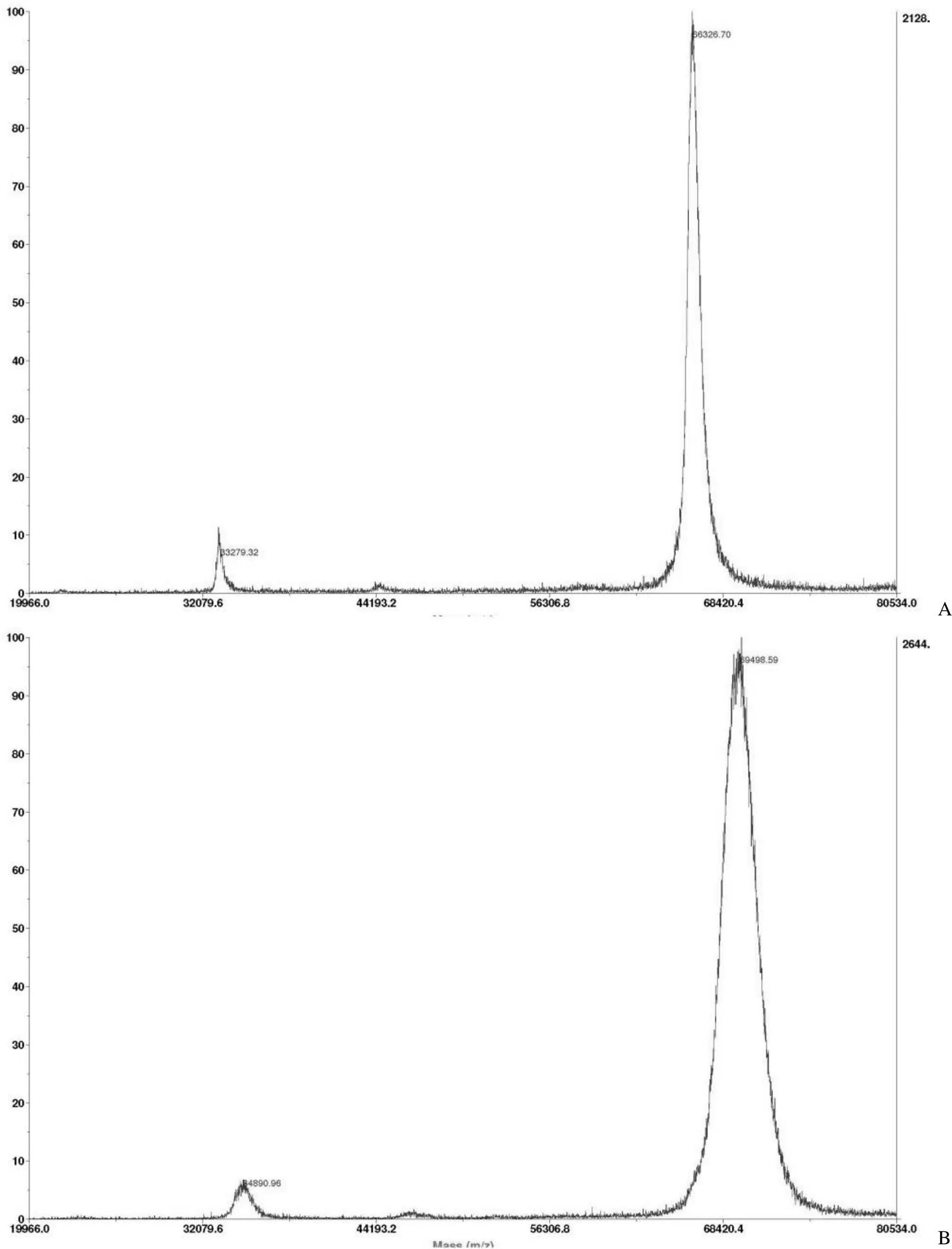
图 5 人血清白蛋白(A)和偶联物 HSA-DM1(B)的分子量
Figure 5 Molecular weight of HSA (A) and HSA-DM1 conjugate (B)
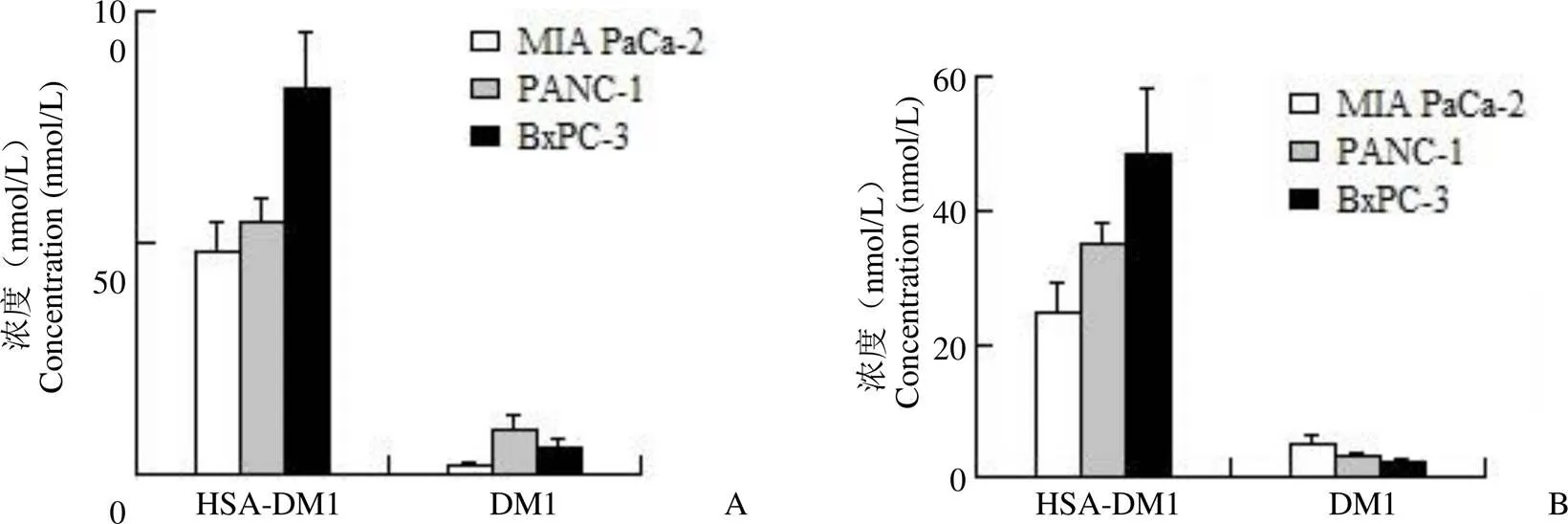
图 6 HSA-DM1 对胰腺癌细胞增殖抑制作用的 IC50值(A:正常培养条件;B:血清饥饿条件)
Figure 6 IC50value of HSA-DM1 on proliferation inhibition of pancreatic cancer cells (A: Normal culture conditions; B: Serum starvation conditions)
2.5 HSA-DM1 可在体外诱导胰腺癌细胞 MIA PaCa-2 和 PANC-1 的凋亡
凋亡实验结果如图 7 所示。在 MIA PaCa-2 和 PANC-1 细胞系中分别检测了对照、HSA-DM1 0.02 μmol/L 和 HSA-DM1 0.2 μmol/L 三组对细胞凋亡的影响,对比对照组,给药组的凋亡率有明显的提高,与给药浓度呈正相关,并随诱导时间的延长而提高。
2.6 HSA-DM1 对胰腺癌细胞 MIA PaCa-2 和 PANC-1 的凋亡信号通路的影响
利用 Western blot 方法检测了凋亡相关蛋白caspase-3、cleaved caspase-3、caspase-9、caspase-7、cleaved caspase-7 及 PARP 在 MIA PaCa-2 和 PANC-1 细胞系中的表达情况,结果如图 8 所示。
在 MIA PaCa-2 细胞系中,HSA 0.2 μmol/L 组蛋白中 caspase-9 与 PARP 蛋白的表达略高于溶剂组,其他测定蛋白的表达均与溶剂组无明显差距;DM1 0.2 μmol/L 组中除了 caspase-7,其他蛋白的表达均高于溶剂组;HSA-DM1 0.02 μmol/L 组和 HSA-DM1 0.2 μmol/L 组中 caspase-3、cleaved caspase-3、caspase-9 与 cleaved caspase-7 的表达明显高于溶剂组,且体现出剂量依赖;HSA 0.2 μmol/L + DM1 0.2 μmol/L 组中所有测定蛋白的表达均高于溶剂组。
在 PANC-1 细胞系中,HSA 0.2 μmol/L 组蛋白中 caspase-9 的表达略高于溶剂组,其余测定蛋白的表达均与溶剂组无明显差距;HSA-DM1 0.2 μmol/L 组、DM1 0.2 μmol/L 组和 HSA 0.2 μmol/L + DM1 0.2 μmol/L 组中 cleaved caspase-3、cleaved caspase-7的表达明显高于溶剂组。
3 讨论
白蛋白会在肿瘤组织富集积累这一现象使得其能够作为抗肿瘤药物的递送载体,但目前对该现象的解释尚无公论。有研究认为这是由于实体瘤组织的高通透性和滞留效应(EPR 效应)造成的被动靶向[18]。正常组织中的微血管内皮间隙致密、结构完整,大分子和脂质颗粒不易透过血管壁,而实体瘤组织中血管丰富、血管壁间隙较宽、结构完整性差、淋巴回流缺失,造成大分子类物质和脂质颗粒具有选择性高通透性和滞留性,促进大分子类物质在肿瘤组织的选择性分布。
同时也有研究认为白蛋白存在主动靶向肿瘤细胞的机制。白蛋白通过转胞吞作用穿过血管内皮,与唾液酸糖蛋白(gp60,一种 60 kD 的血管内皮受体)结合,再与细胞内蛋白 Cav-1 结合,然后该结合物被内化并转运到基底外侧膜以完成转胞吞过程,之后白蛋白与 SPARC 蛋白结合,由 SPARC 介导聚集于肿瘤细胞[19]。
纳米颗粒药物能递送至肿瘤内积累一直被认为是利用 EPR 效应,这是此前开发癌症纳米药物的基础,但该解释目前也受到人们的质疑,在 Sindhwani 等[20]的研究中,他们发现内皮间隙与纳米颗粒转运至实体瘤并无关系,高达 97% 的纳米颗粒是通过内皮细胞的主动转运进入肿瘤。
大获成功的纳米粒白蛋白结合紫杉醇 Abraxane®证明白蛋白纳米颗粒搭载药物的策略可以实现药代动力学的改善以及对肿瘤的靶向聚集,它的开发之初就是基于白蛋白与纳米颗粒的 EPR 效应,但同样有研究表明 Abraxane®并不是通过 EPR 效应进入肿瘤的,而是通过主动转运并且其转运途径与内源性白蛋白不相同。白蛋白纳米颗粒在一定程度上改变了白蛋白的结构,Abraxane®并不通过正常白蛋白的受体 gp60 转运至肿瘤细胞,其转运与变性白蛋白的亲和受体 gp30 的相关性更强[21],因此白蛋白纳米颗粒不能完全发挥出白蛋白的优势。此外,纳米颗粒制剂还存在网状内皮器官(如肝脏和脾脏)的吸收和滞留问题[22],这会导致非肿瘤器官也可能出现白蛋白纳米颗粒的积累,进而造成脱靶毒性。
目前以白蛋白作为递送载体的研究中大多采用前药策略[23-26],以目前处于临床 II 期实验阶段的 INNO-206 为代表,通过功能化接头马来酰亚胺与内源性白蛋白的 Cys34 结合[27],以达到改善药代动力学以及富集于肿瘤部位的目的。该前药在体外的血浆实验中能在 5 min 内选择性地与内源性血清白蛋白结合[27],但目前尚不确定其在体内生理条件下能否达到这种效果。同时除了血清白蛋白以外,淋巴细胞表面同样存在游离的巯基[28],这导致该前药在体内可能会出现脱靶现象。
我们这项工作主要是受到抗体偶联药物(ADC)的启发,利用白蛋白在肿瘤组织和细胞间定向传递的特点,来模拟 ADC 药物的作用机制。ADC 通过连接子将抗体与药物载荷连接,在进入体内后抗体与抗原特异性结合,将药物载荷靶向递送至肿瘤细胞,在细胞中药物载荷被释放,进而杀伤肿瘤细胞。虽然 ADC 目前在抗肿瘤领域非常成功,但其也存在一些问题。
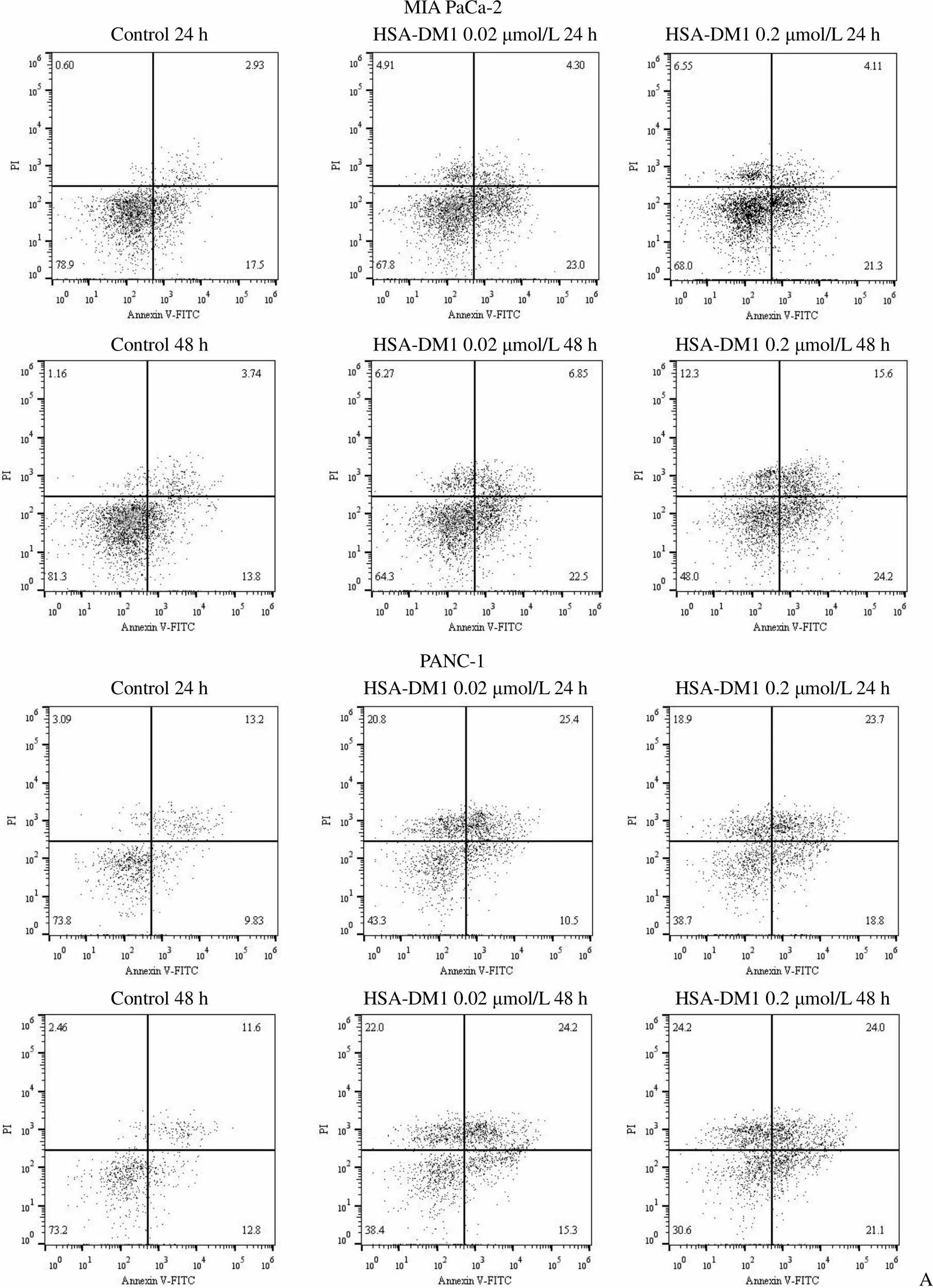
MIA PaCa-2 Control 24 h HSA-DM1 0.02 μmol/L 24 h HSA-DM1 0.2 μmol/L 24 h Control 48 h HSA-DM1 0.02 μmol/L 48 h HSA-DM1 0.2 μmol/L 48 h PANC-1 Control 24 h HSA-DM1 0.02 μmol/L 24 h HSA-DM1 0.2 μmol/L 24 h Control 48 h HSA-DM1 0.02 μmol/L 48 h HSA-DM1 0.2 μmol/L 48 h A
Figure 7 HSA-DM1 induces apoptosis of MIA PaCa-2 and PANC-1 pancreatic cancer cells (A: Flow cytometry scatter plots; B: Apoptosis rate)
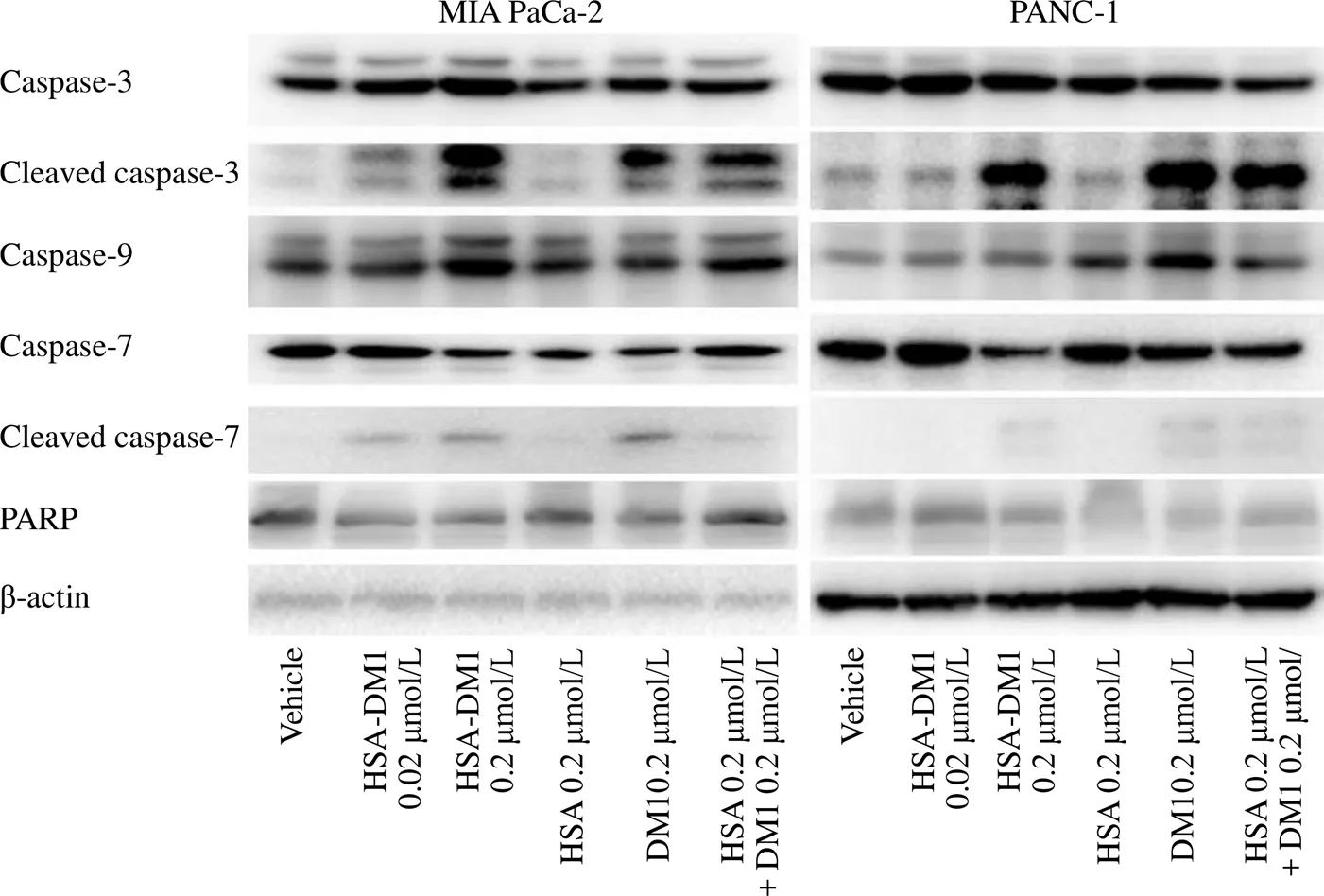
图 8 Western blot 法检测 HSA-DM1 对胰腺癌细胞 MIA PaCa-2 和 PANC-1 的凋亡信号通路的影响
Figure 8 The effect of HSA-DM1 on the apoptosis signaling pathway of MIA PaCa-2 and PANC-1 cells was detected by Western blot
ADC 与单克隆抗体一样存在“结合位点屏障”问题[29-30],虽然 ADC 与肿瘤血管周围的靶抗原紧密结合,却不能穿透整个肿瘤。针对该问题,Cilliers 等[31]给出了一种改善方法,将曲妥珠单抗和 T-DM1 共同给药能够提高渗透性,该方法虽然减少了有效载荷的数量,却能提高疗效。ADC 同样面临着耐药问题,肿瘤细胞中靶抗原较正常细胞的更高表达是其安全性与有效性的必要条件,目前 T-DM1 存在的多种耐药细胞系中[32],部分肿瘤细胞的 HER2 呈现低表达水平造成曲妥珠单抗与细胞的结合率下降[33],进而导致治疗失败。
我们希望借用 ADC 思路开发的白蛋白-偶联物能拥有类似 ADC 靶向肿瘤细胞的能力,同时具备良好的肿瘤部位的渗透性且不需要依赖特定的抗体与抗原结合作用。
在这项工作中我们选择不可裂解型连接子 SMCC 将 DM1 与白蛋白偶联,主要是因为其在循环系统中具有良好的稳定性,只有在偶联物被溶酶体降解时才会释放效应分子赖氨酸-SMCC-DM1,能最大程度地避免效应分子提前释放的情况并发挥白蛋白较长体内半衰期的优势。有研究表明,采用赖氨酸残基偶联策略制备的 ADC 样品,其抗体药物偶联比控制在 3 ~ 4 之间比较合理[17],过低的偶联比会导致效力不足,但过高的偶联比会导致溶解性变差并产生系统性毒副作用,Kadcyla®就将平均偶联比控制为 3.5[34]。基于以上经验,我们将偶联物 HSA-DM1 的平均偶联比控制在 3.32。
通常制备白蛋白偶联物会选择采用与白蛋白上的 Cys34 进行连接,因为白蛋白上仅有一个游离的硫醇基团,这样制得的偶联物能够保证同质均一性,但缺点是无法通过增加效应分子来增强偶联物的抗肿瘤活性。若要增加白蛋白游离硫醇基团数目,就必须还原白蛋白结构内部的其他二硫键,但二硫键对保持白蛋白的结构完整性至关重要,这样制得的偶联物破坏了二级结构,其活性反而不如只连接一个效应分子的偶联物[35]。
白蛋白中的赖氨酸残基较半胱氨酸更为丰富,且通常位于蛋白质表面,为此选择偶联赖氨酸残基的策略可以通过连接复数的效应分子以得到活性更高的白蛋白偶联物。对比Liu 等[35]的研究,偶联物 HSA-DM1 的体外的细胞活性实验结果也证实了我们的假设。
我们用 CCK-8 法测定了偶联物体外抗胰腺癌细胞活性,在 MIA PaCa-2、PANC-1 与BxPC-3 三种细胞系中,HSA-DM1 均表现出了良好的增殖抑制作用,IC50值均在纳摩尔水平。Liu 等[35]通过偶联白蛋白上的 Cys34 制备了 MMAE(甲基澳瑞他汀 E,一种微管蛋白抑制剂)与白蛋白的单效应分子偶联物 ALDC1,并测定了体外活性。MMAE对 MIA PaCa-2 与 PANC-1 细胞系的 IC50值分别为 0.5 nmol/L 与 0.21 nmol/L,较我们测定的游离 DM1 的活性更高,但其偶联物 ALDC1 对两个细胞系的 IC50值均为微摩尔水平,较我们制备的偶联物 HSA-DM1 的活性有一定的差距。
在测定的三种细胞系中,游离药物 DM1 的 IC50均比偶联物 HSA-DM1 低,这种活性的差异可能是由 DM1 与 HSA-DM1 不同的内化途径导致的。DM1 是一种亲脂性小分子(logP ~ 2.77,计算值),因此在体外可以通过自由扩散和渗透穿过细胞膜进入细胞内,而在 DM1 与人血清白蛋白偶联后,HSA-DM1 只能通过内吞作用内化到细胞中,且其降解后的效应形态赖氨酸-SMCC-DM1 同样无法自由扩散,不能通过旁观者效应杀伤周围肿瘤细胞[36]。
对比游离药物 DM1 和偶联物 HSA-DM1 对三种细胞系的增殖抑制作用,可以看出游离药物 DM1 对三种细胞系的增殖抑制作用无选择性差别,而偶联物 HSA-DM1 在两种条件下对三种细胞系的增殖抑制作用强弱体现出一致的趋势。对比 BxPC-3 细胞系,偶联物 HSA-DM1 对 MIA PaCa-2、PANC-1 细胞系的增殖抑制作用有一定的提高。
三种细胞系中,MIA PaCa-2、PANC-1 细胞系为突变型的胰腺癌细胞,BxPC-3 则为野生型。s 突变会增强癌细胞的巨胞饮作用,增加对白蛋白的吞噬,但实验结果并没有明显差距。我们推测这可能是由于体外实验条件与体内条件存在差异,在正常培养基条件下,由于培养基中带有细胞生长所需的各种氨基酸,在营养充足的条件下癌细胞可能会减弱或不需要通过巨胞饮吞噬白蛋白来补充自身生长所需的氨基酸与营养。
综上所述,本研究利用不可裂解型连接子 SMCC 将微管蛋白抑制剂 DM1 与白蛋白赖氨酸残基偶联,在保持白蛋白自身结构的同时最大程度地避免脱靶毒性并通过连接多个效应分子以提高活性,结果表明偶联物 HSA-DM1 具有显著的抑制胰腺癌细胞增殖活性,该偶联策略值得进一步深入研究,为靶向抗肿瘤药物的研发提供了思路。
[1] Kleeff J, Korc M, Apte M, et al. Pancreatic cancer. Nat Rev Dis Primers, 2016, 2:16022.
[2] Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA CancerJ Clin, 2017, 67(1):7-30.
[3] Barbacid M. Ras genes. Annu Rev Biochem, 1987, 56:779-827.
[4] Neoptolemos JP, Kleeff J, Michl P, et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nat Rev Gastroenterol Hepatol, 2018, 15(6):333-348.
[5] Commisso C, Davidson SM, Soydaner-Azeloglu RG, et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature, 2013, 497(7451):633-637.
[6] Kratz F. Albumin as a drug carrier: design of prodrugs, drug conjugates and nanoparticles. J Control Release, 2008, 132(3):171- 183.
[7] Matos MJ. Learning from nature: the role of albumin in drug delivery. Future Med Chem, 2018, 10(9):983-985.
[8] Merlot AM, Kalinowski DS, Richardson DR. Unraveling the mysteries of serum albumin-more than just a serum protein. Front Physiol, 2014, 5:299.
[9] Gradishar WJ, Tjulandin S, Davidson N, et al. Phase III trial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer. J Clin Oncol, 2005, 23(31):7794-7803.
[10] Socinski MA, Bondarenko I, Karaseva NA, et al. Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase III trial.J Clin Oncol, 2012, 30(17):2055-2062.
[11] Iwamoto T. Clinical application of drug delivery systems in cancer chemotherapy: review of the efficacy and side effects of approved drugs. Biol Pharm Bull, 2013, 36(5):715-718.
[12] Ribeiro AG, Alves JEF, Soares JCS, et al. Albumin roles in developing anticancer compounds. Med Chem Res, 2021, 30(8):1469-1495.
[13] Sleep D, Cameron J, Evans LR. Albumin as a versatile platform for drug half-life extension. Biochim Biophys Acta, 2013, 1830(12):5526- 5534.
[14] AlQahtani AD, O'Connor D, Domling A, et al. Strategies for the production of long-acting therapeutics and efficient drug delivery for cancer treatment. Biomed Pharmacother, 2019, 113:108750.
[15] Widdison WC, Wilhelm SD, Cavanagh EE, et al. Semisynthetic maytansine analogues for the targeted treatment of cancer. J Med Chem, 2006, 49(14):4392-4408.
[16] Issell BF, Crooke ST. Maytansine. Cancer Treat Rev, 1978, 5(4): 199-207.
[17] Sun X, Ponte JF, Yoder NC, et al. Effects of drug-antibody ratio on pharmacokinetics, biodistribution, efficacy, and tolerability of antibody-maytansinoid conjugates. Bioconjug Chem, 2017, 28(5): 1371-1381.
[18] Maeda H, Wu J, Sawa T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review. J Control Release, 2000, 65(1-2):271-284.
[19] Spada A, Emami J, Tuszynski JA, et al. The uniqueness of albumin as a carrier in nanodrug delivery. Mol Pharm, 2021, 18(5):1862-1894.
[20] Sindhwani S, Syed AM, Ngai J, et al. The entry of nanoparticles into solid tumours. Nat Mater, 2020, 19(5):566-575.
[21] Hama M, Ishima Y, Chuang VTG, et al. Evidence for delivery of abraxane via a denatured-albumin transport system. ACS Appl Mater Interfaces, 2021, 13(17):19736-19744.
[22] Nie S. Understanding and overcoming major barriers in cancer nanomedicine. Nanomedicine (Lond), 2010, 5(4):523-528.
[23] Zhang W, Song S, Wang H, et al. In vivo irreversible albumin-binding near-infrared dye conjugate as a naked-eye and fluorescence dual-mode imaging agent for lymph node tumor metastasis diagnosis. Biomaterials, 2019, 217:119279.
[24] Kwak G, Kim H, Park J, et al. A trojan-horse strategy by in situpiggybacking onto endogenous albumin for tumor-specific neutralization of oncogenic microRNA. Acs Nano, 2021, 15(7):11369- 11384.
[25] Châtre R, Lange J, Péraudeau E, et al. In vivo synthesis of triple-loaded albumin conjugate for efficient targeted cancer chemotherapy. J Control Release, 2020, 327:19-25.
[26] Zhang H, Wang K, Na K, et al. Striking a balance between carbonate/carbamate linkage bond- and reduction-sensitive disulfide bond-bearing linker for tailored controlled release: In situ covalent-albumin-binding gemcitabine prodrugs promote bioavailability and tumor accumulation. J Med Chem, 2018, 61(11):4904-4917.
[27] Kratz F, Müller-Driver R, Hofmann I, et al. A novel macromolecular prodrug concept exploiting endogenous serum albumin as a drug carrier for cancer chemotherapy. J Med Chem, 2000, 43(7):1253- 1256.
[28] Sahaf B, Heydari K, Herzenberg LA, et al. Lymphocyte surface thiol levels. Proc Natl Acad Sci U S A, 2003, 100(7):4001-4005.
[29] Rhoden JJ, Wittrup KD. Dose dependence of intratumoral perivascular distribution of monoclonal antibodies. J Pharm Sci, 2012, 101(2):860- 867.
[30] Lucas AT, Robinson R, Schorzman AN, et al. Pharmacologic considerations in the disposition of antibodies and antibody-drug
conjugates in preclinical models and in patients. Antibodies (Basel), 2019, 8(1):3.
[31] Cilliers C, Menezes B, Nessler I, et al. Improved tumor penetration and single-cell targeting of antibody-drug conjugates increases anticancer efficacy and host survival. Cancer Res, 2018, 78(3):758- 768.
[32] Hunter FW, Barker HR, Lipert B, et al. Mechanisms of resistance to trastuzumab emtansine (T-DM1) in HER2-positive breast cancer. Br J Cancer, 2020, 122(5):603-612.
[33] Li G, Guo J, Shen BQ, et al. Mechanisms of acquired resistance to trastuzumab emtansine in breast cancer cells. Mol Cancer Ther, 2018, 17(7):1441-1453.
[34] Kim MT, Chen Y, Marhoul J, et al. Statistical modeling of the drug load distribution on trastuzumab emtansine (Kadcyla), a lysine-linked antibody drug conjugate. Bioconjug Chem, 2014, 25(7):1223-1232.
[35] Liu X, Mohanty RP, Maier EY, et al. Controlled loading of albumin-drug conjugates ex vivo for enhanced drug delivery and antitumor efficacy. J Control Release, 2020, 328:1-12.
[36] Ogitani Y, Hagihara K, Oitate M, et al. Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer Sci, 2016, 107(7):1039-1046.
Preparation andanti-pancreatic cancer activity study of albumin-maytansine conjugate
HU Shang-jiu, WANG Ying, ZHANG Guo-ning, ZHU Mei, WANG Ming-hua, WANG Ju-xian
Author Affiliation: Organic Synthesis Chamber, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China
To prepare human serum albumin (HSA)-mertansine derivative (DM1) conjugate and evaluate its anti-pancreatic cancer cells activity.Maytansine derivative DM1 was synthesized by reduction and esterification reaction from ansamitocin. The linker SMCC was synthesized by reaction of N-hydroxysuccinimide and maleic anhydride. HSA-DM1 was prepared by coupling DM1 with human serum albumin through the linker SMCC. HPLC and MALDI-TOF were used to characterize and calculate the average coupling ratio. CCK-8 method was used to detect the inhibitory effect of the conjugate on the proliferation of three pancreatic cancer cell lines: MIA PaCa-2, PANC-1 and BxPC-3. Flow cytometry and Western blot were used to detect its proapoptotic effect on MIA PaCa -2 and PANC-1 cells.Successful preparation of HSA-DM1 conjugate and it’s average coupling ratio was 3.32. The IC50values of HSA-DM1 were (48.2 ± 6.5), (55.0 ± 4.7) and (84.0 ± 11.8) nmol/L for MIA PaCa-2, PANC-1 and BxPC-3 cell lines, respectively. And the proapoptotic effect on MIA PaCa-2 and PANC-1 cells was dose-dependent.The conjugated compound HSA-DM1 has significant inhibitory activity on the proliferation of pancreatic cancer cells and has potential clinical application prospect.
human serum albumin; maytansine derivative; conjugate; pancreatic cancer
WANG Ju-xian, Email: wangjuxian@imb.pumc.edu.cn
10.3969/j.issn.1673-713X.2022.05.002
中国医学科学院医学与健康科技创新工程(2021-I2M- 1-026)
王菊仙,Email:wangjuxian@imb.pumc.edu.cn
2022-04-01
