气相色谱法测定大白菜中百菌清农药残留的不确定度评定
2022-10-13王联广伍湘竹周树娅季青梅石安宪
王联广,伍湘竹,周树娅,季青梅,马 鹏,石安宪
(昭通市绿色食品发展中心,云南昭通 657000)
不确定度为测量不确定度的简称。1927年,德国物理学家维纳海森堡提出了测量的不确定性概念,表示测量结果的分散程度,亦是分析结果准确性的可疑程度,习惯俗称测量的“不可靠程度”,用于表达分析测量结果优劣的一种方式,通常在测量结果完整表达中包括测量不确定度,检验检测机构通用要求规定检验检测出现检测临界值时也要给出不确定度[1]。不确定度分为标准不确定度和扩展不确定度两大类。标准不确定度分为A类、B类标准不确定度。A类是用统计分析方法计算,B类是以估计的标准偏差表示,合成标准不确定度即为各类A、B类标准不确定度的合成。扩展不确定度为总不确定度,是合成标准不确定度与置信因子k的倍数,置信因子k与概率发布关系为正态分布,k=2~3。其中,置信概率P=95.45%时,k=2;P=99.73%时,k=3;三角分布,平均分布,等。
百菌清作为一种广谱、保护性杀菌剂,被广泛应用于蔬菜、水果真菌侵染的防治。昭通大白菜是当地的经济特色产业,但其霜霉病的发生严重影响其产量和质量。百菌清对大白菜霜霉病的防治有重要的作用,不仅可促进农民增收,还可为昭通产业发展提供指导。但百菌清农药的不合理使用或过量使用,使得大白菜中残留增大。为测量其在大白菜中的含量的测量不确定度,对有效监管大白菜中百菌清残留提供更加可靠的结果。本实验参考NY/T 761—2008[2]标准方法,在大白菜样品中加入一定量的百菌清标准液,通过提取、净化和使用气相色谱测定以及建立不确定度测量模型,计算其不确定度值。
1 材料与方法
1.1 材料与试剂
大白菜,购买于当地;百菌清(1 000 mg·L-1),农业农村部环境保护科研监测所(天津);正己烷、二氯甲烷(色谱纯),赛默飞世尔科技(中国)科技有限公司;弗罗里矽柱(1 g/6 mL),天津博纳艾杰尔科技有限公司;乙腈(分析纯),国药集团化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
安捷伦7890B气相色谱仪配uECD检测器,美国安捷伦公司;旋转蒸发RE-2000B,上海亚荣生化仪器厂;电子天平DT-500B,常熟市金羊砝码仪器有限公司;匀浆机IKA T18,艾卡有限公司;固相萃取装QSE-240011,得泰仪器科技有限公司;MFV-36智能氮吹仪,得泰仪器科技有限公司。
1.3 实验方法
1.3.1 样品前处理
准确称取15.0 g大白菜均质样品,添加0.2 mg·kg-1百菌清,摇匀静止30 min,加入30.0 mL乙腈,均质2 min,过滤到4~5 g NaCl的100 mL具塞量筒中,振荡摇匀,静置30 min,量取10.00 mL上清液于150 mL旋转蒸发小瓶中,在40 ℃旋转蒸发至进干后,加入2 mL正己烷,用弗罗里矽柱净化待测。
1.3.2 色谱条件
色谱柱:DB-5石英毛细管柱(30 m×0.32 mm×0.25 μm);载气:氮气(99.999%),恒流;流量:3.0 mL·min-1;进样口温度:220 ℃;检测器温度:300 ℃;柱温:初温150 ℃保持2 min,以8 ℃·min-1升至260 ℃,保持7.25 min;进样方式:不分流进样。
1.3.3 校准标准曲线溶液配制
用正己烷稀释1 000 mg·L-1的百菌清配制成100 mg·L-1的标准储备液,继续稀释成10 mg·L的标准工作液,再用正己烷溶液配制成0.01 mg·L-1、0.05 mg·L-1、0.10 mg·L-1、0.50 mg·L-1和1.00 mg·L-1的系列百菌清校准标准溶液。
2 结果与分析
2.1 测量不确定度主要来源
测定大白菜中百菌清农药残留不确定度主要来源于样品的称量、试剂的体积受环境温度变化、量筒和移液管自带的误差、标准物质不确定度和仪器重复测定的随机误差等。
2.2 建立测量不确定度数学模型
样品中被测农药残留量以质量分数ω计,单位以mg·kg-1表示,公式为

式中:ρ为标准溶液中农药的质量浓度,mg·L-1;A为样品溶液中被测农药的峰面积;AS为农药标准溶液中被测农药的峰面积;V1为提取溶剂总体积,mL;V2为吸取出用于检测的提取溶液的体积,mL;V3为样品定容体积,mL;m为样品的质量,g。
2.3 测量不确定度评定
2.3.1 天平称量引入的不确定度
该天平在0~50 g称量范围的最大允许误差MPE=±0.05 g[3],其允许误差的半峰宽为0.05,按均匀分布计算,称量15.0 g样品引入的B类相对标准不确定度urel(a)=MPE/(k×15.0)=0.192 5%。
2.3.2 标准物质引入的相对标准不确定度
标准物质引入的不确定度urel(b)为标准物质证书给定的扩展不确定度以及样品中加入标准物质引入的不确定度。
(1)标准物质纯度引入的相对不确定度urel(b1)。标准物质证书给出的百菌清浓度为1 000 mg·L-1,则标准物质百菌清的扩展不确定度U(b)=1.20 mg·L-1,k=2,则B类相对标准不确定度urel(b1)=U(b)/(k×1 000)=0.060 0%。
(2)标准物质加入样品中引入的不确定度urel(b2)。加入标准物质引入的B类相对不确定度urel(b2)为稀释1 000 mg·L-1百菌清标准溶液配制成100 mg·L-1标准储备液,继续稀释成10 mg·L-1标准工作液,再移取0.3 mL工作液到样品过程中引入的不确定度。
实验室温差变化为(20±5) ℃,正己烷的膨胀系数为1.26×10-3mL·℃-1,按均匀分布计算,3次使用1 mL移液管移取1 mL百菌清标准溶液,2次用正己烷定容于10 mL容量瓶,按均匀分布计算,引入的B类相对标准不确定度urel(b2-1)为
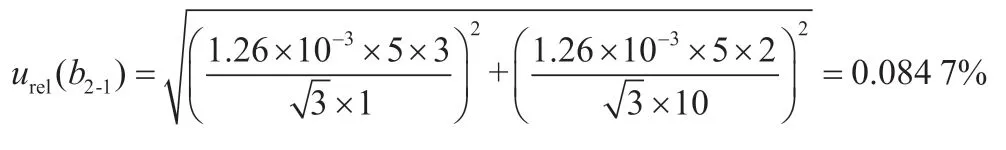
使用1 mL A级移液管移取3次标准溶液,根据《常用玻璃量具检定规程》(JJG 196—2006)规定,1 mL A级移液管的最大允许误差MPE=±0.007 mL,按三角分布计算[4],其引入的B类相对标准不确定度urel(b2-2)=MPE×3/(k×1)=0.857 4%。
使用10 mL A 级容量瓶定容标准溶液2次,根据《常用玻璃量具检定规程》(JJG 196—2006)规定,10 mL A级容量瓶的最大允许误差MPE=±0.02 mL,按三角分布计算,其允许误差引入的B类相对标准不确定度urel(b2-3)=MPE×2/(k×10)=1.633 0%。
加入标准物质引入的B类相对合成不确定度urel(b2)为
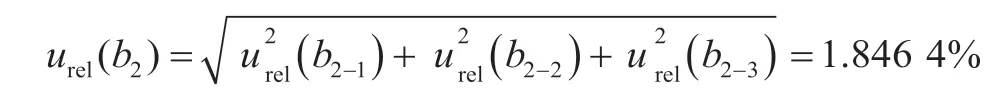
(3)标准物质引入的不确定度urel(b)。标准物质引入的B类相对标准不确定度为
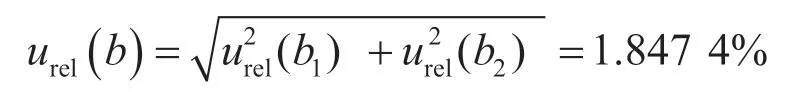
2.3.3 量取乙腈引入的不确定度
使用100 mL量筒取30.0 mL乙腈引入的B类相对不确定度urel(c)为量筒的允许误差、乙腈体积受实验室温度变化和重复移取乙腈引入。
100 mL量筒量取30 mL乙腈,按《常用玻璃量器检定规程》(JJG 196—2006)规定,100 mL的最大允许误差MPE=±1 mL,按均匀分布计算,则允许误差引入的B类相对标准不确定度urel(c1)=MPE/(k×30.0)=1.924 5%。实验室温差变化为(20±5) ℃,乙腈的体积膨胀系数为1.37×10-3mL·℃-1,按均匀分布计算,则由乙腈受温度变化引入的B类相对标准不确定度urel(c2)为
重复6次移取乙腈的体积分别为38.081 3 mL、30.052 8 mL、30.142 0 mL、30.032 3 mL、30.075 7 mL和30.055 6 mL,标准偏差为0.019 0 mL,则重复移取乙腈引入的A类相对标准不确定度urel(c3)为
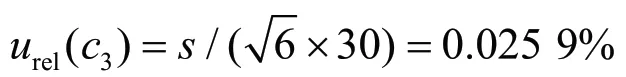
2.3.4 移取提取液引入的不确定度
量取10.00 mL提取试液于150 mL鸡心瓶中引入的B类相对标准不确定度urel(d)为乙腈体积受实验室温差变化以及10 mL A级移液管允许误差引入的不确定度。
(1)温度变化引入的不确定度。实验室温差变化为(20±5) ℃,乙腈的体积膨胀系数为1.37×10-3mL·℃-1,按均匀分布算,则由乙腈体积受温度变化引入的B类相对标准不确定度urel(d1)为

(2)移液管引入的不确定度。使用10 mL A级移液管量取10 mL提取液,根据《常用玻璃量具检定规程》(JJG 196—2006)规定,10 mL A级移液管的最大允许误差MPE=±0.05 mL,按三角分布计算,其B类相对标准不确定度urel(d2)为

(3)移取10.00 mL提取液引入的B类相对合成标准不确定度urel(d)为

2.3.5 定容引入的不确定度
用15 mL离心管收集经过弗罗里硅土小柱萃取后的试液,氮吹蒸发至小于5 mL,用正己烷定容至5.0 mL,定容引入的B类相对标准不确定度urel(e)为离心管允许误差和正己烷体积受实验室温度变化引入的不确定度。
(1)使用15 mL刻度离心管定容5 mL测试液,按《专用玻璃量器检定规程》(JJG 10—2005)规定,15 mL刻度离心管的最大允许误差MPE=±0.2 mL,按三角分布计算,定容到5 mL,其刻度离心管引入的B类相对标准不确定度urel(e1)为
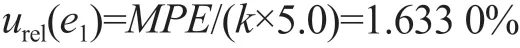
(2)实验室温度变化为(20±5)℃,正己烷的膨胀系数为1.26×10-3mL·℃-1,按均匀分布计算用正己烷定容到5.0 mL,其体积受温度变化引入的B类相对标准不确定度urel(e2)为
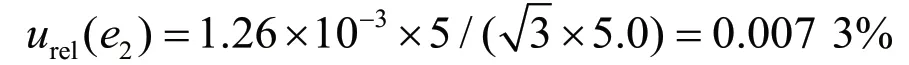
(3)定容引入的B类相对标准合成不确定度urel(e)为
2.3.6 标准曲线引入的不确定度urel(f)
用正己烷稀释1 000 mg·L-1的百菌清,配制成10 mg·L-1的标准储备液,再用正己烷溶液配制成0.01 mg·L-1、0.05 mg·L-1、0.10 mg·L-1、0.50 mg·L-1和1.00 mg·L-1的系列百菌清标准溶液,每个浓度3次平行进样的峰面积为1.491 9×103Hz、1.464 3×103Hz、1.490 0×103Hz;7.414 4×103Hz、7.533 3×103Hz、7.616 8×103Hz;1.460 3×104Hz、1.460 7×104Hz、1.469 3×104Hz;7.526 1×104Hz、7.581 1×104Hz、7.649 4×104Hz;1.435 5×105Hz、1.445 6×105Hz以及1.429 8×105Hz,拟合线性回归方程为y=1.443 8×105x+7.142 1×102,相 关 系 数R=0.999 6,使 用 其拟 合 曲 线 校 准 加 标 浓 度 为C—=0.187 4mg·kg-1,标准曲线引入的B类相对标准不确度按计算。其中,a为校准曲线斜率;SR为残余标准差,b为校准曲线截距;j为获得工作曲线的测量次数;C0为被测量的浓度;C—为不同工作曲线溶液浓度的平均值(n次测试),,i为 第 几 个 工作曲线溶液;n为工作曲线的校准点测量次数,如工作曲线有5个校准点,每点测量3次,则n=15;p为被测样品的测量次数,如某样品重复测量6次,p=6。
则拟合标准曲线校准引入的B类相对标准不确定度urel(f)为

2.3.7 样品重复测定引入不确定度urel(g)
样品平行测定6次的结果为0.196 2 mg·kg-1、0.195 3 mg·kg-1、0.195 6 mg·kg-1、0.175 9 mg·kg-1、0.178 0 mg·kg-1和0.183 2 mg·kg-1,6次测定平均值为0.187 4 mg·kg-1,相对标准偏差s=0.009 5 mg·kg-1,平均回收率为93.70%,符合GB/T 27404—2008[6]要求,则样品平行测定引入A类相对标准不确定度urel(g)[5]为
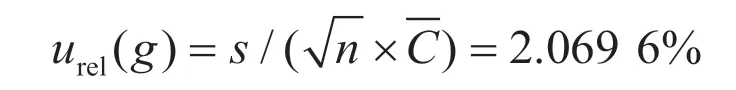
2.3.8 测定百菌清的合成不确定度u(ω)和扩展不确定度U(ω)
(1)大白菜中百菌清农药残留测定相对合成不确定度urel(ω)。测定大白菜中百菌清浓度为C—=0.187 4 mg·kg-1,测定百菌清引入的相对合成不确定度为

(2)大白菜中百菌清农药残留测定合成不确定度u(ω)为
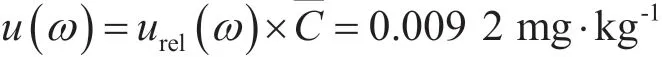
(3)大白菜中百菌清农药残留测定扩展不确定度U(ω)。扩展不确定度取置信区间为95%,置信因子k=2,则扩展不确定度U(ω)为
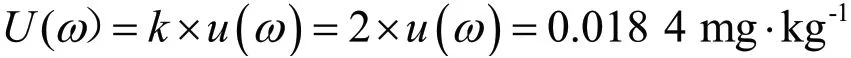
2.4 测定结果的表示
大白菜中百菌清农药残留ω表示为
3 结论
本实验参考标准NY/T 761—2008,在大白菜样品加入一定量的百菌清标准液,通过乙腈溶剂提取、弗罗里矽柱净化、气相色谱的测定,建立了不确定度测量模型。实验结果表明,称量引入相对不确定度0.199 2%、标准物质引入相对不确定度1.846 4%、移取试液引入相对不确定度2.134 6%、定容引入相对不确定度1.633 0%、标准曲线拟合引入相对不确定度3.154 6%、平行测定样品引入相对不确定度2.069 6%,最后评定总的扩展不确定度为0.018 4 mg·kg-1,测量结果表示为(0.187 4±0.018 4) mg·kg-1,k=2。结果表明,检测过程步骤必须按操作规程进行,同时提升检测人员的检测能力才可减少测定带来的不确定度,以保证检测结果的准确度和可靠性。
