气相色谱-串联质谱法测定小麦籽粒中多效唑残留量
2022-10-13侯晓慧田继锋宋国华薛科宇
侯晓慧,魏 珂,田继锋,宋国华,薛科宇
(许昌市农产品质量安全检测检验中心,许昌市农产品质量安全检测与风险评价重点实验室,河南许昌 461000)
多效唑是一种植物生产调节剂,20世纪80年代引入我国,其能够抑制植物内源赤霉素的合成,达到延缓生长、抑制茎秆伸长、缩短植株节间、促进花芽分化的作用,具有增加植物抗逆性能,提高产量等效果,在小麦、水稻、花生、大豆和果树等作物上具有广泛的应用[1-3]。
小麦作为我国主要的粮食作物之一,在农业生产中占有非常重要的地位。数年来,我国农业科技人员依靠科学技术、采取多种措施,不断提高小麦产量,保证粮食安全。农药的使用是其中的主要措施之一。作为一种被广泛使用的低毒高效农药,许多农业科技人员研究多效唑对小麦生长、产量的影响,以期达到提高产量的目的[4-6]。随着多效唑用量的增加,其残留量也在不断增加。特别是多效唑的理化性质相对稳定,降解缓慢,在土壤中的吸附率较高,大部分残留在土壤中,且在表层土壤中的残留量大于深层土壤[3]。植物根系在吸收土壤中营养的同时,也会吸收土壤中的多效唑残留,随着植物的生理活动进而转移至植株的各部位,再通过饮食或食物链的富集进入人体,对人们的生活和健康造成安全隐患。
目前,通用的农药残留的分析方法主要有色谱法、质谱法、酶抑制法等;样品前处理技术主要有固相萃取法、液液萃取法等[7-10]。QuEChERS法作为一种新颖、快速的分散固相萃取技术,因其快速、简单、高效、安全的特点而迅速推广开来。然而,对于复杂基质样品,QuEChERS法中常用的分散剂、净化剂不能满足检测需求。
碳纳米管具有独特力学、化学性能,被逐渐应用于食品、医药、环境等领域中[11-12]。在农药残留方面的研究多集中在果蔬、茶叶中农药残留的检测,在小麦农药残流检测方面的研究还较少。本研究基于碳纳米管的独特性能,对QuEChERS法进行改进,建立了一种检测小麦籽粒中多效唑残留的气相色谱-质谱检测方法。该检测方法具有操作简单、分析准确、灵敏度高、回收率好和精密度稳定的特点,符合检测分析要求,可用于小麦籽粒中多效唑残留的检测。
1 材料与方法
1.1 材料与设备
多效唑标准溶液(1 000 μg·mL-1,农业农村部环境保护科研监测所);环氧七氯B内标(100 μg·mL-1,农业农村部环境保护科研监测所);QuEChERS试剂包(6 g硫酸镁、1.5 g醋酸钠,北京绿绵科技有限公司);多壁碳纳米管(外径20 ~30 nm,内径5~10 nm,长度0.5~2.0 μm,纯度>95%,南京先丰纳米材料科技有限公司);乙腈、丙酮(色谱纯,美国飞世尔科技有限公司公司);醋酸(分析纯,美国飞世尔科技有限公司);0.22 μm微孔滤膜(天津市津腾实验设备公司)。
SCION TQ气相色谱质谱联用仪(德国布鲁克公司);SK5200H型超声波清洗器(上海科导超声波仪器有限公司);TTL-DCII型氮吹仪(北京同泰联科技发展有限公司);TUBE MILL C S025型粉碎机(德国艾卡公司);L-530离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 实验条件
1.2.1 标准溶液配制
准确移取多效唑标准溶液0.8 mL至容量瓶中,用丙酮定容至5 mL,配制成标准储备液;内标物取0.8 mL至容量瓶中,配制成16.00 μg·mL-1的标准储备液;随后,分别转移到棕色瓶中,-20 ℃避光保存。此外,用空白基质溶液配制标准工作溶液,配制相应浓度的标准溶液,加入10 μL内标溶液,标准溶液现用现配。
1.2.2 样品制备
实验用小麦来自于本地生产。取小麦样品500 g粉碎,过孔径0.425 mm的筛子,放入聚乙烯袋中备用。
1.2.3 样品前处理
准确称取小麦试样5.00 g于50 mL塑料离心管中,加10 mL水涡旋振荡混匀,静置30 min。在离心管中加入15 mL乙腈-醋酸溶液(体积比99∶1),加入QuEChERS试剂包,盖上离心管盖子,迅速剧烈振荡1 min,随后,以4 200 r·min-1的速度离心5 min;净化管中加入1.5 g无水硫酸镁和5 mg多壁碳纳米管,取离心后的上清液10 mL于净化管中,剧烈振荡1 min混匀,4 200 r·min-1离心5 min;准确吸取上清液6 mL于离心管中,40 ℃水浴氮吹至近干,加入2 mL丙酮后超声30 s;加入10 μL内标溶液,过微孔滤膜后放入进样小瓶,待测。
1.2.4 色谱条件
色谱柱TG-5SILMS;分流比1∶20;进样体积1 μL;程序升温:初始温度,50 ℃,保持1.0 min;以30 ℃·min-1升温至130 ℃,保持0 min;以5 ℃·min-1,升温至250 ℃,保持0 min;以5 ℃·min-1升温至300 ℃,保持5 min。
1.2.5 质谱条件
电离源模式:EI;电离源极性:阳性;传输线温度:270 ℃;离子源温度:230 ℃;电子轰击源:70 V;扫描模式:多反应监测。
2 结果与分析
2.1 质谱条件优化
小麦籽粒基质比较复杂,含有淀粉、糖类、色素等物质,为消除基质效应,通常采用基质配制标准溶液。实验中,对小麦阴性样品进行处理,配制基质标准溶液。对多效唑标准溶液(0.10 mg·L-1)进行分析,调节进样口温度、载气流速、升温程序等色谱条件,观察目标化合物的信号响应强度、出峰情况。利用质谱仪对标准溶液进行全扫描分析,根据总离子流图,用仪器自带的NIST谱库进行检索,确定目标化合物的出峰时间;调整碰撞电压,确定多效唑的定性离子对和定量离子。如图1所示,多效唑的出峰时间是21.14 min,定性离子对为236.00>132.00和236.00>167.00,碰撞能量为5 V和20 V,定量离子对为236.00>125.00,碰撞能量为10 V。
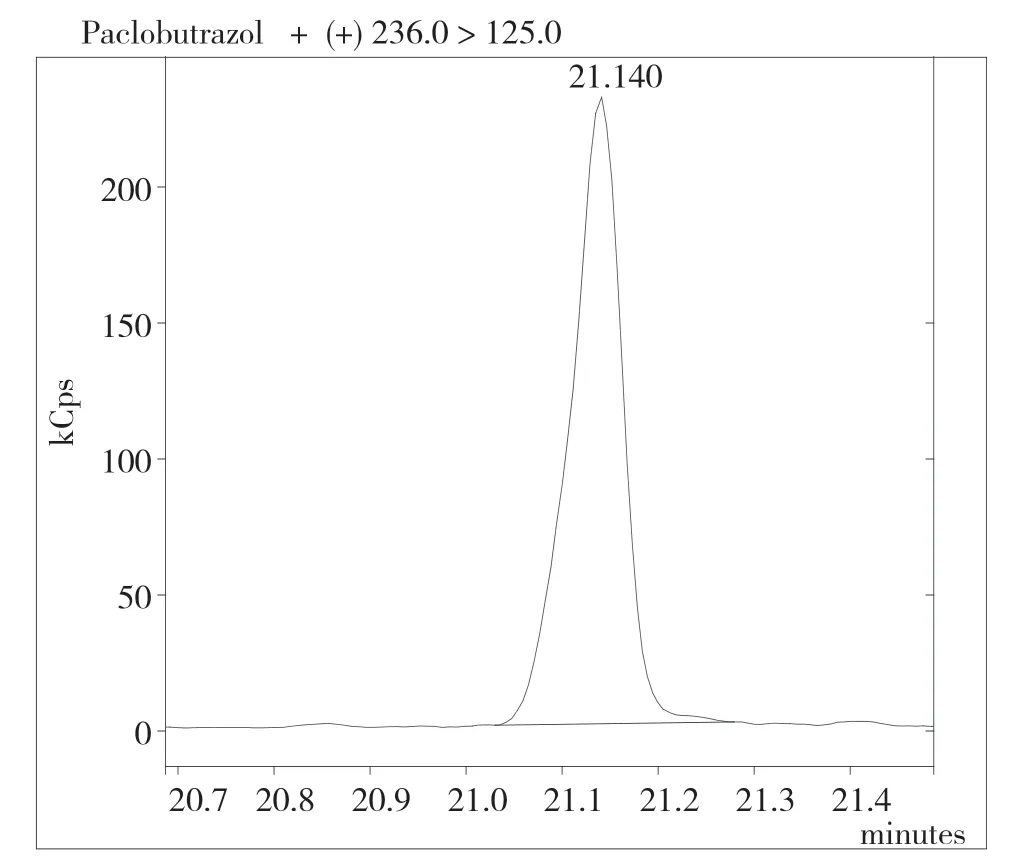
图1 多效唑多反应监测色谱图
2.2 净化剂的选择
用空白小麦样品添加0.10 mg·kg-1浓度的农药,前处理提取过程采用乙腈作为提取剂、用醋酸缓冲盐包进行提取。在净化管中加入净化剂进行净化,根据实验室前期研究,实验中多壁碳纳米管的用量为5 mg;氮吹定容后经气相色谱质谱联用仪检测。样品平均回收率为81.98%,满足检测要求(一般回收率实验要求70%~120%)。这是因为多壁碳纳米管具有纳米级别的特殊的中空管状结构,可以通过非共价力对某些物质产生较强的作用力,具有良好的吸附能力[13-14]。此外,多壁碳纳米管易制备、市售价格低廉,能够降低实验成本[15]。
2.3 方法评价
用选定的质谱条件对基质标准溶液进行质谱分析,满足定性分析要求,具体结果见图1。配制不同质量浓度的标准溶液(0.01 mg·L-1、0.02 mg·L-1、0.05 mg·L-1、0.10 mg·L-1、0.20 mg·L-1和0.40 mg·L-1),以峰面积对应不同浓度作标准曲线,如表1所示,多效唑在0.01~0.40 mg·L-1线性良好,相关系数r2为0.998 9。
对阴性样品进行3个浓度的加标回收实验,每个添加水平设置5组平行样品,计算平均回收率及相对标准偏差。如表1所示,多效唑的回收率为89.44%~102.96%,相对标准偏差为3.4%~9.5%,回收率及稳定性均满足分析检测的要求。

表1 多效唑的线性范围、线性方程、相关系数、定量限、加标回收率及精密度(n=5)
2.4 实际样品的检测
采用该方法对市场上购买的2份样品进行分析检测,没有检测到阳性样品。
3 结论
本研究采用多壁碳纳米管改进的QuEChERS方法为前处理方法,建立了同时测定小麦籽粒中常见杀虫剂的气相色谱-串联质谱法(GC-MS/MS)。在0.01~0.40 mg·L-1线 性 良 好,加 标 回 收 率 为89.44%~102.96%,相对标准偏差小于10%,满足定性分析、定量分析的检测要求。该方法操作简单、分析准确、检测灵敏度高、稳定性好,能够快速检测小麦籽粒中多效唑残留,可为小麦的日常农药残留风险检测提供技术支持。
