微生物菌剂对栽培基质微生物群落的影响
2022-10-13曾翠云张永合万家秀
陈 臻,曾翠云,张永合,万家秀
(1.兰州资源环境职业技术大学环境与化工学院,甘肃兰州 730021;2.甘肃中医药大学药学院,甘肃兰州 730000;3.西北中藏药协同创新中心,甘肃兰州 730000)
无土基质栽培有效地解决了以往设施农业与露地农业生产争地的矛盾,实现了蔬菜对水分、肥料的高吸收。甘肃现代丝路寒旱农业区通过循环利用玉米秸秆等农业废弃物,以及椰糠、草炭、牛粪等制作无土栽培基质,不仅解决了农业面源污染难题,而且实现了农果蔬结合、农牧互补和资源再利用的绿色循环发展。无土基质栽培已成为现代丝路寒旱农业生产的重要环节,现已在我国西北地区大面积推广应用。由于基质是作物赖以生存的基础,戈壁农业中作物生长发育所需要的养分、水分和土壤微生物都需从基质中获得,尤其是土壤微生物与植物的生长和健康密切相关,是土壤肥力的重要组成部分和重要保障。
微生物菌剂是从土壤或植物体内经筛选、分离后得到的一类菌群,再经过发酵等一系列工业化处理将这些微生物扩增培养后加工成一种液态或固态的活菌制剂,将其应用到农作物上,能够实现绿色无污染的现代化农业生产模式。木霉菌(spp.) 是自然界广泛分布的生防真菌,其中的绿色木霉() 和哈茨木霉() 是常用的微生物菌剂。近年来研究发现,哈茨木霉协同秸秆处理对马铃薯土壤微生物群落有一定影响,尤其对真菌群落多样性、群落结构组成影响较大。施用微生物菌剂有利于改善土壤的微生物结构,增加土壤细菌、放线菌的数量。
目前,关于河西走廊戈壁农业区无土栽培基质根际微生物现状以及微生物菌剂施用后对基质的根部微生物群落等影响报道较少。为此,该研究以温室大棚栽培土壤作为对照,对比其与栽培基质本身的微生物群落结构状况;并通过在基质上施用哈茨木霉,探讨微生物菌剂对基质微生物群落多样性的影响,以期为戈壁生态农业无土栽培基质中微生物菌剂的应用提供理论依据。
1 材料与方法
供试植物。供试辣椒(L.)品种为螺丝椒,市场购买,生产厂家为河北茂华种业有限公司。
供试微生物菌剂。哈茨木霉,主要菌种为哈茨木霉菌(),有效活孢数≥10亿/g,市场购买,生产厂家为北海亦强生物科技有限公司。
供试基质。基质购自酒泉康多生态农业科技发展有限公司,以有机质为主要原料,通过高温发酵腐熟后,复配生物菌剂、草炭、珍珠岩,经自动化程序加工而成。其中有机质35%~45%,pH中性,腐殖酸15%~25%。
供试土壤。采自白银区水川镇桦皮川村农业示范园温室大棚。
试验于2021年3—6月在白银市白银区水川镇桦皮川村农业示范园温室大棚内进行,以基质栽培为处理1(T),以土壤栽培为处理2(T),定植时将哈茨木霉菌对水稀释2 000倍后灌根,每株浇灌200 mL。设1个对照(CK),对照用清水喷施,其他栽培方式、条件相同。
取样:在定植移栽后60 d,按五点取样法采集0~20 cm土层基质(土壤)得到混合土样。迅速将土样保存于带有冰袋的保温箱中,带回实验室,于-20 ℃冰箱保存,备用。
采用 Power Soil DNA Isolation kit 提取试剂盒(MOBIO),称取 0.5 g土样,按试剂盒说明书分别提取供试土壤(T)、喷施哈茨木霉的栽培基质(T)和对照(CK)的 DNA。用 0.8% 琼脂糖凝胶电泳对 DNA的质量进行检测,测定DNA的纯度和浓度。样品总 DNA 提取后,对细菌16S rRNA V3-V4区和真菌18S rRNA V4区进行 PCR 扩增:细菌引物序列为341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′);真菌引物序列为V4F(5′-GGCAAGTCTGGTGCCAG-3′)和V4R(5′-ACGGTATCTRATCRTCTTCG-3′)。PCR 反应成分:Phusion DNA 聚合酶预混液 12.5 μL,上下引物各 2.5 μL,DNA 50 ng,补无菌水至 25 μL。PCR 扩增反应条件:98 ℃预变性 2 min;98 ℃变性 15 s,55 ℃退火30 s,72 ℃延伸30 s,25个循环;72 ℃ 延伸5 min。用 2% 的琼脂糖凝胶电泳对 PCR 产物进行检测,PCR 产物的回收采用 AXYGEN 公司的凝胶回收试剂盒,待测定后产物的浓度和特异性合格后,送生工生物工程(上海)股份有限公司测序。
利用 Uparse 软件对所有有效序列按 97%相似度进行分类操作单元(operational taxonomic units,OTUs)划分;然后选取每个 OTUs 中频数最高的代表性序列,进行物种注释,用 Mothur 方法将 OTUs 的代表序列与 SSUrRNA 数据库进行物种注释,最终获得分类学信息。统计各个样本的物种在门、纲、目、科、属和种分类水平上的分类单元数量。运用QIIME2软件计算各样本微生物群落的α多样性指数,以表征物种的丰富度、多样性及均匀度。采用语言的Venn Diagram包绘制各分类学水平上的细菌和真菌基因序列的Venn图。
2 结果与分析
从稀释曲线(图1)可以看出,从样本中随机抽取一定数量的序列,随着抽取的测序数据量的增加,细菌和真菌稀释曲线均基本趋于平缓,所有个体的深度测序指数(Coverage指数)在 0.996 9~0.999 7(表1),说明该研究的测序结果有足够的测序数据量,能反映当前样本所包含的多样性。
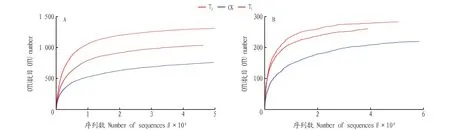
图1 相似度为0.97条件下各土壤细菌(A)和真菌(B)的稀释曲线Fig.1 The dilution curve of each soil bacteria (A) and fungi (B) under the condition that the similarity is 0.97
Chao1指数和Shannon指数代表了微生物群落结构的变化,Chao1指数越大,该样本物种数越多;Shannon指数越大,群落多样性越高。从表1可以看出,辣椒根际土壤(T)细菌的Chao1指数、Shannon指数均为最高,表明在不同的栽培介质中,土壤栽培的根际土壤细菌群落丰富度和多样性大于栽培基质。施用哈茨木霉后处理(T)的细菌类群的Chao1指数和Shannon指数较未施用哈茨木霉(CK)分别提高了16.87%和6.48%,真菌类群(包括其他真核生物)分别提高了17.36%、42.33%,说明施用哈茨木霉后,栽培基质中的微生物群落多样性和物种数量均有不同幅度的升高。
图 2 表明,栽培土壤(T)、施用哈茨木霉的栽培基质(T)、对照(CK)共有的细菌 OTUs 数量为402,T、CK、T特有的 OTUs 数量分别为639、49、144,可见土壤的细菌OTUs 数量最多,哈茨木霉处理后的栽培基质细菌OTUs 数量高于对照;3种不同处理共有真菌的 OTUs 数量为117,而T、CK、T特有的真菌OTUs 数量分别为92、28、29,栽培土壤(T)的真菌群落的 OTUs数量仍为最高,哈茨木霉处理后的栽培基质(T)真菌OTUs数量略高于对照(CK)。
T、CK和T这3种处理根际土壤中共有24门64纲108目215科378属细菌,其中T为21门59纲96目184科295属,CK为20门51纲86目176科293属,T为21门55纲95目194科333属。在细菌的门、纲、目、科、属水平,栽培土壤(T)均表现较高。施用哈茨木霉(T)后细菌类群高于对照(CK),分别增加了1门、4纲、9目、18科、40属。各处理细菌群落在门分类水平上具有较高的多样性,相对丰度位于前8的分别为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、酸杆菌门(Acidobacteria)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia),其他类群的相对丰度占比为19.81%。在T中变形菌门、拟杆菌门、酸杆菌门为优势菌群,相对丰度分别为 31.55%、22.00%、15.47%;在CK中变形菌门、放线菌门、厚壁菌门为优势菌群,相对丰度分别为 33.79%、22.63%、9.11%;在T中变形菌门、拟杆菌门、厚壁菌门为优势菌群,相对丰度分别为 35.05%、27.68%、16.99%。施用哈茨木霉后,优势菌群中变形菌门、厚壁菌门的相对丰度分别增加了3.73%、86.50%(图3)。
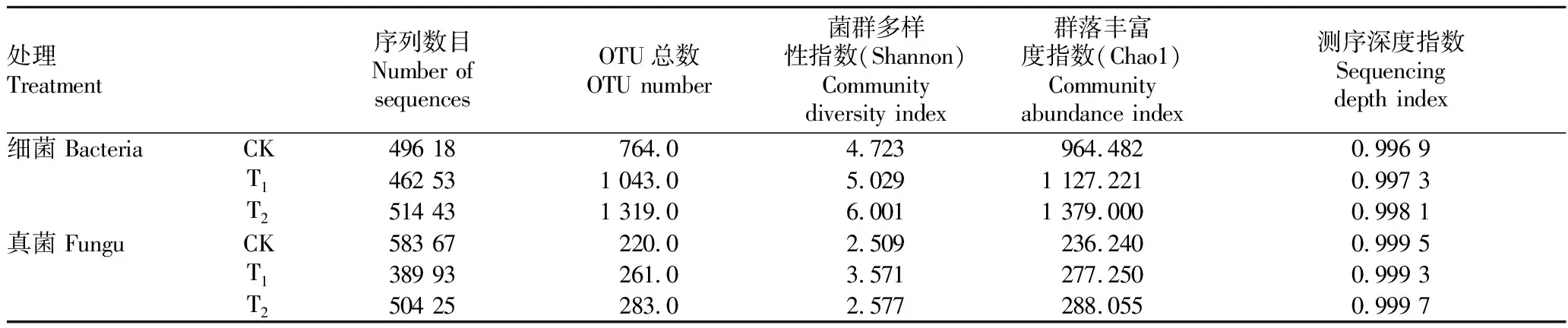
表1 哈茨木霉处理后辣椒根际土壤细菌、真菌群落多样性指数
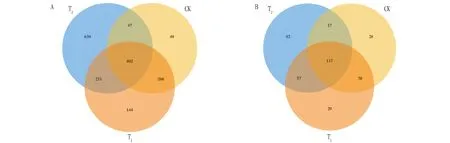
图2 不同处理辣椒根际土壤细菌(A)和真菌(B)群落的OTUs韦恩图Fig.2 Venn diagrams of OTUs of bacterial (A) and fungal (B) communities in the rhizosphere soil of pepper under different treatments
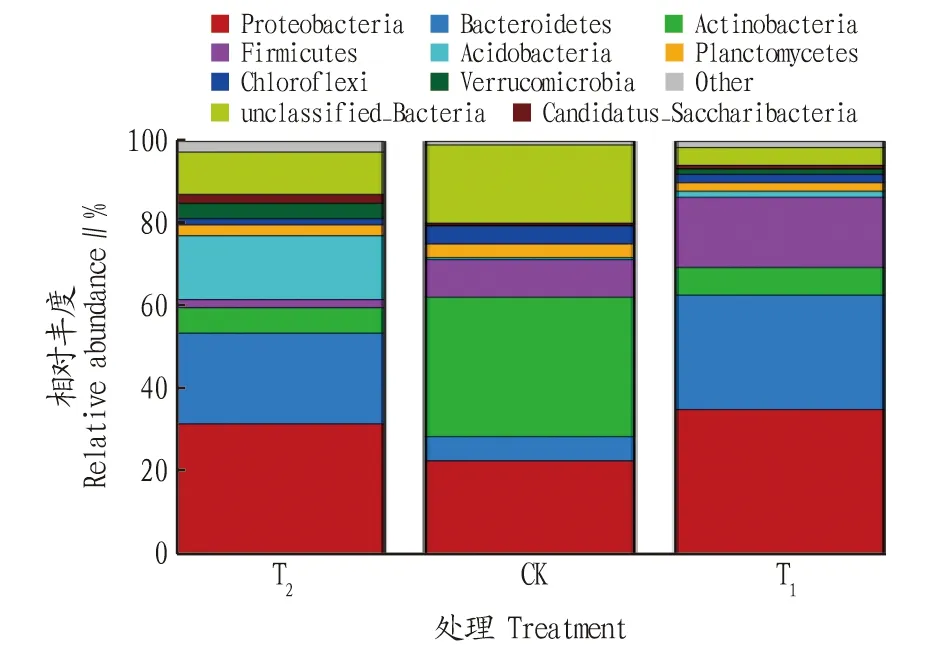
图3 不同处理辣椒根际土壤细菌群落在门水平上的相对丰度Fig.3 Relative abundance of bacterial communities in the rhizosphere soil of pepper under different treatments at the phylum level
T、CK和T这3种处理根际土壤中共有4门8纲12目14科16属17种真菌,其中在真菌的门、纲、目、科水平均相同;在属水平上,T最少,为13属,CK和T均为16属;在种水平上,T最少,为12种,CK和T均为17种。施用哈茨木霉(T)真菌类群和对照(CK)数量无变化。各处理真菌群落在门分类水平上具有较高的多样性,相对丰度位于前4的土壤真菌群落分别为子囊菌门(Ascomycota)、壶菌门(Chytridiomycota)、毛霉门(Mucoromycota)、担子菌门(Basidiomycota)。其中CK中相对丰度子囊菌门占59.54%,壶菌门、毛霉门、担子菌门分别占0.52%、4.85%、0.28%;T中相对丰度子囊菌门占42.20%,壶菌门、毛霉门、担子菌门分别占3.88%、0.30%、4.11%。施用哈茨木霉后,优势菌群有增有减,子囊菌门和毛霉门相对丰度分别减少了29.12%和93.81%,壶菌门和担子菌门相对丰度分别增加了6.5和13.7倍(图4)。

图4 不同处理辣椒根际土壤真菌群落在门水平上的相对丰度Fig.4 Relative abundance of fungal communities in the rhizosphere soil of pepper under different treatments at the phylum level
3 讨论
土壤微生物能分解土壤中的动植物残体,形成有机质,是最丰富最全面的植物营养来源,有益微生物与根系形成互补共生关系。无土栽培基质在使用前都经过高温灭菌,基质中含有微生物很少,但在作物栽培过程中,许多微生物会通过各种途径进入基质。在该研究中,温室大棚中原有栽培土壤中微生物群落不论是细菌还是真菌群落的丰富度和多样性均高于栽培基质,在施用哈茨木霉后,栽培基质中的微生物群落多样性呈现显著提升,说明微生物菌剂可对基质的改良起到较好的促进作用。近年来,微生物菌剂的应用越来越广泛,多种微生物制剂在作物上取得了较好的效果,施用微生物菌肥和菌剂能促进农作物生长,增加产量,提高品质,增加有益菌丰度,减少病原菌丰度,改变土壤微生物群落结构,改善土壤微环境。也有研究表明,微生物菌剂对土壤微生物群落多样性的影响并不明显,但显著改变了土壤微生物群落组成,土壤微生物群落通过影响土壤碳、磷循环的微生物酶活性,从而间接地影响作物产量。
施用微生物菌剂对土壤细菌群落和真菌群落会产生不同的影响。据报道,微生物菌剂的添加对草莓土壤细菌群落结构产生了显著影响,增加了厚壁菌门细菌的相对丰度,但对真菌的作用不明显。不同的微生物菌剂对土壤微生物群落影响也不同,施用枯草芽孢杆菌()后,华重楼根际土壤细菌丰富度和多样性显著下降,而解淀粉芽孢杆菌()对细菌丰富度和多样性无显著影响,2种微生物菌剂均对根际土壤中真菌数量的影响不显著。长枝木霉处理会增加根际玉米土壤细菌群落数量,但会减少真菌群落数量。施入木霉制剂后,茉莉根围土壤中细菌和真菌的数量显著提高。在该研究中,施用哈茨木霉后,基质细菌类群较对照分别增加了1门、4纲、9目、18科、40属,优势菌群中变形菌门、厚壁菌门的相对丰度分别增加了3.73%、86.50%;基质真菌类群中优势菌群中子囊菌门和毛霉门相对丰度分别减少了29.12%和93.81%,壶菌门和担子菌门相对丰度分别增加了6.5和13.7倍,但在属和种的水平上基本没有变化,这与前期相关学者的研究结果基本一致。施用微生物菌剂,可以通过调节土壤微生物群落结构和组成,使其中功能菌和激发的关键微生物来增加作物产量,同时还能够提高根际土壤微生物群落代谢能力,促进土壤微生物群落对碳源的整体利用,增强代谢活性,提高作物品质、改善土壤肥力。因此,未来微生物菌剂在基质改良、绿色生产中有广泛的应用前景。
4 结论
该试验通过研究栽培土壤与栽培基质之间微生物群落结构及多样性差异,以及施用微生物菌剂后对栽培基质微生物群落的影响,发现农田栽培土壤的根际土壤细菌和真菌群落丰富度和多样性高于栽培基质,微生物菌剂的施用显著提升了栽培基质细菌类群,但对栽培基质的真菌类群影响较小。这些结果为认识无土栽培基质种植带来的根际微生态问题提供了新的视角,可为戈壁农业科学种植农作物、高质量持续发展提供理论依据。
