Ⅱ型2级AIP影像学表现及文献回顾
2022-10-12王卫红刘丹颖程颜苓
王卫红,刘丹颖,程颜苓
(1.北戴河康复疗养中心 健康管理部,河北 066100;2.天津康复疗养中心 健康管理部,天津 300000)
自身免疫性胰腺炎 (autoimmune pancreatitis,AIP),是由免疫机制介导的慢性胰腺炎,胰腺呈弥漫型或肿块型肿大,胰管不同程度狭窄伴或不伴有远端胰管继发性扩张,临床特征主要为梗阻性黄疸,治疗上对糖皮质激素敏感。本文报道了1例Ⅱ型AIP2级病例,并结合国内外相关文献对其诊断及治疗进展进行归纳和总结。
1 病例资料
患者男,52岁,因腹痛、尿色发黄两日并皮肤巩膜轻度黄染于2020年8月9日来我院就诊。实验室检查:总胆红素65.58μmol/L,直接胆红素43.82μmol/L,间接胆红素21.76μmol/L,碱性磷酸酶638.5U/L,谷丙转氨酶350.3U/L,谷草转氨酶149.2U/L。肿瘤标志物检测阴性。超声检查所见:胰腺形态饱满,体积增大,表面明显不光滑,实质回声稍减低、增粗、不均匀,胰头、体部均可见局灶性偏低回声(图1),较大范围约3.8cm×3.5cm×3.2cm,边界不清,彩色多普勒未见明显血流信号;主胰管走形扭曲,局限性扩张,最宽处内径约0.49cm。胆囊大小约12.4cm×4.1cm,腔内见胆泥沉积后壁,胆总管增宽,较宽处内径约1.5cm。肝内胆管增宽,较宽处内径约0.7cm。超声提示:①考虑符合胰腺炎超声表现,建议进一步检查;②肝内外胆管增宽,胆囊体大,胆泥淤积,考虑继发性改变。核磁增强检查提示:胰腺体积增大,形似“腊肠”样改变,可见假包膜,呈稍长T1、稍长T2信号改变,注入GD-DTPA后行动态增强扫描,胰腺延迟期强化,胆囊增大(图2)。提示:考虑自身免疫性胰腺炎伴低位胆道梗阻。遂进行血清检测发现:IgG7.62g/L(亚型均正常),IgA0.61g/L,IgM0.77g/L,抗SM抗体、抗SSA抗体、抗SSB抗体、抗核小体抗体、抗线粒体抗体、抗横纹肌抗体等均阴性。穿刺病理:未找到癌细胞,可见多量红细胞。后转入外院经激素试验性治疗症状好转。该例患者年龄52岁、男性,为AIP的高发人群,且以慢性腹痛、梗阻性黄疸就诊,血清IgG4未见明显升高,影像学表现胰腺呈多灶性肿大并延迟强化,同时伴有肝内外胆管及胰管的继发扩张,穿刺活检未见癌细胞,激素试验性治疗有效,按照AIP国际诊断标准,诊断为AIP-Ⅱ型2级。

图1
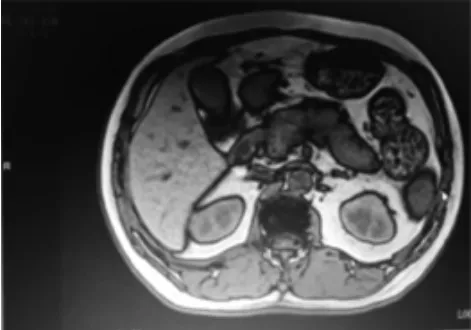
图2
图1超声显示胰腺体积增大,回声不均,呈多灶性回声减低。
图2上腹部增强MRI扫描显示胰腺体积增大,呈“腊肠样”改变,并可见延迟强化。
2 讨论
2.1 流行病学及发病机制
慢性胰腺炎多由急性胰腺炎演变而来,胰腺炎性病变反复发作,迁延不愈,依其病因可分为酒精性慢性胰腺炎、胆源性慢性胰腺炎、AIP。酒精性及胆源性慢性胰腺炎有确切病因,AIP病因不明,以胰腺弥漫性或局限性肿大以及胰管不规则狭窄为 特征,对激素治疗敏感[1]。AIP最早由Sarles等于1961年首次报道,其概念由Yoshida等在1995年首次提出,发病机制尚不清楚,可能与遗传、免疫及感染性因素相关,好发于中老年男性,发病年龄跨度较大,多发生在40-70岁。AIP发病率较低,国外文献报道其发病率不超过慢性胰腺炎的6.6%[2]。2011年国际共识统一诊断标准,将AIP分为两种亚型,即Ⅰ型和Ⅱ型AIP。Ⅰ型AIP常伴有特征性血清免疫球蛋白G4(immunoglobulin G4,IgG4)水平升髙,是血清IgG4相关疾病(IgG4-related disease,IgG4-RD)的胰腺表现,组织学上表现为大量淋巴细胞和浆细胞的浸润伴纤维化,又称之为淋巴浆细胞硬化性胰腺炎;Ⅱ型AIP仅见少量或无IgG4阳性细胞浸润(0-10个细胞/HPF),是一类与IgG4无关的胰腺特异性疾病,常并发炎症性肠病[3-4],组织学表现为导管壁或腺泡的粒细胞浸润,又称之为特发性导管中心性胰腺炎。
2.2 临床表现
AIP的临床表现复杂多样,且缺乏特异性,主要为胰腺本身及胰腺外病变,多数患者有梗阻性黄疸表现,呈进行性或间歇性,部分患者伴轻微腹痛、腹胀、腹泻、恶心呕吐、乏力、体重减轻等,还有少数患者有消化不良、糖尿病等胰腺内、外分泌功能不全的表现[5-6]。AIP患者首发症状多为梗阻性黄疸伴上腹痛或体检发现胰腺占位而就诊。
2.3 辅助检查、诊断及鉴别诊断
2.3.1 辅助检查
该病的辅助检查主要包括影像学、血清学及组织病理学检查等。①影像学检查。AIP可根据病变累及范围分为弥漫型和肿块型,超声及MRI增强扫描检查可发现胰腺及胰管形态、信号及强化方式的异常:弥漫型典型表现为胰腺形态的“腊肠样”改变,肿块型类似于胰腺癌,不具有特异性,增强检查可见延迟强化。②实验室检查。自身免疫性抗体、血清IgG4指标用于确定AIP分型。血尿淀粉酶因其不确定性(可升高、正常或偏低),仅作为参考和鉴别诊断。③组织病理学检查。二者的病理学特征有着显著不同:AIP-Ⅰ型典型的病理学特征为致密胰腺导管周围的炎症细胞浸润,主要为淋巴细胞和浆细胞,最终导致管周的纤维化、管腔狭窄,甚至为纤维瘢痕组织所代替,累及肝外胆管,尤其胆总管远端,呈渐进性狭窄。免疫组化染色可见大量IgG4染色阳性细胞,阳性细胞数>20个时仅见于AIP,该指标具有较高敏感度和特异度(敏感度为43%,特异度为100%)[7],其炎症介质主要是淋巴细胞和浆细胞;而AIP-Ⅱ型典型的病理学特征为胰腺主导管及小叶间导管上皮细胞破坏引起的炎症细胞浸润,主要为中性粒细胞,导致胰管不同程度狭窄,仅见少量或无IgG4染色阳性细胞出现(0-10个细胞/HPF)[8],其炎症介质主要为中性粒细胞。
2.3.2 诊断标准
AIP的临床表现复杂多样,诊断标准不一,发病机制尚不十分明确,通过单一检查方法很难确诊。糖皮质激素对于治疗AIP效果较为积极,但无其他佐证的情况下,亦不能做出该病的诊断。因为胰腺癌、急性胰腺炎及其他类型的慢性胰腺炎临床表现与AIP难于明确区分,应用激素治疗后,临床症状及影像学表现亦可得到改善,同时也偶见胰腺癌合并AIP的病例报道[9-11],这给临床诊疗造成了一定困难。第14届国际胰腺病协会于2011年制定了AIP的国际诊断标准,主要从6个方面对AIP不同分型以及不同强度的诊断标准进行总结,为AIP的临床诊断提供了可靠依据[12],见表1-2。本例患者符合A+B+E2+D+F,诊断为AIP-Ⅱ型2级。

表1 AIP-Ⅰ型国际诊断标准
2.3.3 鉴别诊断
AIP需与胰腺癌、急性胰腺炎及其他类型的慢性胰腺炎相鉴别。①AIP根据病变累及范围可分为弥漫型和肿块型,常引起主胰管和胆管的不均匀狭窄和继发性扩张,组织病理学是诊断鉴别AIP和胰腺癌的金标准,但还要结合影像学、血清学检查。弥漫型AIP二维声像图表现为胰腺实质的弥漫性肿大、胰管不规则炎性狭窄,肿块型AIP则表现为胰腺实质内局灶性低回声,与周围组织界限清晰,多数不伴远端胰管扩张,少数伴远端胰管扩张时,其内径<5mm;AIP常累及肝外胆管,远离胰头的局灶性病变亦可累及,所累及胆管呈渐进性狭窄,胆管壁增厚但光滑;AIP患者胰腺萎缩不常见;彩色多普勒(CDFI)表现为病灶内点状彩色血流信号;MRI增强扫描呈延迟强化,强化程度高于胰腺癌,且密度均匀,周围可见环状低密度包壳;AIP是IgG4相关性疾病最常见的一种表现形式,常累及全身多个器官,引起器官纤维化,包括:IgG4相关性硬化性胆管炎、IgG4相关性涎腺炎、溃疡性结肠炎、原发性胆汁性肝硬化、肾脏病、干燥综合症、腹膜后纤维化等;AIP患者CA199、CEA等生化指标未见异常。胰腺癌依据病变累积范围亦可呈弥漫型或肿块型表现,多呈低回声,向周围组织浸润性生长,边界不清晰,多伴远端胰管不同程度扩张;胰腺癌患者累及肝外胆管,呈现“截断梗阻征”,伴胆管转移时,胆管壁不光滑;胰腺萎缩常见;胰腺癌为乏血供病变,CDFI表现为肿块内部血流稀疏,2cm以上的胰腺肿瘤甚至无血流显示;MRI增强扫描呈低增强,因乏血供内部容易出现缺血坏死灶,导致强化不均匀,且增强强度低于正常胰腺实质,静脉期廓清较快;胰腺癌多呈邻近脏器压迫受侵表现,常见腹腔及腹膜后淋巴结转移,晚期常见远隔脏器转移,多为肝、肺;胰腺癌患者有CA199、CEA等生化指标的升高,外周血肿瘤细胞检测亦呈阳性。②急性胰腺炎是消化科常见急腹症,因胆囊结石、过量饮酒、暴饮暴食等诱因导致胰酶激活引起胰腺组织自身消化。临床表现为突发性上腹痛、恶心、呕吐等,常伴血尿淀粉酶明显升高,超声表现为胰腺肿大、回声减低、胰周积液甚至假性囊肿形成等。该例患者无明显急性胰腺炎诱因及典型临床表现,超声未见自身消化造成的多发灶状回声减低,未见胰周积液或假性囊肿形成。③其他类型慢性胰腺炎。酒精性及胆源性慢性胰腺有明显诱因,患者有大量饮酒史或胆道疾病史,多由急性胰腺炎演变而来,病情反复、迁延不愈,其影像学表现为患病初期胰腺体积增大回声减低,随病情进展,胰腺体积往往缩小回声增高,与周围组织分界不清,可见假性囊肿、胰管结石或钙化等。血尿淀粉酶较急性胰腺炎升高不明显,多数在正常范围。

表2 AIP-Ⅱ型国际诊断标准
2.4 治疗
AIP的临床治疗首选类固醇激素,尤其对早期活动性AIP疗效较为积极。经激素治疗后,AIP患者不仅临床症状有所缓解,实验室指标及影像学检查结果都能得到改善。对于临床仍有约30%不能明确诊断的AIP患者,亦可采取试验性激素治疗来达到临床预期效果[13-14],激素治疗的有效性亦可协助临床诊断。有文献报道对于激素治疗反应差者,可选用针对B淋巴细胞表面CD20抗原的特异性药物-利妥昔单抗进行诱导缓解,但对治疗效果差、反复发作的患者,为在一定程度上减少激素和免疫抑制剂的使用剂量和时间,降低该病的复发率,可考虑手术切除,防止因反复复发导致恶变。影像学检查辅以血清免疫学指标的检测除了有助于明确诊断外还可判断疗效,用于AIP的随访观察。MRI检查以及IgG4水平变化为AIP的治疗效果评估提供重要的参考价值,造影增强检查可用于对比观察AIP在激素治疗后胰腺及胰管结构的变化,并结合临床症状改善情况综合评价激素治疗效果[15-17],而超声检查具有实时化、便携化、无射线损伤、图像质量高等优点,使其成为AIP的有效评估手段之一。
综上所述,AIP临床表现、血清学指标及影像学检查缺乏特异性,诊治较为复杂。IgG4在Ⅰ型AIP的诊断中具有较大参考价值,但对于Ⅱ型AIP则指导意义不大,因此对于AIP的诊断不能依靠某个单一指标,应对临床表现、影像学特点、实验室及组织病理学检查结果、激素试验性治疗效果综合分析,还应特别注意有无胰腺外器官受累[18]。临床医师应正确认识本病,从而为AIP获得最佳治疗时机及更好的治疗效果。
