甲硝唑凝胶微生物限度检查方法适用性研究
2022-10-12钮晓淑张姝丽柏大为
冯 璐,曹 敏,钮晓淑,张姝丽,柏大为△
(1.江苏省泰州市药品检验院,江苏 泰州 225300;2.江苏省泰州市人民医院,江苏 泰州 225300)
药品微生物控制是保障药品安全性的重要措施[1],药品的微生物限度检查对于控制药品质量和制剂安全性至关重要。甲硝唑凝胶为局部外用类药物,适用于炎性丘疹、脓疱疮或酒糟鼻、红斑等治疗。可根据2020年版《中国药典(四部)》通则1105-1107项下要求,建立其微生物检查方法。但进行微生物限度检查前,需消除样品本身的抑菌性[2]。本品辅料中所含卡波姆是凝胶剂中应用较广的一种基质[3],具有对皮肤亲和、易涂抹、不具油腻性、释药迅速等特点,被用作局部外用类药品[4]的辅料,而其黏合度易受酸碱度、金属离子等影响。薄膜滤过时,由于甲硝唑凝胶中卡波姆的存在,稀释液中形成胶体溶液,堵塞薄膜,导致供试液不能经0.45 μm滤膜滤过,难以冲洗,从而影响该检查。为消除这部分影响并选取最适宜的滤过方法,选取硫酸镁与供试液中的卡波姆络合,从而形成沉淀以方便过膜。为更好地体现不同方法对具有抑菌性类药物微生物限度检查的适用性,本研究中另采用常规平皿法和中和剂法进行探讨。现报道如下。
1 仪器、试药与菌株
仪器:SHP-250型生化培养箱(上海三发科学仪器有限公司,精度为0.1℃);QUINTIX1102-1CN型电子天平(赛多利斯科学仪器<北京>有限公司,精度为0.01 g);HTY-APL01型集菌仪(浙江泰林生物技术股份有限公司);1300 SERIES A2型生物安全柜(美国Thermo Fisher公司)。
试药:甲硝唑凝胶(江苏知原药业有限公司,批号为200350,规格为20 g∶0.15 g);pH 7.0氯化钠-蛋白胨缓冲液(批号为1091715)、胰酪大豆胨琼脂培养基(批号为1085674)、胰酪大豆胨液体培养基(批号为1086275)、沙氏葡萄糖琼脂培养基(批号为1086835)、溴化十六烷基三甲铵琼脂培养基(批号为1091355)、甘露醇氯化钠琼脂培养基(批号为2006045),均购自广东环凯微生物科技有限公司,规格均为每瓶250 g。
菌株:铜绿假单胞菌Pseudomonas aeruginosa[CMCC(B)10104]、金黄色葡萄球菌Staphylococcus aureus[CMCC(B)26003]、枯草芽孢杆菌Bacillus subtilis[CMCC(B)63501]、白色念珠菌Candida albicans[CMCC(F)98001]、黑曲霉Aspergillus niger[CMCC(F)98003],均购自中国食品药品检定研究院。
2 方法与结果
2.1 溶液制备
菌液:按照2020年版《中国药典(四部)》[5]通则1105及1106要求,取上述试验菌经培养后制成适宜浓度的菌液。
供试品溶液:称取样品10 g,加入pH 7.0氯化钠-蛋白胨缓冲液至100 mL,充分混匀,制成1∶10(m/V)的供试品溶液Ⅰ;称取样品10 g,加入含3%吐温80和0.3%卵磷脂[6-7]的pH 7.0氯化钠-蛋白胨缓冲液至100 mL,充分混匀,制成1∶10(m/V)供试品溶液Ⅱ;取样品10 g,置装有6~10颗玻璃珠的锥形瓶内,加入0.9%无菌氯化钠(含0.5%,1%,3%硫酸镁)溶液至100 mL,充分混匀,制成1∶10(m/V)的供试品溶液,静置沉淀,取上清液,即得供试品溶液Ⅲ。
2.2 需氧菌总数计数方法适用性试验
2.2.1 常规法(平皿法)及中和剂法
试验组:取2.1项下供试品溶液Ⅰ或Ⅱ各5份,每份9.9 mL,置试管中,分别加入5种菌的菌液0.1 mL,使供试品溶液含菌量均不大于100 cfu/mL。分别取适量,注入2个平皿,每皿1 mL。分别注入胰酪大豆胨琼脂培养基及沙氏葡萄糖琼脂培养基(其中前3种菌株仅以前一培养基培养),分别置30~35℃及20~25℃培养箱中培养。
供试品对照组:取2.1项下供试品溶液适量,以稀释液(0.9%无菌氯化钠溶液,下同)代替菌液,同试验组操作。
菌液对照组:取不含中和剂(聚山梨酯80,下同)及灭活剂的相应稀释液适量代替供试品溶液,按试验组操作,加入菌液并进行微生物回收试验。
取上述3组溶液,分别检测5种菌株含菌量,计算回收比。试验组的回收比=(试验组菌落数-供试品对照组菌落数)/菌液对照组菌落数。结果见表1及表2(表中左列数据为使用胰酪大豆胨琼脂培养基得到,右列数据为使用沙氏葡萄糖琼脂培养基得到)。

表1 常规法试验菌回收试验结果Tab.1 Results of the recovery test of test microorganisms by the conventional method
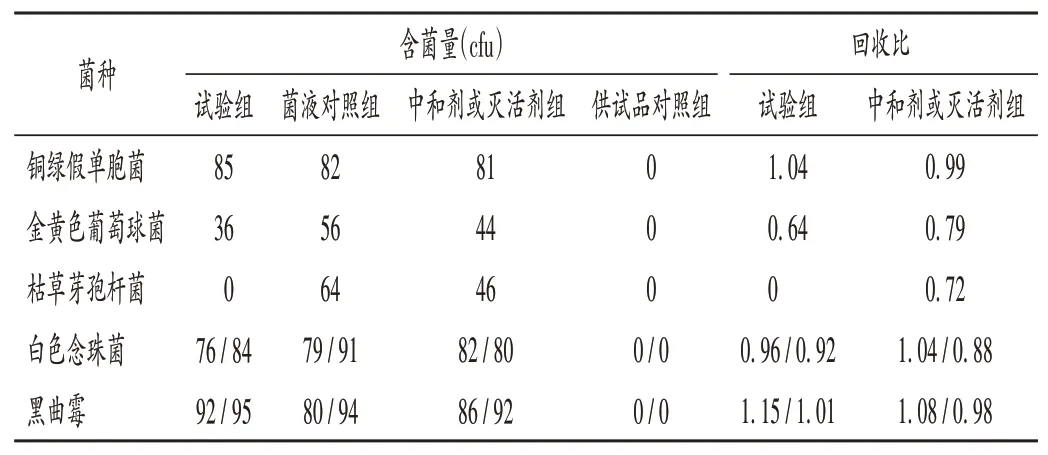
表2 中和剂法试验菌回收试验结果Tab.2 Results of the recovery test of test microorganisms by the neutralization method
2.2.2 薄膜过滤法
试验组:取2.1项下供试品溶液Ⅲ(含0.5%,1.0%,3.0%硫酸镁)各5份,每份9.9 mL,置试管中,分别加入5种菌的菌液0.1 mL,使供试品溶液含菌量不大于100 cfu/mL。取适量,经0.45 μm滤膜滤过,以pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗滤膜,取出滤膜,贴至胰酪大豆胨琼脂培养基及沙氏葡萄糖琼脂培养基,分别置30~35℃及20~25℃培养箱中培养。
稀释液对照组:取等体积含中和剂或灭活剂的稀释液代替供试品溶液Ⅲ,同试验组操作。
供试品对照组与菌液对照组:操作同2.2.1项下相应组的要求。
取上述4组溶液,分别检测5种菌株含菌量,计算回收比。试验组回收比的计算公式同2.2.1项,中和剂或灭活剂的回收比=中和剂或灭活剂对照组菌落数/菌液对照组菌落数。
2.2.3 改良薄膜过滤法
常规法中,金黄色葡萄球菌和枯草芽孢杆菌的回收比均为0,不达标。加入中和剂后,金黄色葡萄球菌回收比为0.79,符合规定(0.5~2.0);枯草芽孢杆菌回收比为0.70,需进一步改进。现在2.2.2项薄膜过滤法基础上,选择供试品溶液Ⅲ,冲洗液为pH 7.0无菌氯化钠-蛋白胨缓冲液(100 mL、300 mL、500 mL),稀释剂对照组对枯草芽孢杆菌进行回收试验,结果见表3。据此选择0.9%氯化钠溶液(含0.5%硫酸镁),冲洗液为pH 7.0无菌氯化钠-蛋白胨缓冲液(300 mL),进行5种试验菌的回收试验,结果见表4。

表3 改良薄膜过滤法枯草芽孢杆菌回收试验结果Tab.3 Results of the recovery test of Bacillus subtilis by the modified membrane filtration method
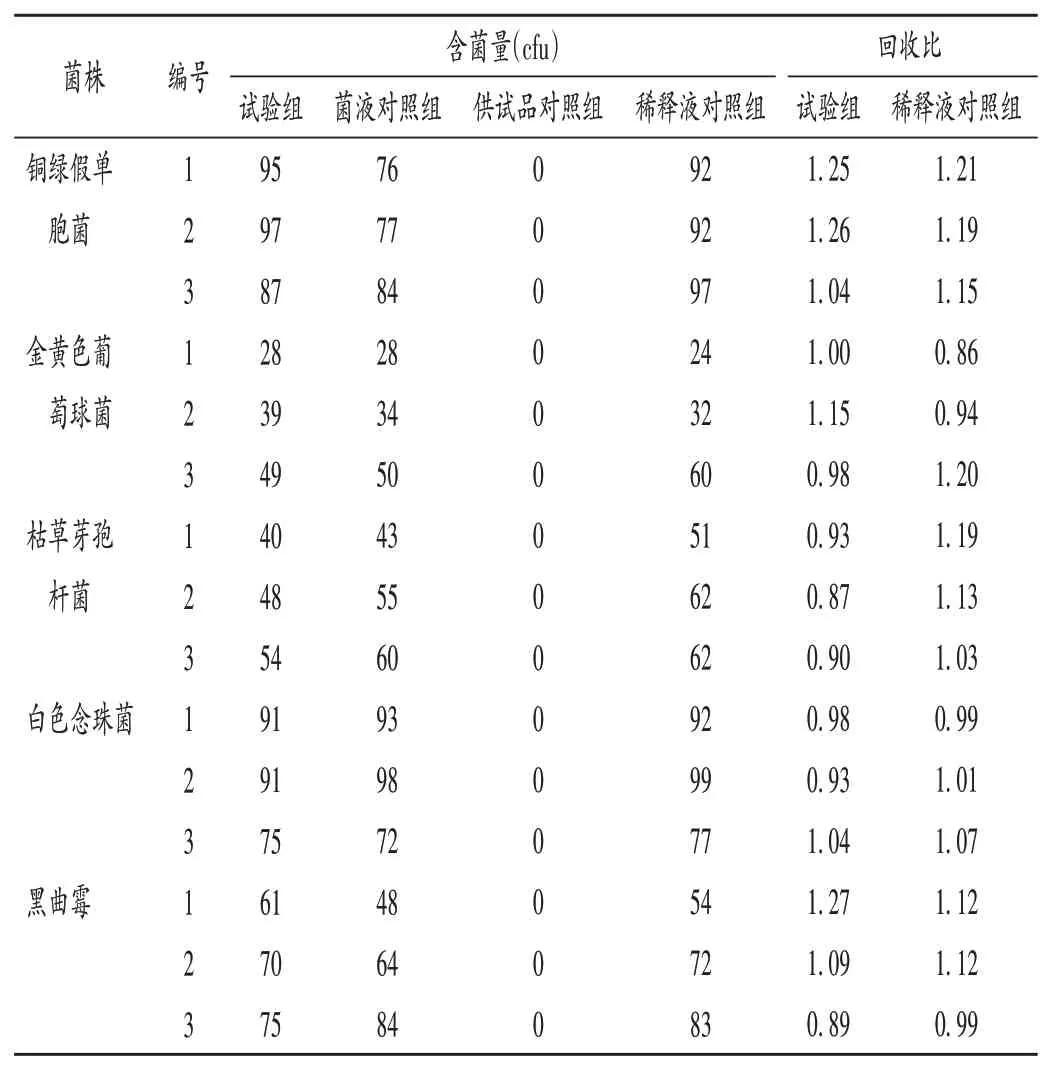
表4 改良薄膜过滤法试验菌回收试验结果Tab.4 Results of the recovery test of test microorganisms by the modified membrane filtration method
由表1可见,霉菌(黑曲霉)、酵母菌(白色念珠菌)总数采用常规法检测时回收比符合规定,故无须使用薄膜过滤法。试验组取加0.9%无菌氯化钠(含0.5%硫酸镁)溶液制备的供试品溶液Ⅲ6份,每份9.9 mL,置试管中,分别加入白色念珠菌和黑曲霉的菌液0.1 mL,使供试品溶液含菌量不大于100 cfu/mL,其余各组操作同2.2.1项下常规法相应组要求。取适量,各注入2个平皿,每皿1 mL。注入沙氏葡萄糖琼脂培养基,20~25℃培养,结果见表5。

表5 平皿法白色念珠菌及黑曲霉回收试验结果Tab.5 Results of the recovery test of of Candida albicans and Aspergillus niger by the plate-count method
2.3 控制菌检查方法适用性试验
2.3.1 供试品溶液制备
取样品10 g,加入0.9%无菌氯化钠溶液(含0.5%硫酸镁)至100 mL,充分混匀,制成1∶10(m/V)的供试品溶液,静置沉淀,取上清液,即得供试品溶液Ⅳ。
2.3.2 金黄色葡萄球菌检查方法验证
常规法:取供试品溶液Ⅳ10 mL,置200 mL胰酪大豆胨液体培养基中,加入含菌量不大于100 cfu的金黄色葡萄球菌菌液于培养温度下培养规定时间后,取培养物划线接种至甘露醇氯化钠琼脂培养基上,依法检查。结果前一培养基清澈,后一培养基上无菌落生长。
薄膜过滤法:取供试品溶液Ⅳ10 mL,薄膜滤过,冲洗液为pH 7.0无菌氯化钠-蛋白胨缓冲液(300 mL),薄膜置200 mL胰酪大豆胨液体培养基中,加入含菌量不大于100 cfu的金黄色葡萄球菌菌液,于培养温度下培养规定时间后按常规法操作。结果前一培养基浑浊,后一培养基上有典型菌落生长。
2.3.3 铜绿假单胞菌检查方法验证
采用常规法和薄膜过滤法(操作同2.3.2项,仅甘露醇氯化钠琼脂培养基换成溴化十六烷基三甲铵琼脂培养基)。结果无论采用常规法还是薄膜过滤法,前一培养基均出现浑浊,后一培养基上均有典型菌落生长。
2.4 最佳微生物限度检查方法
供试品溶液:取样品10 g,加入0.9%无菌氯化钠溶液(含0.5%硫酸镁)至100 mL,充分混匀,制成1∶10(m/V)的供试品溶液Ⅴ,静置沉淀,取上清液,备用。
需氧菌总数检测溶液:取1∶10(m/V)供试品溶液1 mL,采用薄膜过滤法,以300 mL pH7.0氯化钠-蛋白胨缓冲液冲洗,取出滤膜,贴至胰酪大豆胨琼脂培养基,置30~35℃培养箱中培养。
霉菌和酵母菌总数检测溶液:取1∶10(m/V)供试品溶液2 mL,注入2个平皿,每皿1 mL。注入沙氏葡萄糖琼脂培养基,置20~25℃培养箱中培养。
控制菌检测溶液:取1∶10(m/V)供试品溶液10 mL,采用薄膜过滤法,以300 mL pH7.0氯化钠-蛋白胨缓冲液冲洗,取出滤膜,接种于200 mL胰酪大豆胨液体培养基中,置规定培养温度下培养。
3 讨论
甲硝唑凝胶为凝胶类制剂,具有较强的抑菌活性,故在试验中需要优先考虑消除药品自身的抑菌性。本试验中采取加入中和剂和薄膜过滤的方法,为了更有效对比其中差异,另做常规法进行数据比较。结果显示,常规法中均有试验组的回收比低于0.5,不符合药典的要求,不能建立行之有效的需氧菌总数计数方法,且不同来源、不同浓度的中和剂聚山梨酯80对枯草芽孢杆菌的抑制作用差异较大[8],导致方法重复性较差,故采用薄膜过滤法。而在进行薄膜过滤法时,由于药品中存在卡波姆[9],会堵塞滤膜,导致无法正常过滤。对此,可采用金属离子络合形成沉淀的方法解决。
在消除供试品溶液抑菌活性的同时,还可对相应方法进行改进。1)需考虑供试品溶液制备步骤及方法对微生物的损耗程度[10]。加入0.5%硫酸镁后,可适当增加沉淀时间,取上清液更有效。选用静置而非离心取上清,是为了避免对微生物造成损伤[11]。但静置时间也不宜过长,否则可能导致微生物繁殖或死亡[12]。2)因pH 7.0氯化钠-蛋白胨缓冲液会与金属离子产生沉淀,影响过膜,故选取0.9%无菌氯化钠溶液作为稀释剂制备供试品溶液[13]。3)联用中和剂法与薄膜过滤法,加入硫酸镁前,先加入中和剂充分混匀供试品溶液。4)冲洗滤膜的过程中,理论上冲洗量越大更能消除抑菌性,但考虑到实际操作的琐碎,本着简易便捷、快速准确的原则,选取300 mL为适宜冲洗量,可少量多次冲洗,每次冲洗50~100 mL,以达到最理想效果[14]。5)冲洗过程中,需要边振摇边冲洗,从而使药物充分洗脱[15]。
本研究中开展薄膜过滤法前,为探寻最合适的冲洗量及硫酸镁的体积分数,以枯草芽孢杆菌为敏感菌,加入3种浓度的硫酸镁,再分别以3种冲洗量做对比。结果发现,当硫酸镁体积分数为0.5%和1.0%时,试验菌回收比大多符合标准。实际操作过程中,由于考虑薄膜过滤法带来的烦琐操作,且对比发现0.5%硫酸镁为破胶剂时滤过更容易。故择优选取以0.5%硫酸镁作为破胶剂,300 mL为冲洗量,作为甲硝唑凝胶薄膜过滤法的条件。
试验过程中发现,采用常规法时霉菌和酵母菌总数的回收比符合规定,在实际操作中,仅制备1次供试液进行检验最合理,故采用供试品溶液Ⅲ,再次进行霉菌和酵母菌总数的回收试验,验证霉菌和酵母菌总数的测定亦可通过常规法进行检测。
综上所述,本研究中利用硫酸镁与凝胶中的卡波姆(丙烯酸交链聚合物)结合形成沉淀,从而达到破胶的目的。取上清液,则可以顺利通过微孔滤膜,经冲洗后,可有效去除甲硝唑凝胶的抑菌作用。该种方法可为含抗感染药物凝胶制剂的微生物限度检查的研究提供参考。
