小切口联合内镜微创手术治疗感染性胰腺坏死疗效分析:附9例报告
2022-10-12卜浩吴浩然叶劲松刘友元黎辉赵凯柳胜君
卜浩,吴浩然,叶劲松,刘友元,黎辉,赵凯,柳胜君
(湖南省常德市第一人民医院 肝胆外科,湖南 常德 415003)
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床上常见的一种急腹症,占急性胰腺炎(acute pancreatitis,AP)的5%~10%,具有起病迅速、病情复杂多变、并发症多且严重及易出现多器官功能衰竭等特点,其病死率高达30%以上[1]。SAP有两个死亡高峰:其一是病程早期,发病两周内全身免疫反应综合征和多器官功能障碍综合征危重期;其二为病程晚期,发病1~2个月左右胰腺及胰周坏死继发感染期,易出现脓毒症、出血、消化道瘘等并发症,病死率高达15%~39%[2-4]。近年来多学科协作的综合治疗在SAP的治疗方面取得了一定进展,但感染性胰腺坏死(infected peripancreatic necrosis,IPN)的治疗仍是SAP治疗的公认难点,约35%~50%的SAP死亡与IPN有关[5]。经皮胰周脓肿穿刺置管引流术(percutaneous puncture catheter drainage,PCD)可使大部分IPN患者获益,但当引流难以奏效时,则需更进一步的外科干预[6-7]。随着微创技术和理念的不断发展,近年来IPN治疗已由传统开腹胰腺坏死组织清除术(open pancreatic necrosectomy,OPN)逐渐转变为以微创技术治疗为首选的“升阶梯(step-up)”策略[5,8-10]。笔者中心近年来运用小切口联合内镜微创手术治疗IPN临床疗效满意,现报告如下。
1 资料与方法
1.1 研究对象
回顾性分析2019年6月—2021年6月湖南省常德市第一人民医院肝胆外科9例行小切口联合内镜微创手术治疗IPN患者的临床资料。纳入标准:⑴ IPN诊断明确,自胰腺炎起病开始病程≥4周;(IPN诊断标准:符合下列两项中一项者可确诊:细针穿刺抽吸物或PCD引流物细菌或真菌培养为阳性;CT检查图像显示胰腺及胰周坏死区域出现气泡征);⑵ PCD引流效果欠佳;⑶ 完成小切口联合内镜微创手术治疗。排除标准:⑴ IPN诊断不明确,病程<4周;⑵ 复发性胰腺炎;⑶ 行PCD引流有效或未行PCD治疗;⑷ 未完成小切口联合内镜微创手术治疗或联合其他术式;⑸ 病例资料不完整。所有患者均签署知情同意书。
1.2 手术方法
本组患者遵循“升阶梯”治疗策略,术前均已行PCD引流(图1A)。术前常规行全腹部增强CT扫描明确坏死感染脓腔部位、大小及范围,脓腔是否分隔,脓腔与周围组织脏器位置关系,坏死组织液化程度;明确PCD管位置与坏死感染脓腔关系,是否在主要脓腔内。根据术前CT评估选择行小切口联合内镜微创手术清除感染坏死组织的最佳切口途径,包括经腹腔小网膜囊入路、经腹膜后入路以及两者同时运用的联合入路。经腹膜后入路建立清创通道:全身麻醉下,左侧或右侧倾斜卧位,腰部垫高,充分暴露腹部左外侧区或右外侧区,以PCD穿刺点或术中结合术中超声选取脓腔距离腹壁最近处为中心,行4~6 cm小切口,逐层切开进入腹膜后间隙,手指钝性分离,将腹膜向腹侧推移,以PCD管为指引钝性分离腹膜后筋膜寻找胰周脓肿,打开脓腔壁进入脓腔(对于切口处无PCD管引导者运用注射器结合术中超声穿刺确认脓腔位置)(图1B)。经腹腔小网膜囊入路建立清创通道:全身麻醉下,患者取平卧位,常规消毒铺无菌,以PCD穿刺点或术中结合术中超声选取脓腔距离腹壁最近处为中心,行4~6 cm小切口,逐层切开到达壁腹膜,切开壁腹膜,以PCD管为指引分离周围韧带寻找胰周脓肿,打开脓腔壁进入脓腔,而部分患者PCD管贯穿胃壁,则需要游离部分胃,将胃向上翻转,显露后方脓腔(对于切口处无PCD管引导者运用注射器结合术中超声穿刺确认脓腔位置)。保护切口,打开脓腔,运用吸引器吸取部分脓液,然后将脓腔壁或周围韧带组织与切口处壁层腹膜缝合固定,隔绝腹腔,防止脓液污染腹腔(图1C)。清除坏死感染组织:建立清创通道后,运用吸引器吸取部分脓液显露视野,先运用手指轻柔地钝性分离坏死组织,进入肾镜辅助下直视运用无齿卵圆钳夹取松散的团块状坏死组织,动作轻柔,绝不强硬拽拉;间断使用正压脉冲水枪生理盐水灌洗脓腔,使坏死组织冲洗松动的同时协助视野显露。待团块状坏死组织清除干净后,运用更精细的活检钳或取石网篮清除残余坏死组织,位置深在脓腔则运用胆道镜辅助下清除,待脓肿壁呈粉红色肉芽组织后停止清创,观察无活动性出血后退镜,在脓腔内留置两根及以上的引流管,再次逐根引流管冲水检测冲洗效果,确保建立一个术后贯通式冲洗系统(图1D-F)。
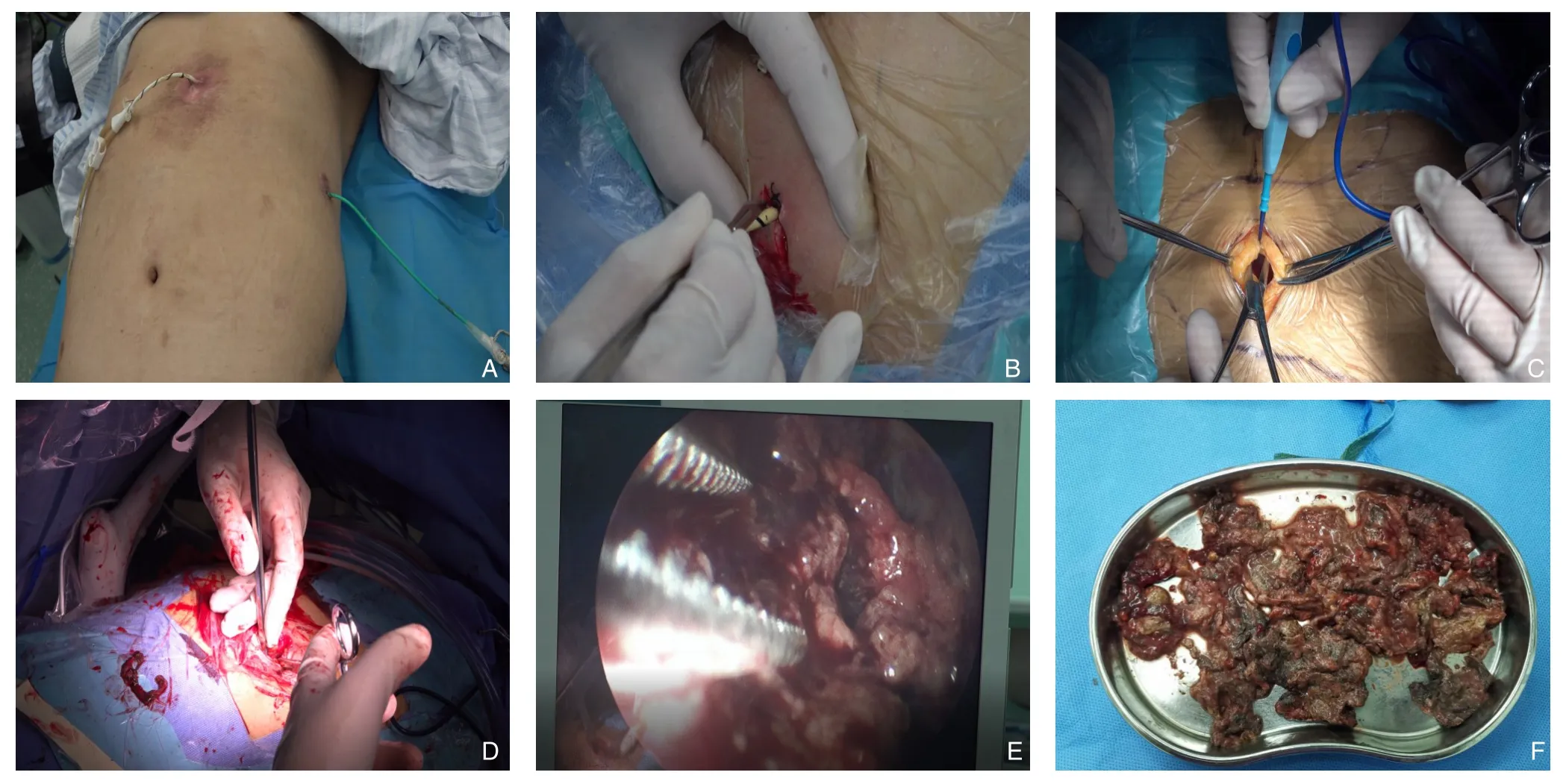
图1 小切口联合内镜微创手术治疗IPN A:术前行PCD;B:经左侧腹膜后入路;C:经腹腔小网膜囊入路;D-E:内镜辅助下清除坏死组织;F:坏死组织标本Figure 1 Mini-incision access combined with endoscopic pancreatic necrosectomy for IPN A: Preoperative PCD; B: Left retroperitoneal approach; C: Small omental sac approach through the abdominal cavity; D-E: Endoscopic-assisted removal of necrotic tissue; F: Necrotic tissue specimens
1.3 术后处理
术后常规进行心电监测,观察各引流管引流液性质和量;合理运用抗生素,术后常规使用生长抑素抑酶;若无消化道梗阻、瘘等需要禁食情况,术后第2天开始进食;术后第2天开始每天以500~1 000 mL生理盐水持续低流量冲洗脓腔;术后每5~7天复查1次CT,评估坏死物清除效果(图2),观察积液情况及引流管位置,必要时调整引流管。
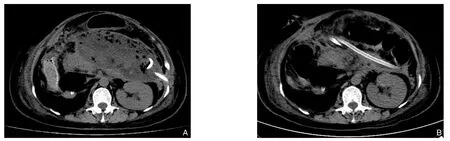
图2 CT评估坏死物清除效果 A:术前CT图像; B:术后5 d复查CT图像Figure 2 CT assessment of necrotic tissue removal A: Preoperative CT image; B: CT review on 5 d after surgery
1.4 观察指标
观察患者手术时间、术中出血量、清除坏死组织量、引流管数量、术后主要并发症发生率(器官衰竭、出血、胰瘘、肠瘘、肠梗阻等)、病死率、再次PCD次数、再次手术次数、术后住院时间及总住院时间等。
2 结 果
2.1 一般资料
湖南省常德市第一人民医院肝胆外科2019年6月—2021年6月共有14例IPN患者行外科手术治疗,排除5例行传统开放手术,其中有9例患者符合纳入标准而纳入本研究,其中男性7例,女性2例;年龄31~67岁,平均(46.7±11.6)岁;5例为高脂血症性胰腺炎、2例胆源性胰腺炎及2例酒精性胰腺炎;其中3例合并有2型糖尿病、1例合并有慢性肾功能不全;脓液细菌真菌培养提示有7例患者培养结果为阳性,阳性率为77.8%,其中有2例为两种病菌混合感染;培养病菌主要为多重耐药鲍曼不动杆菌(3例)、多重耐药肺炎克雷伯菌(3例)、大肠埃希菌(1例)、阴沟肠杆菌(1例)、光滑丝酵母菌(1例)、铜绿假单胞菌(1例)(表1)。

表1 9例IPN患者的临床资料Table 1 The clinical data of the 9 patients with IPN
2.2 手术情况
本组9例患者根据脓腔分布位置不同,分别有4例经左侧腹膜后入路、3例经腹腔小网膜囊入路及2例联合入路;从胰腺炎起病到第一次手术时间(47.2±10.1)d,术后住院时间(20.4±9.6)d;总住院时间(36.1±18.1)d,最长住院时间为65 d;手术时间为(151.7±55.2)min;清除坏死组织量(240±119.6)g;术中出 血 量(55.4±44.2)mL;放置引流管数量为3~6根,中位数4根。
2.3 术后并发症及预后情况
8例患者一次手术治愈,1例患者术后残余局部脓肿引流效果欠佳,术后仍出现发热症状,予以再次行PCD和胆道镜手术后明显改善;9例患者中有2例围手术期出现主要并发症(22.2%),其中1例患者术后第5天出现腹腔出血,经介入手术发现脾动脉分支出血,介入手术成功止血;1例患者术后8 d发现结肠瘘,考虑为结肠脾曲瘘,引流通畅,经过积极保守术后33 d顺利带管出院,术后4个月拔除引流管,未再次住院及手术治疗。9例患者均顺利出院,随访半年无脓肿复发、新发糖尿病、胰腺外分泌功能障碍、再次住院及死亡病例。
3 讨 论
3.1 IPN外科治疗现状
SAP治疗过程中,多学科协作的综合治疗能有效降低早期全身免疫反应综合征和多器官功能障碍综合征导致的病死率,但外科干预贯穿其治疗过程,尤其在坏死感染期可取得显著的效果[11]。在损伤控制理念的指导下,外科干预的微创化、创伤递进式的“升阶梯”策略已成为目前的重要趋势,微创手术逐渐成为IPN外科干预的首选方式[8,12]。2010年荷兰多中心随机对照研究[5]结果表明,“升阶梯”策略微创手术组对比OPN,患者术后并发症发生率、病死率、胰腺分泌功能不全及切口疝的发生率等均显著降低,这项高质量研究成果奠定了以微创手术为主导的“升阶梯”策略的发展基础。近年来在“升阶梯”治疗策略引领下,微创手术技术在国内外得到了全面发展,包括经自然通道内镜下坏死组织引流术(endoscopic transluminal drainage,ETD)、经自然通道内镜直视下坏死组织清除术(direct endoscopic necrosectomy,DEN)、经皮内镜坏死组织清除术(percutaneous endoscopic necrosectomy,PEN)、视频辅助下腹膜后坏死组织清除术 (video-assisted retroperitoneal debridement,VARD)、小切口腹膜后入路清创、肾镜及腹腔镜胰腺坏死组织清除术等多种方式,但由于IPN存在复杂性及多变性治疗难度高,目前尚无标准化术式,各类方法均有其优劣,因此临床上也常见多种方式联合运用及多次手术治疗[5,13-17]。IPN外科治疗的关键在于有效清除坏死感染组织及通畅引流,在平衡清创引流的效果与手术创伤的基础上,笔者中心近期运用小切口联合内镜微创手术治疗IPN取得了满意疗效,现将经验总结如下。
3.2 IPN外科干预策略及时机选择
PCD常作为IPN“升阶梯”策略的首选治疗方案,本组患者在行小切口联合内镜微创手术前均行1次或多次PCD治疗,但引流效果欠佳,仍有发热现象,予以引流管冲洗及针对性抗生素治疗后病情缓解不明显,复查CT局部仍可见较大脓腔,遂决定“升阶梯”运用外科清创引流干预。尽管PCD可能存在治疗效果欠佳,但仍不能否认其在IPN治疗中的关键作用,有报道[6,18]表明约30%~50%的IPN患者可通过PCD治愈,从而避免了外科手术干预。不仅如此,PCD能通过引流控制感染、改善患者状态,避免早期手术带来的“二次创伤”,延缓进一步微创清创手术干预时机;同时还能作为“路标”为进一步手术提供方向引导[19]。外科清创引流手术时机的选择是影响IPN疗效的重要因素,目前国内外指南推荐应尽可能推迟至发病4周后,此时感染性坏死组织逐渐液化形成包裹性坏死,与周围界限更清晰,且患者全身情况逐渐稳定,此状态下更利于微创手术清创的实施[20-21]。有报道[22-23]也表明,早期手术患者的病死率可达40%~50%,延迟手术可显著降低主要并发症发生率和病死率。本组患者通过PCD治疗联合抗感染及营养支持等对症治疗后,使坏死区域逐渐局限,为安全有效地进行外科清创引流手术提供了保障。但过度依赖PCD或非手术治疗延迟手术干预,可能导致多器官功能衰竭而丧失手术干预的机会,因此IPN在遵循“升阶梯”策略时,亦要避免“绝对化”,需遵循个体化的原则,少数患者可能需从由“升阶梯”到“跨阶梯(stepjump)”的治疗策略[24-26]。本组患者行小切口联合内镜微创手术时间均在发病4周之后,更多的是6周左右,获得满意的疗效,但考虑到笔者中心样本量偏小,累及经验有限,因此更为谨慎地选择手术时机。随着微创技术的飞速发展,微创手术对患者带来的“二次创伤”可能减少,对一般状态较好的患者适当提前手术,可能有利于缩短病程和患者住院时间,也有助于减轻经济负担。
3.3 小切口联合内镜微创手术的优势及局限性
2001年Horvath等[27]首次报道了视频辅助下腹膜后坏死组织清除术,他们以PCD管为引导在左侧腰部行4~5 cm切口,然后运用腹腔镜辅助下清除坏死组织引流,但其主要目的在于冲洗引流,并结合运用高压脉冲水枪冲洗脓腔,清除松动的坏死组织。吕新建等[19]运用小切口(3~8 cm)微创入路手术也取得了满意的疗效,针对脓腔位置分别运用了小切口腹膜后途径和小网膜囊途径两种入路,降低了手术创伤及腹腔脏器干扰。近期李国光等、蔡翊等[16,28]分别报道了运用视频辅助小切口手术及小切口联合肾镜手术清除坏死组织更为高效彻底,可显著减少再次手术干预次数。因此笔者在借鉴上述成功经验的基础上,做出了一些改进,运用小切口、肾镜及胆道镜等各类技术的优势,在安全可视的前提下提高清除坏死组织彻底性,以期更多患者达到一期治愈,避免多次手术治疗,从而减少创伤、缩短病程、降低医疗费用等。本组患者结果显示明显降低了再次手术次数,只有1例患者因脓腔广泛、复杂,术后再通过1次PCD和1次胆道镜手术治疗,最终患者痊愈出院。小切口联合内镜微创手术虽然清创效率更高,但该手术需要在全身麻醉下进行,因此不适用于基础情况较差难以耐受全身麻醉的患者。另外,由于其清创的彻底性更高,术后潜在出血、肠瘘、胰瘘等风险也可能更高。如冯健等[29]报道了12例IPN患者行腹膜后入路视频辅助下小切口坏死组织清除术,术后腹腔出血5例、结肠瘘3例,其原因可能与其过早的外科干预有关,其中7例患者在起病4周内手术,甚至4例患者在起病1周内进行手术;另外可能与术中使用卵圆钳损伤有关,清除大块清除坏死组织时,可能损伤坏死组织中未机化的血管导致出血。而本研究患者手术均在发病4周之后,在清创过程避免了盲目钳夹,先运用手指轻柔地钝性分离和正压脉冲水枪灌洗等方式,在冲出脓液显露视野的同时,使得“干性”坏死组织松动,然后在内镜直视下进行运用卵圆钳或肾镜抓钳夹取坏死组织,在直视下能减少盲目钳夹带来的损伤。在完成清创后再运用内镜仔细检查创面,若有活动性出血,运用电凝、缝合及夹闭等方式处理,尤其是血管残端处理时需更为谨慎。本研究9例患者术后分别只出现1例腹腔出血和1例肠瘘,并且从近期小切口入路手术报道来看,高效清除坏死组织同时,并未明显增加其术后近期并发症的发生率,但目前只有少数单中心经验,还缺乏进一步高质量的对照研究,从目前安全性及有效性来看,值得进一步推广[16,19,28]。
3.4 小切口联合内镜微创手术经验总结
笔者团队在运用小切口联合内镜微创手术治疗IPN过程中积累了一些经验,总结以下几项要点:⑴ 重视术前CT评估:术前精细阅片判断坏死感染脓腔部位、大小及范围,脓腔是否分隔,脓腔与周围组织脏器位置关系,坏死组织液化程度;评估是否适合行小切口联合内镜微创手术及选择合适的手术途径。根据孙备等[30]IPN分型:I型(中央型)脓腔主要位于小网膜囊及其周围间隙;Ⅱ型(外周型):局限于两次肾-结肠区域及盆腔区域;Ⅲ型(混合型):I型与Ⅱ型相结合。I型选择经腹腔小网膜囊入路途径、Ⅱ型选择经腹膜后入路途径、Ⅲ型选择两者联合途径。⑵ 术前行PCD:路穿刺路径允许情况下建议行多点穿刺,不仅能改善引流效果,而且在行手术治疗时可作为指引路标。⑶ 合理运用“升阶梯”策略:尽可能将外科干预时间延长至起病4周以后。⑷ 联合运用各项内镜技术优势:肾镜操作简单,清创效率高,因此手术过程中可先常规使用肾镜辅助下清除脓腔中央简单易清除的坏死组织;但肾镜为硬镜,当脓腔扭曲、深在时,存在一定盲区,从而影响总体清创效果,因此可以利用胆道镜的可弯曲性,软硬结合提高清除效率。⑸ 避免腹腔污染:进行经腹腔小网膜囊入路手术时,打开脓腔后,尽快将脓腔壁或周围韧带组织与切口处壁层腹膜缝合固定,隔绝腹腔,避免腹腔脏器感干扰和腹腔污染。⑹ 保持术后引流通畅:小切口联合内镜微创手术尽管清创高效彻底,但无法完全清除脓腔内坏死组织,且新生坏死组织不断形成,因此通畅引流也至关重要。引流管尽可能在脓腔内交错放置,从不同方向引出,建立一个术后贯通式冲洗系统;术后生理盐水持续低流量冲洗脓腔,冲洗过程密切观察引流管引流情况,若引流管出现引流不畅或堵管时,可用注射器手动冲洗引流管,必要时更换引流管。
综上所述,小切口联合内镜微创手术结合了多种微创技术优点,很好地平衡了清创效率和手术创伤之间的矛盾,在高效彻底清除坏死组织的同时,也保障患者的手术安全性,值得进一步推广。
利益冲突:所有作者均声明不存在利益冲突。
