活血清解汤对重症急性胰腺炎大鼠肠道免疫屏障功能的影响及机制
2022-10-12梁超汪扬刘新博李善宝
梁超,汪扬,刘新博,李善宝,2
(1.上海中医药大学附属岳阳中西医结合医院 肝胆胰外科,上海 200437;2.上海交通大学医学院附属上海市第一人民医院普通外科,上海 200080)
重症急性胰腺炎(severe acute pancreatitis,SAP)为临床上常见的急腹症,是急性胰腺炎的一个亚型,与多器官功能衰竭及全身炎症反应综合征相关,严重者危及生命[1-2]。SAP患者易并发肠道屏障功能障碍,而小肠巨噬细胞的M1/M2型极化参与肠黏膜的免疫调节过程,但机体机制仍有待深入研究[3-4]。
M1型巨噬细胞活化后可分泌肿瘤坏死因子α(tumor necrosis factor α,TNF-α),并表达特征及标识分子诱生型一氧化氮合成酶(inducible nitric oxide synthase,iNOS),而iNOS基因上存在着核因子κB(nuclear factor κB,NF-κB)调控位点,NF-κB可调节iNOS的表达[5]。抗炎症因子IL-4参与调节SAP炎症反应过程,而M2型巨噬细胞活化后分泌IL-4,可减轻M1型巨噬细胞引起的炎症反应[5-6];其亦可产生精氨酸酶1(arginase-1,Arg-1),使清道夫受体表达上调,导致产生一氧化氮(nitric oxide,NO)及IL-12的能力下降,因此将表达的Arg-1及IL-4作为M2分化的证据[7],同时过氧化物酶增殖物激活受体γ(peroxisome proliferater activated receptor γ,PPAR-γ)是M2巨噬细胞活化过程中的重要转录因子[8]。肿瘤坏死因子α诱导蛋白8样分子2(tumor necrosis factor-α-induced protein 8 like 2,TIPE2)属于TNFAIP8家族成员,是天然免疫和获得性免疫反应的负向调控因子;在巨噬细胞中,TIPE2高表达可调控NF-κB信号途径,可抑制M1巨噬细胞的分化。在T淋巴细胞中可负向调节T细胞受体及Toll样受体的活化,阻止严重炎症性疾病的发生与发展,进而对维持免疫的稳态起到重要作用[9-11]。笔者前期研究发现活血清解汤可缓解SAP的炎症反应,但是对肠道屏障免疫功能的影响不清,其对巨噬细胞的极化更需深入研究。
本研究利用牛磺胆酸钠构建大鼠SAP模型,使用中药活血清解汤研究其对大鼠胰腺及肠道炎症的反应情况,并通过体外实验,进一步探讨活血清解汤对肠巨噬细胞分化的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验细胞、动物及器械 大鼠小肠巨噬细胞株购于中科院上海细胞库。SPF级别雄性SD大鼠200~230 g,由上海中医药大学附属岳阳中西医结合医院动物实验中心提供,动物房为SPF级,环境:恒温26 ℃、恒湿45%~55%、12 h光照和12 h黑夜交替,自由进食标准颗粒饲料和饮水,整个实验过程中对大鼠的处理符合动物伦理学标准,实验伦理注册号:YYLAC-2021-118。实验器械,剪刀、镊子等(购自上海金钟器械厂),手术缝线、注射器等(购自上海浦东金环医疗用品有限公司),微泵注射装置由上海中医药大学附属岳阳中西医结合医院肝胆胰外科提供。
1.1.2 实验药物、试剂及仪器 活血清解汤:上海中医药大学附属岳阳中西医结合医院制剂室提供,主要成分有丹参12 g、赤芍9 g、大黄15 g、枳实12 g、芒硝6 g、柴胡12 g、桃仁12 g、黄连9 g、黄芩等9 g,浓煎后相当于生药1 g/mL,每毫升相当于含生药1 g。牛磺胆酸钠(Sigma,美国),用生理盐水配成5%溶液。2%戊巴比妥由动物实验中心提供。DMEM培养基(SH30022.01B,Hyclone,美国),PBS(GNM20012,吉诺生物,中国),胰酶(碧云天,中国),青链霉素双抗(C0222,碧云天,中国),胎牛血清(FBS)(26010074,Gibco,美国),TRIzol(15596018,Invitrogen,美国),引物(上海生工生物科技有限公司,中国),Prime ScriptTMRT Reagent Kit(RR047A,TakaRa,日本),SYBR®Premix Ex TaqTM(RR820A, TakaRa,日本),CCK-8试剂盒(C0037,碧云天,中国),RIPA裂解液(P0013C,碧云天,中国),BCA蛋白浓度测定试剂盒(P0012S,碧云天,中国),2×SDS-PAGE蛋白上样缓冲液(P0015B,碧云天,中国),SDS-PAGE凝胶配制试剂盒(P0012A,碧云天,中国),ECL发光试剂盒(P0018FS,碧云天,中国),预染蛋白Marker(LC5615,Thermo Fisher,美国),GAPDH(ab9485,Abcam,英国),PPARγ抗体(ab178860,Abcam,英国),IL-4(12227S,CST,美国),TIPE2(53842S,CST,美国),Arg1(93668T,CST,美国)、NF-κB(8242T,CST,美国),iNOS(80517-1-RR,Proteintech,美 国)、TNFα抗体(17590-1-AP,Proteintech,美国)。大鼠血清淀粉酶(CSB-EL001689RA,华美生物,中国),大鼠血脂肪酶(CSB-E13784r,华美生物,中国),IL-4(CSB-E04635r,华美生物,中国)及TNFα(CSB-E11987r,华美生物,中国)的ELISA试剂盒。普通PCR仪(BIO-RAD,美国),实时荧光定量(BIO-RAD,美国),多功能酶标仪(BIORAD,美国),转膜仪(BIO-RAD,美国),电泳仪(BIO-RAD,美国),化学发光凝胶成像分析系统(BIO-RAD,美国)。
1.2 实验方法
1.2.1 SAP模型建立及实验分组 ⑴ 模型制备:所有大鼠术前禁食12 h,禁水4 h。2%戊巴比妥钠(30 mg/kg)腹腔注射麻醉。用微量泵通过胰管逆行以1 mL/kg的剂量持续匀速输入5%的牛磺胆酸钠,速度为0.06 mL/min,输注时间5 min建立SAP模型[3,12]。⑵ 动物分组:假手术组是麻醉后开腹扰动胰组织后关腹,腹腔注射生理盐水0.2 mL每只。治疗组用活血清解汤灌胃,每20 mL/kg,每6 h灌胃1次。非治疗组及治疗组分别在6 h及12 h,用2%戊巴比妥钠腹腔内注射麻醉,开腹经腹主动脉注射器采血并处死动物,动脉血静置30 min后离心(3 500 r/min,5 min),收集上清液置于-80 ℃冰箱中冻存用于后续生化检测。⑶ 细胞实验分组:将大鼠小肠巨噬细胞分别用活血清解汤(活血清解汤组)、牛磺胆酸钠(牛磺胆酸钠组),牛磺胆酸钠+活血清解汤(牛磺胆酸钠+活血清解汤组)处理,以无处理的大鼠小肠巨噬细胞为空白对照组,共培养24 h。活血清解汤颗粒溶解于DMSO,并用细胞滤网过滤清除杂质及微生物,收集各组培养基上清液、细胞进行备用(已有相关实验采用牛磺酸胆盐刺激巨噬细胞的实验模型[13-14])。
1.2.2 CCK-8实验 大鼠小肠巨噬细胞细胞培养后,制备细胞悬液,细胞计数,稀释后在96孔板中接种待测细胞悬液,每孔约5×103个细胞100 μL细胞悬液,种3个复孔。置于37 ℃培养箱中培养,细胞接种后贴壁大约需要培养6 h。加入不同浓度梯度的牛磺胆酸钠或者活血清解汤(药物采用40 μm无菌过滤器过滤),其中牛磺胆酸钠浓度设定根据相关文献及说明书设置成(1~128 μmol/L相关浓度梯度)[13-14],活血清解汤根据前期实验设置成(1~64 g/mL相关浓度梯度),37 ℃培养箱中培养24 h,每孔加入10 μL CCK-8,培养1.5 h,后测定450 nm吸光度。
1.2.3 实时荧光定量PCR 使用TRIzol试剂从培养的大鼠巨噬细胞中提取总RNA,根据TaKaRa逆转录试剂盒操作说明,建立逆转录反应体系,合成cDNA。反转录后进行荧光定量PCR扩增,反应条件为50 ℃ 2 min,95 ℃ 2 min,95 ℃ 15 s,60 ℃60 s,40个循环,72 ℃延伸7 min,最后降至4 ℃结束反应。以检测NF-κB、iNOS、TNF-α、Arg-1、IL-4、TIPE2、PPAR-γ和GAPDH表达的表达水平,其中GAPDH被用作内参。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.2.4 Western blot 细胞置于蛋白裂解液中,制备组织匀浆,提取大鼠巨噬细胞中总蛋白质。根据BCA蛋白测定试剂盒的制造商说明书,测定所提取样品的蛋白质浓度。取20 μg蛋白进行10% SDSPAGE电泳,转膜,5%脱脂牛奶37 ℃封闭1 h后,加入一抗iNOS(1∶1 000)、TNF-α(1∶1 000)、NF-κB(1∶2 000)、Arg-1(1∶1 000)、IL-4(1∶1 000)、TIPE2(1∶1 000)、PPAR-γ(1∶1 000)和GAPDH(1∶2 000),4 ℃孵育过夜。洗膜3次后,加二抗(抗兔/鼠1:5 000),37 ℃孵育2 h。洗膜3次后,加入ECL试剂,机器显影。
1.2.5 ELISA实验 按照检测试剂盒说明书,对大鼠的血淀粉酶、血脂肪酶、IL-4和TNF-α水平进行测定。
1.2.6 组织病理学观察 取胰腺及小肠组织,切取0.5 cm×0.4 cm×0.3 cm大小组织块,10%中性福尔马林固定,自动脱水机逐级酒精脱水,二甲苯透明,包埋、4 μm切片,HE染色,显微镜观察组织的病理变化。依照Schmidt病理评分标准[15]对各组胰腺进行改良评分,从胰腺水肿、坏死、炎症细胞浸润等方面对染色结果进行评定,分为5个等级,以1、2、3、4、5分进行标记。以Chiu病理评分[16]为基础对肠黏膜、固有层及腺体等组织炎症病理进行改良评分,包括肠绒毛、水肿、出血、炎症、坏死、溃疡等方面进行评分,小肠黏膜损伤程度评分:0~5分,每段小肠观察10个视野,评分总和为小肠黏膜病理评分[17-18]。
1.3 统计学处理
所有数据统计分析均使用SPSS软件(版本22.0)进行,所有条形图中的误差条表示指定的SD或SEM,数据符合正态分布的计量资料,两组间采用t检验,组间多重比较采用F检验,P<0.05被认为差异有统计学意义。
2 结 果
2.1 动物实验各组TNF-α和IL-4、血清淀粉酶及血脂肪酶水平比较
与假手术组比较,模型组术后6、12 h的TNF-α表达量增加(均P<0.05),而治疗组后6、12 h的TNF-α表达量明显低于相同时间段的非治疗组(均P<0.05),且治疗组的TNF-α表达量明随时间延长明显降低(P<0.05)(图1A)。与假手术组比较,模型组术后6 h的IL-4表达量增加不明显(P>0.05),而治疗组术后6 h的IL-4表达量明显高于假手术组与模型组(均P<0.05),且随着治疗时间延长治疗组IL-4表达水平明显升高(P<0.05)(图1B)。在相同时间段的血清淀粉酶及脂肪酶水平,治疗组明显低于相同时间段的模型组(均P<0.05)(图1C-D)。
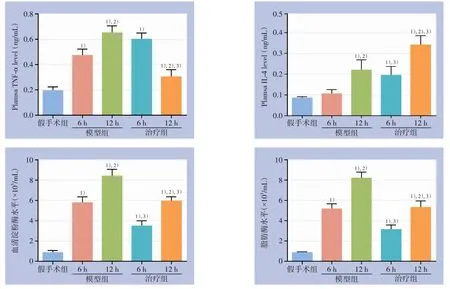
图1 各组血清中TNF-α、IL-4、血清淀粉酶及脂肪酶水平比较 1)与假手术组比较,P<0.05;2)与同组6 h比较,P<0.05;3)与模型组同时间点比较,P<0.05Figure 1 Comparison of the serum levels TNF-α, IL-4, amylase and lipase among groups 1) P<0.05 vs.sham operation group; 2) P<0.05 vs.the 6-h value in the same group; 3) P<0.05 vs.the value of the same time point in model group
2.2 各组胰腺及肠道组织HE染色以及病理结果
HE染色结果显示:假手术组胰腺组织无水肿、充血和胰腺坏死,镜下胰腺腺泡排列规则,腺管形态正常,无明显充血、坏死和炎性浸润,且胰岛结构完整;肠道上皮及绒毛未见明显损伤,无充血及水肿,未见炎症细胞浸润。与手术组比较,模型组与治疗组术后6、12 h的胰腺组织均有出血,腺泡细胞肿胀、坏死,小叶结构紊乱,叶间隙增宽,间质内有炎性细胞浸润等病理改变;小肠组织可见更多的炎性细胞浸润弥散、小肠绒毛断裂及脱落、腺体肿胀、出血灶形成,甚至固有层崩解。模型组胰腺与小肠的病理改变随时间延长而逐渐加重,治疗组胰腺与小肠的病理改变随时间延长而逐渐减轻(图2)。各组胰腺与小肠组织的病理学评分差异均有统计学意义(均P<0.05)(表2)。
表2 各组胰腺和肠道组织病理学评分比较(±s)Table 2 Comparison of pathological score of pancreas and intestine issue among three groups (±s)

表2 各组胰腺和肠道组织病理学评分比较(±s)Table 2 Comparison of pathological score of pancreas and intestine issue among three groups (±s)
注:1)与假手术组比较,P<0.05;2)与同组6 h比较,P<0.05;3)与模型组同时间点比较,P<0.05Notes:1) P<0.05 vs.sham operation group; 2) P<0.05 vs.the 6-h value in the same group; 3) P<0.05 vs.the value of the same time point in model group
组织胰腺小肠假手术组1.56±0.32 2.63±0.49模型组6 h 10.24±1.571)15.41±1.521)12 h 14.72±1.391),2)27.53±2.771),2)治疗组6 h 12.85±1.691),3)18.49±2.141),3)12 h 9.26±1.311),2),3)10.17±1.241),2),3)
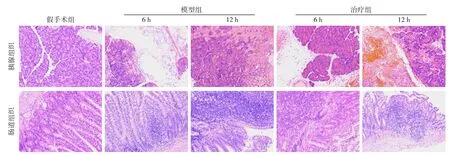
图2 各组大鼠胰腺和肠道组织病理学改变(HE×200)Figure 2 The histopathological changes of the pancreatic and intestinal tissues (HE×200)
2.3 各组大鼠小肠组织与M1/M2巨噬细胞相关标志基因iNOS、Arg-1的表达
Western blot及qRT-PCR结果显示,与假手术组比较,模型组12 h组的iNOS表达量明显增加(P<0.05),而治疗组的iNOS表达量明显低于相同时间段的非治疗组(均P<0.05)。与假手术组比较,模型组6 h的Arg-1表达量明显下降(P<0.05),而12 h的Arg-1表达量明显增加(P<0.05),治疗组Arg-1表达量明显高于假手术组与模型组6 h的表达了(均P<0.05),且随着治疗时间延长Arg-1表达水平明显升高(P<0.05)(图3)。

图3 Western blot及qRT-PCR检测各组大鼠小肠组织iNOS、Arg-1基因的表达 1)与假手术组比较,P<0.05;2)与模型组同时间点比较,P<0.05Figure 3 The expressions of iNOS and Arg-1 in small intestine among groups of rats detected by Western blot and qRT-PCR 1) P<0.05 vs.sham operation group; 2) P<0.05 vs.the value of the same time point in model group
2.4 大鼠肠巨噬细胞相关基因表达
利用CCK-8实验,按照相应的浓度梯度,加入大鼠巨噬细胞培养液中进行检测,发现牛磺胆酸钠对大鼠小肠巨噬细胞的IC50浓度为6 μmol/L(图4);活血清解汤对大鼠小肠巨噬细胞的IC50浓度为6.8 g/mL(图4)。

图4 CCK-8检测牛磺胆酸钠与活血清解汤对大鼠小肠巨噬细胞的IC50浓度Figure 4 IC50 values of sodium taurocholate and HXQJ decoction on rat intestinal macrophages determined by CCK-8 assay
体外实验中,牛磺胆酸钠与活血清解汤均采用各自IC50浓度。Western blot及qRT-PCR结果显示,与空白对照组及活血清解汤组比较,牛磺胆酸钠组NF-κB、iNOS及TNF-α蛋白及mRNA表达水平明显上升(均P<0.05),而Arg-1、IL-4、TIPE2及PPAR-γ蛋白及mRNA表达水平无明显统计学差异(均P>0.05);与空白对照组比较,活血清解汤组Arg-1、IL-4、TIPE2及PPAR-γ蛋白及mRNA表达水平明显升高(均P<0.05),而NF-κB、iNOS及TNF-α蛋白及mRNA表达无明显变化(均P>0.05);与牛磺胆酸钠组比较,牛磺胆酸钠+活血清解汤组的NF-κB、iNOS及TNF-α蛋白及mRNA表达水平明显下降(均P<0.05),而Arg-1、IL-4、TIPE2及PPAR-γ蛋白及mRNA表达水平明显增加(均P<0.05)(图5-6)。

图5 Western blot检测各组细胞NF-κB、iNOS、TNF-α、Arg-1、IL-4、TIPE2及PPAR-γ蛋白表达 1)与空白对照组比较,P<0.05;2)与牛磺胆酸钠组比较,P<0.05Figure 5 The protein expressions NF-κB, iNOS, TNF-α, Arg-1, IL-4, TIPE2 and PPAR-γ in each group of cells determined by Western blot 1) P<0.05 vs.blank control group; 2) P<0.05 vs.sodium taurocholate group

图6 qRT-PCR检测各组细胞的NF-κB、iNOS、TNF-α、Arg-1、IL-4、TIPE2及PPAR-γ mRNA表达 1)与空白对照组比较,P<0.05;2)与牛磺胆酸钠组比较,P<0.05Figure 6 The mRNA expressions NF-κB, iNOS, TNF-α, Arg-1, IL-4, TIPE2 and PPAR-γ in each group of cells determined by qRT-PCR 1) P<0.05 vs.blank control group; 2) P<0.05 vs.sodium taurocholate group
3 讨 论
急性胰腺炎是临床上一种常见的急腹症,特征是胰腺水肿、出血、坏死等。其中约1/5的患者并发SAP,不仅会导致严重的急性胰腺损伤,还易引起全身炎症反应综合征,甚至是多器官功能障碍综合征[3]。在SAP早期,机体促炎与抗炎调节机制失衡,引起炎症过度反应,导致胰腺局部及外组织损伤[19]。肠道是全身炎症反应的一个重要靶器官,可防止肠道内的细菌及毒素等有害物质穿透肠壁,在维护机体内部环境的稳定方面发挥重要作用[20]。SAP早期时易并发肠道屏障功能障碍,引起的肠道菌群异位、肠源性感染以及内毒素血症可进一步加重SAP[21]。其中单核巨噬细胞系统被激活,TNF-α等促炎细胞因子链启动后,引起炎症介质级联样反应,加重肠黏膜损伤,导致肠道屏障功能障碍[22-23]。
在本研究中,利用牛磺胆酸钠构建大鼠SAP模型,血淀粉酶、脂肪酶及病理学结果提示成功构建,与相关报道相似[3,24]。同时发现活血清解汤能减轻SAP大鼠的炎症反应程度,促炎症因子TNF-α释放减少,抗炎因子IL-4释放增多,降低血清淀粉酶及脂肪酶水平。活血清解汤可降低临床急性胰腺炎患者血清炎性细胞因子水平,提高超氧化物歧化酶活性,清除氧自由基,改善症状,提高疗效[25]。临床研究[26]发现活血清解汤配合西医常规疗法治疗急性胰腺炎,患者的排气及通便时间、腹胀及腹痛缓解时间、体温恢复正常及住院时间明显优于西医常规疗法。本中心前期研究[27]发现活血清解汤改善SAP患者血液流变学,控制D-二聚体的升高,维持血栓素A2及前列环素I2之间的平衡,起到治疗SAP作用。因此,活血清解汤在急性胰腺炎及SAP中均发挥积极作用,可有效缓解炎症反应程度。而SAP易引发肠道屏障功能障碍,活血清解汤是否对肠道黏膜免疫屏障的具有保护作用及其中机制尚不清楚,有待深入研究。
巨噬细胞分M1型和M2型,肠巨噬细胞由血液中的单核细胞骨髓造血干细胞及胸腺内早期T淋巴细胞分化而来,主要分布于肠黏膜下的固有层中,占人体巨噬细胞的绝大多数,参与炎症反应[28]。在健康肠道环境中,肠道巨噬细胞以M2型为主;而在炎症期间,单核细胞被招募到肠道固有层并成为炎性巨噬细胞,分泌促炎症细胞因子,推动炎症反应,表现出M1型[29]。M1型巨噬细胞的特征是分泌细胞因子的能力增强,可被TNF-α活化,活化后不仅能正反馈分泌促炎症细胞因子,如TNF-α、IFN-γ、IL-1β及IL-6等杀伤感染性病原体,还能表达M1型巨噬细胞一个重要的特征及标识分子iNOS,产生NO,产生NO的巨噬细胞在炎症发病机制中发挥作用,而NF-κB是其活化的重要转录因子[30-32]。M2型巨噬细胞有抗炎和免疫调节作用,可表达抗炎细胞因子如IL-4和转化生长因子β(transforming growth factor β,TGF-β)等,降低炎性细胞因子水平,从而下调M1型巨噬细胞引起的炎症反应。同时M2型巨噬细胞能诱导产生Arg-1,使清道夫受体表达上调,产生NO和IL-12的能力下降,可将表达Arg-1及IL-4作为M2型巨噬细胞分化的证据,其中PPAR-γ是其活化的重要转录因子[29,31]。本研究建立的大鼠SAP模型提示,术后6 h的TNF-α表达水平明显增高,而IL-4表达水平偏低;随着SAP进程延长,术后12 h IL-4表达水平明显增加。以上提示早期SAP可能由M1巨噬细胞表型占优势,后期M2型巨噬细胞抗炎发挥积极作用。但对SAP大鼠使用活血清解汤后,术后6 h的TNF-α表达水平较未使用组明显降低,且IL-4表达水平升高,在术后12 h趋势更加明显,这提示活血清解汤可能促进SAP大鼠肠黏膜巨噬细胞由M1型巨噬细胞表型转化为M2型。
巨噬细胞在免疫反应中的表型具有可塑性,随着微环境刺激的改变,进而改变其生理特性,遵循不同的激活途径;M1型巨噬细胞首先出现在炎症发生早期,针对刺激释放多种炎症介质,以推动炎症反应;而过度过量的炎症反应会导致机体损伤加重,M2型巨噬细胞在炎症后期释放抗炎介质,抑制炎症反应,维持内环境稳定。因此根据他们所接受的微环境刺激不同,巨噬细胞可遵循不同的激活途径,在不同组织甚至同一组织中呈现的表型以及功能也具有差异性[28]。
为了进一步探讨肠巨噬细胞在炎症中表型变化,本研究在体外实验中发现牛磺胆酸钠刺激肠巨噬细胞后,TNF-α、iNOS及NF-κB表达水平明显升高,说明牛磺胆酸钠可介导肠巨噬细胞的炎症反应。活血清解汤加入肠巨噬细胞后TNF-α、iNOS及NF-κB表达水平较单独牛磺胆酸钠刺激组明显降低,而Arg-1、IL-4、TIPE2及PPAR-γ表达水平升高,这提示活血清解汤一定程度上能促进大鼠肠黏膜巨噬细胞由M1型巨噬细胞表型转化为M2型。
但笔者观察到在单独活血清解汤刺激这种趋势相对于体内实验不是很明显,猜测原因如下:由于炎症反应是一个复杂的级联过程,除了巨噬细胞外还有其他多种免疫细胞参与,因此笔者体外的模拟实验相对来说比较简单。由于条件所限,需要将来对活血清解汤在急性胰腺炎中的作用机制进行更加深入的研究。但结果也能一定程度上说明活血清解汤可介导大鼠肠黏膜表型的转化,调节肠黏膜的免疫屏障功能,减轻大鼠SAP的炎症反应程度。这也为治疗及预防SAP提供新的思路。
综上所述,本研究结果表明活血清解汤可能通过调节SAP大鼠中的小肠巨噬细胞,由M1型转化成M2型,缓解炎症反应,这也为研究活血清解汤的作用机制提供新的思路。
利益冲突:所有作者均声明不存在利益冲突。
