胰腺癌患者预后预测动态在线列线图的构建及应用
2022-10-12施华清柴长鹏陈洲董仕何茹秦子顺周文策
施华清,柴长鹏,陈洲,董仕,何茹,秦子顺,周文策,4
(1.兰州大学第二临床医学院,甘肃 兰州 730030;2.兰州大学第一临床医学院,甘肃 兰州 730000;3.兰州大学口腔医学院,甘肃 兰州 730000;4.兰州大学第二医院 普通外科,甘肃 兰州 730030)
胰腺癌高度恶性,在全球范围内是第十二位最常见的癌症,是癌症相关性死亡的第七大原因[1-2]。2022年,在美国胰腺癌是继肺癌、前列腺癌或乳腺癌及结直肠癌之后的第四大癌症死亡原因[2-4]。胰腺癌,尤其是胰腺导管腺癌(占胰腺癌的90%以上),由于其高度恶性,5年生存率低于10%[4-5]。约80%的胰腺癌在发现时已是局部晚期或有远处转移,并失去手术机会[6]。只有15%~20%的胰腺癌患者被诊断在手术可切除阶段,手术切除是目前唯一可能治愈的治疗方法[7];然而,即使切除后,由于远处转移和局部复发的频率较高,5年生存率也不足20%[8]。目前,胰腺癌的预后在过去20年中基本没有变化[9]。因此急需进一步对胰腺癌进行研究,以探究其发病机制、诊断标志物、药物治疗靶点和构建临床实用的预后预测模型。
目前,在临床上对于预测胰腺癌患者预后还主要依靠美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期系统。然而,一些影响预后因素,如年龄、肿瘤大小、肿瘤位置和病理类型等,并没有包括在分期系统中[10]。因此具有一定的局限性,尤其在预测个体预后方面效果不佳。所以,构建个性化的便捷预测模型至关重要。
列线图是一种新型可视化多变量模型,能够整合多个与预后相关变量[11]。此外,列线图能够可视化显示预后结果,并根据肿瘤患者的个体差异和疾病特征指导个性化治疗[12]。Ma等[13]利用1973—2015年间SEER数据库中远处转移的胰腺导管腺癌患者的临床数据,结合婚姻状况、年龄、分级、肿瘤大小、原发部位手术、转移灶和淋巴结手术等变量,构建了预测总生存期(overall survival,OS)的列线图。Zhang等[14]从SEER数据库中筛选2010—2016年胰腺癌骨转移患者,构建了预测胰腺癌骨转移患者预后OS的预测模型。虽然列线图预测模型的作用已在多种癌症中得到验证[15-17],但尚未对其在胰腺癌患者中的应用进行充分的研究,而基于网络的列线图更便于临床实际使用,因此,本研究旨在建立一个实用的基于Cox回归模型的动态在线列线图,预测常用的临床预后指标对胰腺癌患者1、3、5年OS的影响,并利用SEER数据库的大样本数据对模型进行验证。
1 资料与方法
1.1 数据提取
SEER数据库(http://seer.cancer.gov)是一个使用广泛、可靠的公开癌症数据库,覆盖了约28%的美国人口[18]。本研究在SEER数据库中检索原发部位在胰腺,组织学病理确断为胰腺癌的阳性患者,并具有完整的年龄、种族、性别、肿瘤分期、肿瘤大小和治疗等数据,以及具有完整有效的随访记录。胰腺癌的临床病理数据使用SEER*Stat 8.3.9.2版软件。纳入标准:⑴ 原发部位位于胰腺,病理确诊为阳性;⑵ 组织学类型(ICD-O-3组织/行为)为恶性肿瘤;⑶ 拥有完整有效的随访和生存数据。排除标准:⑴ 肿瘤分级和TNM分期未知;⑵ 手术情况未知;⑶ 生存时间未知或生存月数为零;⑷ 病例来源于尸检和只有死亡报告上的病例;⑸ 肿瘤大小未知。最终,根据纳入标准和排除标准在SEER数据库中进行样本筛选。
1.2 变量特征和生存数据
患者的临床病理数据包括以下变量:年龄、性别、种族、AJCC分期[临床分期、TNM分期(参考第7版)]、肿瘤大小和组织学分期、是否进行了手术、是否进行了放疗和化疗、生存时间(月)和生存状态。结合SEER数据库样本情况,根据胰腺癌的临床上的发病情况,按年龄分为4组(<45岁、45~64岁、65~74岁、≥75岁),构建基于Cox回归的分析。其中,对放疗情况不明的放疗患者纳入到无放疗组。本研究中分析的终点事件是由生存状态和生存月数得出的OS,从胰腺癌初步诊断时开始计算,到最后一次随访或死亡为止[19]。在SEER数据库中,存活时间少于1个月的患者被编码为零[20-21]。
1.3 统计学处理
将肿瘤大小分为4组(1 cm、1.1~2 cm、2.1~4 cm、>4 cm),转化为分类变量。计数资料采用例数(百分比)[n(%)]形式表示,组间比较采用χ2检验;使用SPSS 22.0软件构建Cox比例危险回归模型进行单因素和多因素生存分析,并选择出与生存结果相关的独立预后因素。这些独立的预后因素被用于构建列线图,以预测胰腺癌患者的1、3、5年的OS。本研究中的列线图由训练集构建,并在训练集和验证集中进行验证。计算时间依赖性ROC曲线下的面积(AUC)和C-指数,并绘制校准曲线,以评估模型的预测能力,使用决策曲线分析(decision curve analysis,DCA)评估列线图在决策中的效用[22]。根据列线图将患者分为高风险组和低风险组,并使用Kaplan-Meier曲线绘制两组的生存曲线。分析使用的R软件包(tableone、plyr、tidyverse、survcomp、DynNom、car、pRoc、survminer、dcurves、dplyr、rms、Hmisc、survival、formula、ggplot2、rmda、time ROC and foreign),通过R 4.0.3(http://www.r-project.org)加载;P<0.05为差异有统计学意义。
2 结 果
2.1 临床病理和人口统计学特征
经过严格筛选,从SEER数据库中共检索出12 175例符合条件的胰腺癌患者。按照7∶3的比例,8 522例患者被随机分配到训练队列,3 653例患者被随机分配到验证队列。所有变量的分布在两组之间是相似的,差异无统计学意义(均P>0.05)(表1)。在总样本的4个年龄组中,45~64岁的患者占39.0%,次之为65~74岁间的患者占32.7%,另两个年龄组患者所占比例<30%。男性患者占51.2%,女性占48.8%。大多数为白人78.7%(n=9 579),次之为黑人占12.7%,其他种族所占比例较少。57.2%位于胰腺头部,其次为胰腺体尾部(29.5%)。42.5%为中度分化的Ⅱ级,次之为低分化占33.9%,2%为Ⅳ级未分化所占比例最少。54.3%为AJCC Ⅱ期患者,其次为Ⅳ期患者占21.9%,Ⅱ期患者所占最少,为6.9%。TNM分期以T3为主占59%(n=7 181),T1和T2相近,分别为10.1%和12.1%,N0和N1相近,分别为48.6%和49.7%。78.1%的患者处于M0期,远处转移患者较少,占比为21.9%。49.6%的肿瘤大小为2.1~4 cm,其次为>4 cm为33.1%,≤1 cm者最少(3.5%)。在治疗方面,70.2%患者接受了手术治疗,未手术患者占比29.8%;22.8%胰腺癌患者接受了放疗,大部分未放疗或放疗情况不清;59.6%患者接受了化疗。
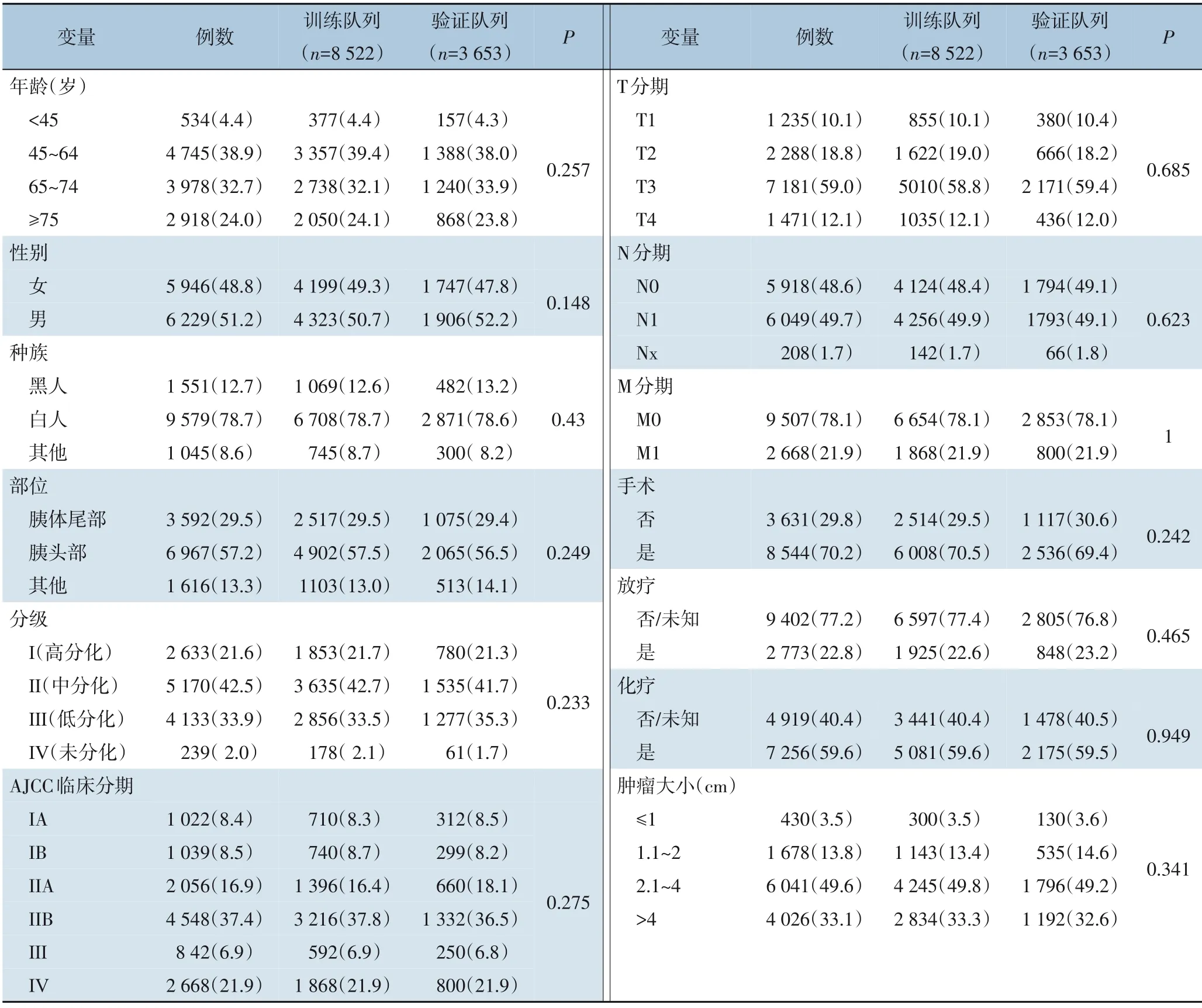
表1 12 175例胰腺癌患者的人口统计学和临床数据[n(%)]Table 1 Demographic and clinical data of the patients with 12 175 pancreatic cancers [n (%)]
2.2 鉴定预后变量
单因素Cox回归分析显示,年龄、种族、肿瘤原发部位、肿瘤分化程度、AJCC临床分期、TNM分期、手术、化学治疗和肿瘤大小等因素与胰腺癌患者的OS密切相关(均P<0.05)。由于与TNM分期潜在的相关性,AJCC临床分期被排除在多因素Cox分析之外,以避免因素之间的多重共线性影响。多因素Cox回归分析结果显示,年龄、原发肿瘤部位、分化等级、T分期、N分期、M分期、肿瘤大小、手术和化疗是OS的独立预后因素(均P<0.05)(表2)。
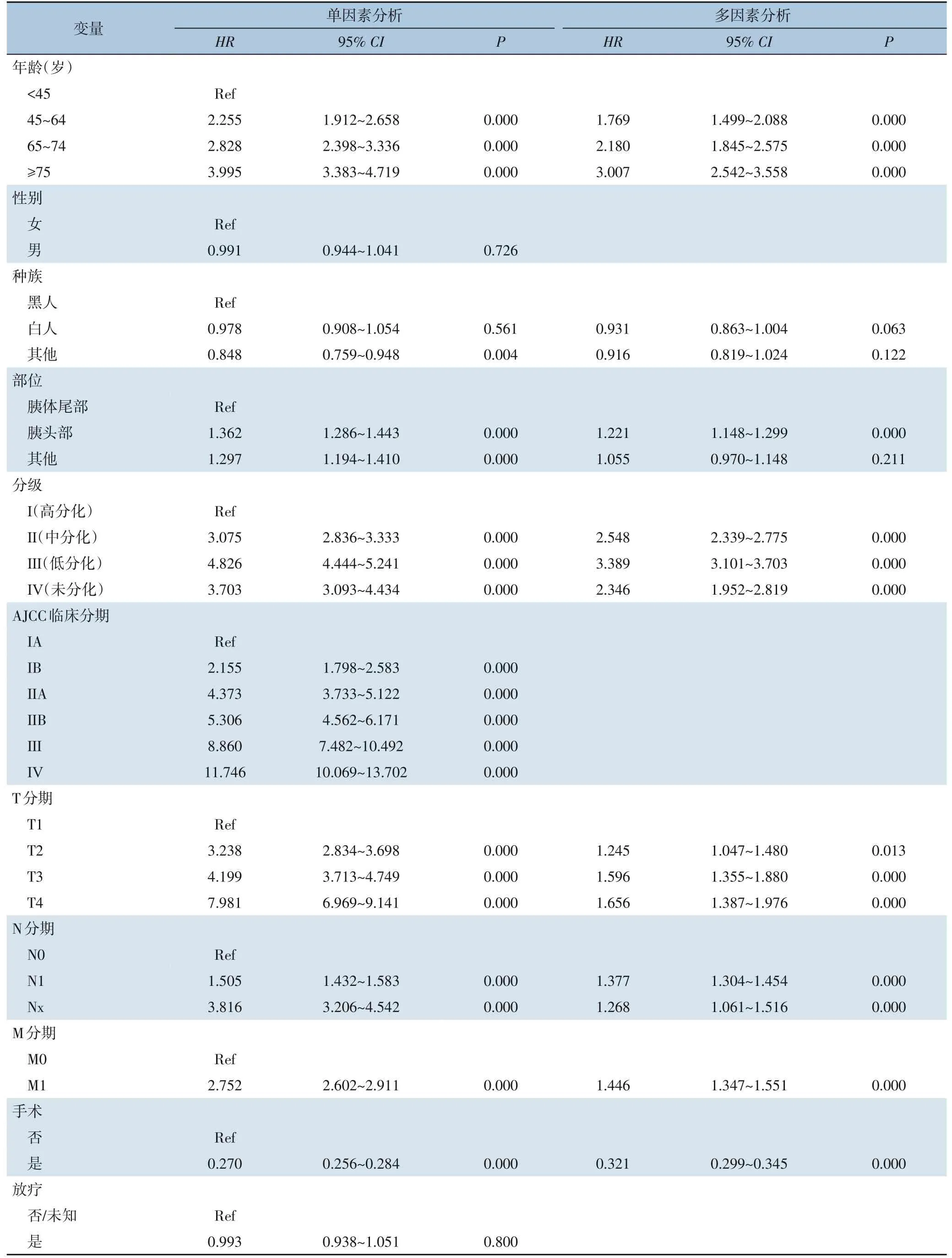
表2 胰腺癌患者OS的单因素和多因素Cox回归分析Table 2 Univariate and multivariate Cox regression model of OS in pancreatic cancer patients
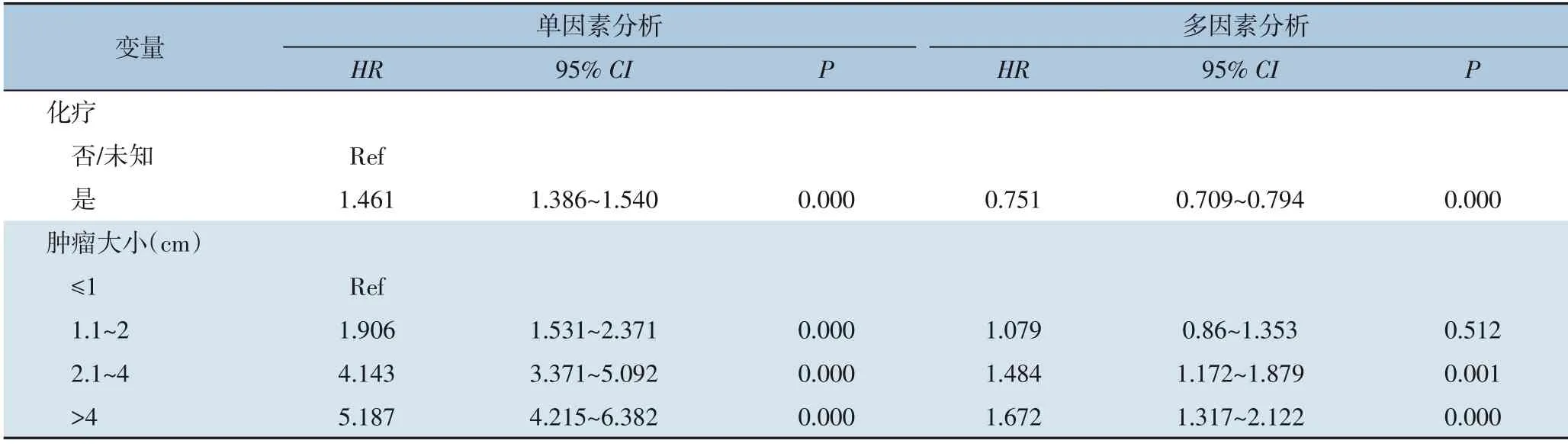
表2 胰腺癌患者OS的单因素和多因素Cox回归分析(续)Table 2 Univariate and multivariate Cox regression model of OS in pancreatic cancer patients (continued)
2.3 构建预后列线图
根据多因素Cox分析选择出的独立预后因素构建了OS的列线图。列线图显示,组织分化等级对预测胰腺癌患者的OS贡献最大,其次是手术、年龄、肿瘤大小、T分期、N分期、M分期、化疗和肿瘤部位。每个重要的变量都被赋予了一个从1~100的加权分数,然后将这些分数相加,确定生存概率轴和总分轴的垂直交点的数值,这意味着胰腺癌患者1、3、5年后的OS概率。最终构建了胰腺癌患者的预后模型及其网页版本(https://yixueyucemoxing.shinyapps.io/PAADPMqh)(图1)。
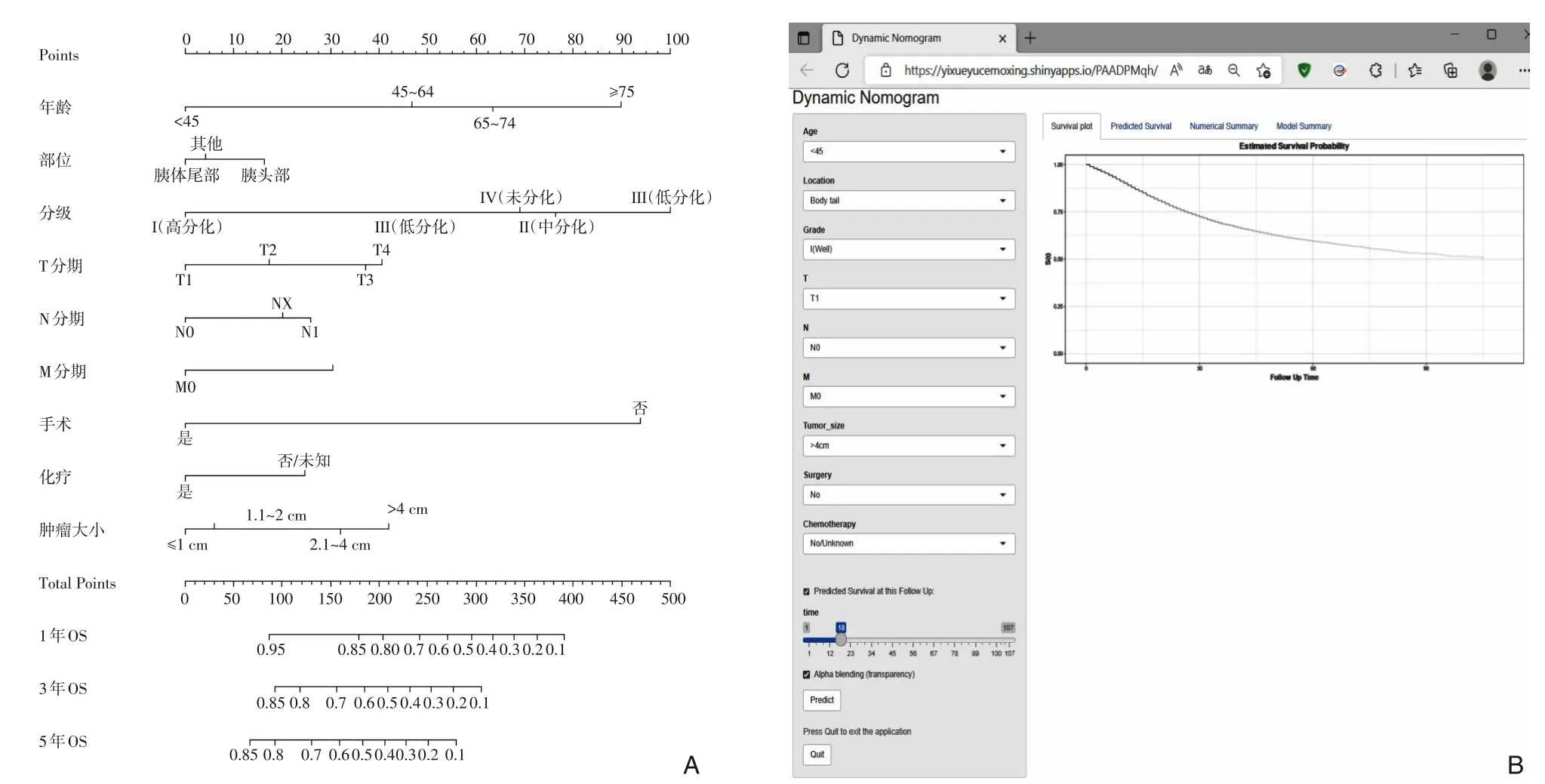
图1 预测胰腺癌患者OS概率的列线图 A:通过训练队列中结合9个变量构建的预测胰腺癌患者的1、3、5年OS的列线图;B:在线动态列线图截图Figure 1 Nomogram for predicting OS in patients with pancreatic cancer A: The nomogram developed in the training cohort by combining 9 variables for predicting the 1-, 3-, and 5-year OS in patients with pancreatic cancer; B: Screenshot of the online dynamic nomogram
2.4 列线图的验证
C-指数、时间依赖性的ROC曲线和校准曲线被用来区分和校准列线图的效用。在训练队列中,C-指数为0.759(95%CI=0.745~0.772),预测1、3、5年OS的ROC AUC值分别为0.828、0.842和0.849。在验证组中,C-指数为0.756(95%CI=0.735~0.776),1、3、5年的AUC值分别为0.820、0.831和0.842(图2)。此外,OS列线图的校准曲线显示列线图预测和实际数据之间具有高度的一致性(图3)。

图3 训练队列和验证队列的校准曲线 A-C:训练队列中预测1、3、5年OS列线图的校准曲线;D-F:验证队列中预测1、3、5年OS列线图的校准曲线Figure 3 Calibration curves in the training cohort and validation cohort A-C: Calibration curves of the nomogram for predicting 1-, 3- and 5-year OS in training cohort; D-F: Calibration curves of the nomogram for predicting 1-, 3- and 5-year OS in validation cohort
2.5 列线图和AJCC TNM分期系统的比较
将构建的列线图模型与第7版的AJCC TNM分期系统进行比较,DCA被用来评估新模型对预测预后的效用,在训练和验证队列中,这个新模型在临床上是实用的,在预测OS方面比AJCC分期系统有更大的净收益(图4)。此外,在训练和验证队列中,根据列线图将患者分为高风险和低风险组。Kaplan-Meier生存曲线显示,在训练队列和验证队列中,低风险患者的OS都比高风险患者好(均P<0.05)(图5)。
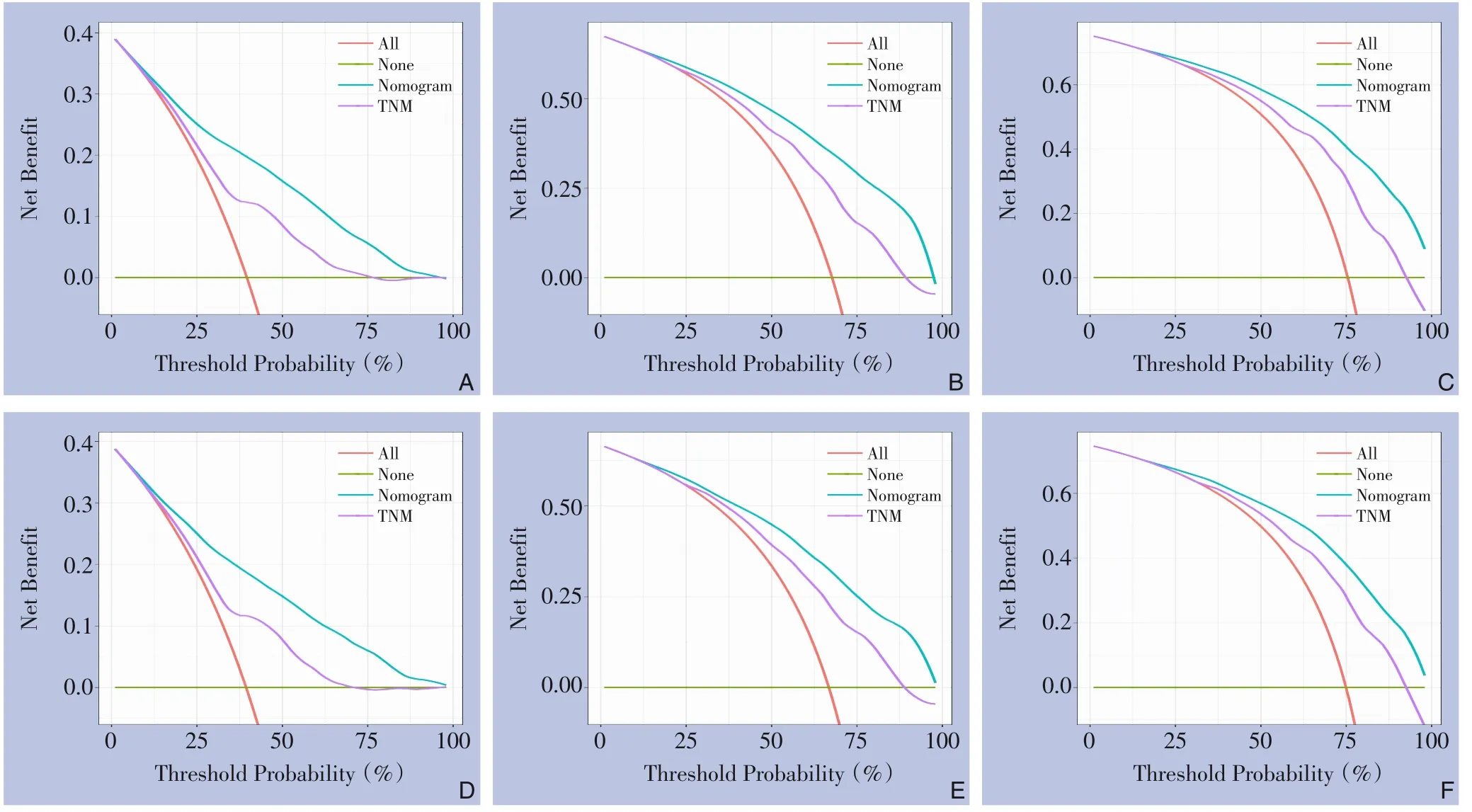
图4 列线图的DCA曲线,以及AJCC TNM分期系统 A-C:在训练队列中预测1、3、5年OS的DCA曲线;D-F:在验证队列中预测1、3、5年OS的DCA曲线Figure 4 DCA curves of the nomogram, and AJCC stage system A-C: DCA curves for predicting 1-, 3- and 5-year OS in training cohort; D-F: DCA curves for predicting 1-, 3- and 5-year OS in validation cohort

图5 高风险组和低风险组的Kaplan-Meier生存曲线 A:训练队列中OS的Kaplan-Meier生存曲线;B:验证队列中OS的Kaplan-Meier生存曲线Figure 5 Kaplan-Meier survival curves for the high- and low-risk groups A: Kaplan-Meier curve for OS in training cohort;B: Kaplan-Meier curve for OS in the validation cohort
3 讨 论
研究[3,23]表明,虽然胰腺癌约占所有癌症病例的3%,但它的病死率非常高,占所有癌症死亡病例的8%。在临床实践中,大多数胰腺癌患者只能存活6~9个月左右[24]。肥胖、吸烟、饮酒、2型糖尿病以及慢性胰腺炎被认为是胰腺癌的危险因素[25]。目前,临床上主要用于胰腺癌的预后预测工具是AJCC分期系统,但其局限性是未考虑对生存有影响的其他重要因素。因此,本研究构建胰腺癌患者的新型预后列线图模型,综合、准确地预测生存预后,以补充这一模型在胰腺癌患者中应用的空缺。
本研究经过单因素和多因素Cox回归分析,确定年龄、肿瘤位置、分化等级、T分期、N分期、M分期、肿瘤大小、手术和化疗为OS的独立预后因素,这与以往研究[26-27]一致。Zhang等[28]利用2010—2016年SEER数据库中胰腺癌肺转移患者数据构建了预测预后OS的列线图模型,其中年龄、肿瘤分级、肿瘤大小、手术和化疗等因素是胰腺癌肺转移患者OS的独立预后因素,这与本研究构建的模型一致,并且该研究发现放疗不是预后的独立危险因素。在本研究中,放疗与胰腺癌患者的预后也没有统计学意义。这可能与胰腺癌对放疗不敏感有关,Ding等[29]认为部分原因是胰腺癌独特的肿瘤微环境导致。本研究构建的预后模型,筛选的是经组织病理确诊,并且囊括各期的胰腺癌患者,方便临床上对各期患者进行预后评估。因此,本预后模型适用面更广,更加方便临床使用。但本模型中没有对组织病理类型、社会经济因素、远处转移部位和淋巴结转移进行分析,这也为后续的研究提供方向。
众所周知,AJCC分期系统被认为是预测肿瘤患者预后的金标准[12]。本研究结果显示,TNM分期越高,OS越差,且是与预后独立相关的危险因素。化疗是与预后相关的一个良好的独立预后因素,因此化疗被用于临床一线治疗[30]。列线图是根据多变量结果构建,需要进行验证,以避免过度拟合,提高适用性[31]。C-指数和ROC AUC值被用来评估胰腺癌患者预后OS列线图的准确性和判别能力[32]。本研究中,预测1、3、5年OS的AUC值都在0.8以上,校正曲线的结果表明这种新型模型具备良好的预测性能[11]。此外,DCA曲线被用来评估列线图在临床决策上的性能,本研究结果表明新型模型对胰腺癌患者的生存时间有较好的预测作用。
列线图模型整合了临床和人口因素,能够评估多种肿瘤的生存结果[33-35]。本研究将整合多变量的列线图与传统的AJCC分期系统进行了比较,结果表明列线图预测模型具有更好的预测能力。在训练集和验证集中,DCA曲线表明,本研究的模型预测的生存结局比TNM分期系统具有更好的临床价值和效用。并且,本研究构建了网页版列线图预测模型,方便医生和患者随时线上根据实际情况进行个性化预测预后情况。
本研究也有一些局限性;首先,它是一项基于SEER数据库的回顾性研究,由于SEER数据库中一些检验和病理等信息不完整,可能存在一定程度的偏倚;并且因为数据库收纳的2000—2018年的样本数据,受样本量限制,本研究使用的是第7版AJCC TNM分期标准。第二,相关重要预后因素的信息记录不完整,如没有详细的化疗方案和剂量,没有详细的手术方式等。第三,本研究是单一的回顾性分析,因此需要前瞻性和多中心研究来验证该模型,使其更具有说服力。最后,办研究临床数据主要来自国外,还需要国人自己的临床数据来进行验证。
总之,本研究根据SEER数据库的大量胰腺癌样本,结合常用的临床指标,构建了一个预测胰腺癌患者预后模型,并建立了一个基于网络的列线图,可能方便临床实际使用。这个动态的在线列线图可能有助于临床医生更准确地判断胰腺癌患者的预后,有利于个体精准治疗,尽可能为患者的预后提供指导。
利益冲突:所有作者均声明不存在利益冲突。
