miR-142-3p对膀胱癌细胞增殖和有氧糖酵解的影响及作用机制
2022-10-12沈翀阎家骏任煜
沈翀 阎家骏 任煜
膀胱癌(bladder cancer,BC)是世界范围内常见肿瘤之一。随着人口增长和老龄化的增加,BC发病率呈逐年上升趋势,每年新增约55万病例[1]。根据肿瘤侵犯是否超过膀胱肌层可将BC分为肌层浸润型和非肌层浸润型,随着医疗科技水平的提高,不同类型BC的治疗方式都有了很大改进,术后患者生存率也有了极大提高[2-3]。但BC的进展预测和术后复发仍是目前临床难点,亟需寻找新的临床标志物或治疗策略。微小RNA(micro-RNA,miR)是一类非编码RNA,能在肿瘤细胞信号通路中起信号阻遏或激活作用,并调控肿瘤细胞有氧糖酵解[4-6]。现阶段研究认为,miR的异常表达与泌尿系统肿瘤发生及进展相关[7-8],故极有潜力作为BC的治疗靶点和预后标志物。研究表明,miR-142-3p在BC细胞及组织内低表达,与BC细胞增殖、迁移、侵袭能力增强有关[9-11],但miR-142-3p对BC的有氧糖酵解作用未知。本研究利用体外BC细胞转染miR-142-3p,以明确miR-142-3p对BC细胞增殖和糖酵解的影响,并探究其可能的作用靶点。
1 材料和方法
1.1 材料
1.1.1 实验细胞人输尿管上皮细胞株SV-HUC-1和人BC细胞株SW780、UMUC3、T24、BIU87均购自赛百慷生物技术有限公司;使用含10 % FBS的培养基,在37℃、5%二氧化碳(CO2)条件下培养。每1~2 d进行细胞传代,取对数生长期细胞进行实验。
1.1.2 试剂RPMI1640培养基购自美国Hyclone公司,批号:AE29 163439;CCK-8试剂盒购自美国MCE公司,批号:092820 210318;葡萄糖和乳酸含量微量法检测试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒、双荧光素酶报告基因检测试剂盒购自中国索莱宝科技有限公司,批号分别为20210711、20210813、20210623、20 210808;细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)4、乳酸脱氢酶(lactate dehydrogenase,LDH)A、磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)蛋白抗体购自美国Affinity公司,批号分别为38f4541、47o1025、25s1685;细胞周期试剂盒购自美国BD公司,批号:9 312877;逆转录试剂盒购自中国康为世纪科技股份有限公司,批号:36320;2-NBDG葡萄糖摄取实验试剂盒购自美国Abcam公司,批号:GR3347285-12。
1.2 方法
1.2.1 5组细胞miR-142-3p表达的检测采用qPCR法。5组细胞分别加入Trizol匀浆管中裂解,提取RNA。42℃,15 min;85℃,5 min,进行逆转录反应。miR-142-3p引 物 为F:5'-CAAACTCAAGGAGCAACACCG-3',R:5'-TAAGTGTAGTAAACCACTCGTG-3';U6引物为F:5'-GATTATCGGGACCATTCCACTG-3',R:5'-GATCTGGTTCCCAATGACTGTG-3'。95℃,10 min变性;95℃,15 s;60℃,60 s条件下循环40次。U6作为内参,采用2-ΔΔCt法分析计算各组细胞miR-142-3p相对表达量。选取极低表达miR-142-3p的细胞进行后续实验。
1.2.2 miR-142-3p质粒构建、转染及表达检测美国国家生物信息中心(national center for biotechnology information,NCBI)数据库获取miR-142-3p基因序列,PCR法扩增序列,双酶切法将基因片段和空白质粒连接构建miR-142-3p质粒。将空白质粒和miR-142-3p质粒转染至选取的细胞内,5种细胞均各分为质粒对照组和miR-142-3p转染组,正常培养24~48 h。采用qPCR法测定各组细胞miR-142-3p相对表达量。
1.2.3 细胞克隆的检测采用平板克隆实验。将转染后的细胞消化制成细胞悬液,接种于含30%FBS的完全培养基的12孔板中。孔中单克隆细胞数量>50个时,PBS洗涤细胞,4%多聚甲醛固定1 h。PBS清洗细胞,纯净结晶紫染液染色2 min,拍照并计数细胞克隆数量。
1.2.4 细胞活性的检测采用CCK-8法。将转染后的细胞制备悬液,接种于96孔板中培养24 h。按照CCK-8试剂盒方法加入CCK-8试剂,继续于培养箱内孵育24 h。完成后取出,检测450 nm处各孔细胞吸光度(optical density,OD),根据公式计算细胞存活率。细胞存活率(%)=(实验组OD450-空白组OD450)/(对照组OD450-空白组OD450)。
1.2.5 细胞周期检测采用流式细胞术。PBS清洗转染后的细胞,消化细胞,待消化结束时血清培养基终止反应。1 000 r/min离心3 min,弃上清液。1 ml PBS重悬细胞,1 000 r/min离心3 min,弃上清液。500 μl DNA染液和5 μl破膜剂,室温避光孵育细胞30 min,离心,吸弃300 μl上清液。PBS重悬细胞,过300目滤膜,移至新离心管。使用流式细胞仪计数不同周期的细胞数量及比例。
1.2.6 细胞糖酵解的检测(1)细胞葡萄糖摄取能力的检测:采用2-NBDG摄取实验,按照葡萄糖检测试剂盒方法,将转染后的细胞接种于96孔板孵育48 h后,加入2-NBDG孵育10 min。在激发波长/发射波长(Ex/Em)为488/520的条件下测定荧光值。以各组荧光强度/空白值表示细胞葡萄糖消耗量。(2)细胞乳酸生成量的检测:按照乳酸含量检测试剂盒方法检测细胞的乳酸生成量。
1.2.7 miR-142-3p与CDK4、LDHA靶向性预测及验证使用Target Scan(https://www.targetscan.org/)进行miR-142-3p与野生(wild-type,WT)型和变异(mutate,Mut)型的CDK4、LDHA基因靶向预测。采用双荧光酶报告基因检测试剂盒进行靶向性验证。miR-142-3p质粒转染后的细胞预先铺板培养16 h,构建WT、Mut型的CDK4-3'端非翻译区(3'UTR)和LDHA-3'UTR的荧光素酶报告质粒,转染至铺板细胞中,6 h更换1次培养基。48 h后,裂解细胞并加至黑色酶标板中,加入检测反应液共培养30 min,测定报告质粒荧光值,进行miR-142-3p与CDK4、LDHA的靶向性验证。
1.2.8 CDK4与LDHA表达的检测采用Western blot法。PBS清洗并收集低表达miR-142-3p细胞及miR-142-3p转染后的细胞。使用RIPA裂解液裂解细胞,4℃,12 000 g离心5 min,提取上清液。按照BCA蛋白定量试剂盒方法检测样品中总蛋白浓度。聚丙烯酰胺凝胶电泳后转至聚氟乙烯膜(PVDF),5%脱脂奶粉振荡孵育2 h,洗涤缓冲液清洗。将PVDF膜放入含有CDK4与LDHA抗体的稀释液中,4℃振荡过夜。TBST清洗,加二抗。增强化学发光法显影,chemi capture软件拍照并分析,计算各组细胞中CDK4与LDHA的相对表达量。
1.2.9 CDK4与LDHA的质粒构建、过表达及相应检测采用PCR法扩增CDK4和LDHA基因序列,构建CDK4、LDHA质粒。miR-142-3p转染的BC细胞分为miR-142-3p+空白载体组、miR-142-3p+CDK4组、miR-142-3p+LDHA组,将空白质粒、CDK4过表达质粒和LDHA过表达质粒分别转染至对应组别细胞中,培养24~48 h。采用2-NBDG摄取实验,有氧糖酵解产物检测,CCK-8实验测定各组细胞2-NBDG荧光值、葡萄糖消耗量、乳酸生产量和细胞活性。
1.3 统计学处理使用SPSS 16.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用Tukey检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-142-3p在5组细胞中表达的比较与SVHUC-1细胞相比,miR-142-3p在BIU87、SW780细胞中显著低表达(均P<0.05),在UMUC3细胞和T24细胞中极显著低表达(均P<0.01),见表1。故本研究选取T24、UMUC3细胞构建过表达miR-142-3p的BC细胞株进行后续实验。

表1 miR-142-3p在5组细胞中表达的比较
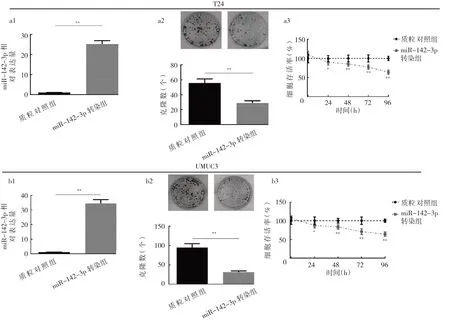
2.2 miR-142-3p对UMUC3和T24细胞增殖影响的比较与质粒对照组相比,miR-142-3p转染组的T24和UMUC3细胞miR-142-3p相对表达量显著升高(均P<0.01),细胞克隆数显著减少(均P<0.01),细胞存活率在24 h及之后显著下降(P<0.05),见图1。
2.3 miR-142-3p转染对UMUC3和T24细胞周期影响的比较与质粒对照组相比,miR-142-3p转染组的T24和UMUC3细胞滞于G0/G1期细胞比例显著增加(均P<0.01),而滞于S期和G2/M期的细胞比例明显下降(P<0.05),见图2。
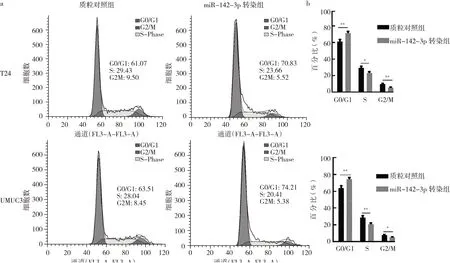
图2 过表达miR-142-3p对2种BC细胞周期的影响(a:流式细胞术检测细胞周期;b:过表达miR-142-3p的2种BC细胞不同细胞周期细胞比例)
2.4 miR-142-3p对UMUC3和T24细胞有氧糖酵解影响的比较与质粒对照组相比,miR-142-3p转染组T24、UMUC3细胞的2-NBGD荧光强度显著减弱、葡萄糖消耗量显著下降(均P<0.01),乳酸生成量显著下降(P<0.01),见图3。
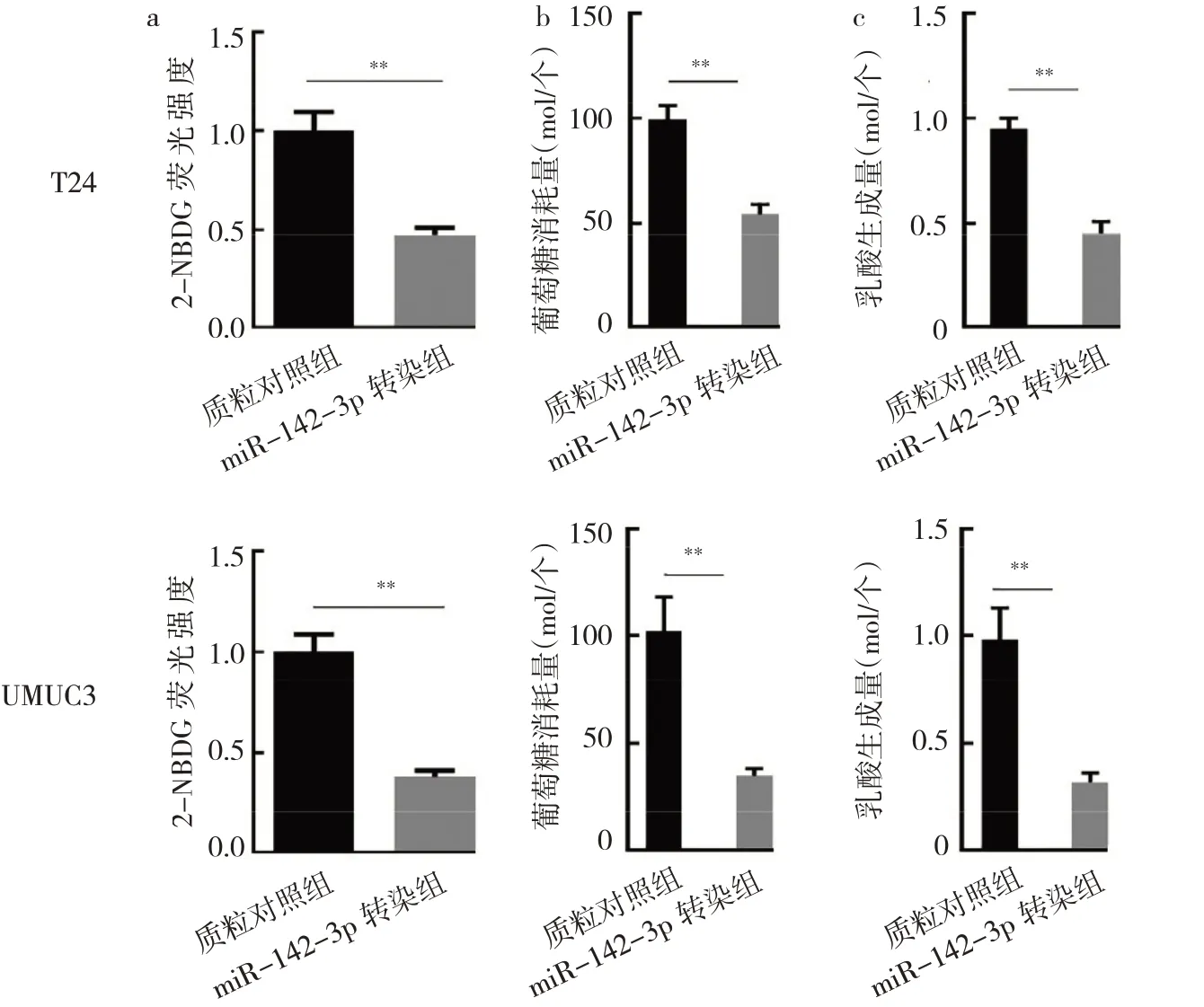
图3 过表达miR-142-3p对2种BC细胞有氧糖酵解的影响(a:过表达miR-142-3p对2种BC细胞2-NBDG荧光强度的影响;b:过表达miR-142-3p对2种BC细胞葡萄糖消耗量的影响;c:过表达miR-142-3p对2种BC细胞乳酸生成量的影响)
2.5 miR-142-3p与不同型CDK4和LDHA基因靶向性预测及验证miR-142-3p与野生型的CDK4和野生型LDHA基因的部分基因序列靶向关联。与质粒对照组相比,miR-142-3p转染组的野生型CDK4和LDHA荧光素酶报告质粒的荧光素酶相对活性显著降低,差异均有统计学意义(均P<0.01),而变异型荧光素酶报告质粒的荧光酶相对活性无明显变化(均P>0.05),见图4。
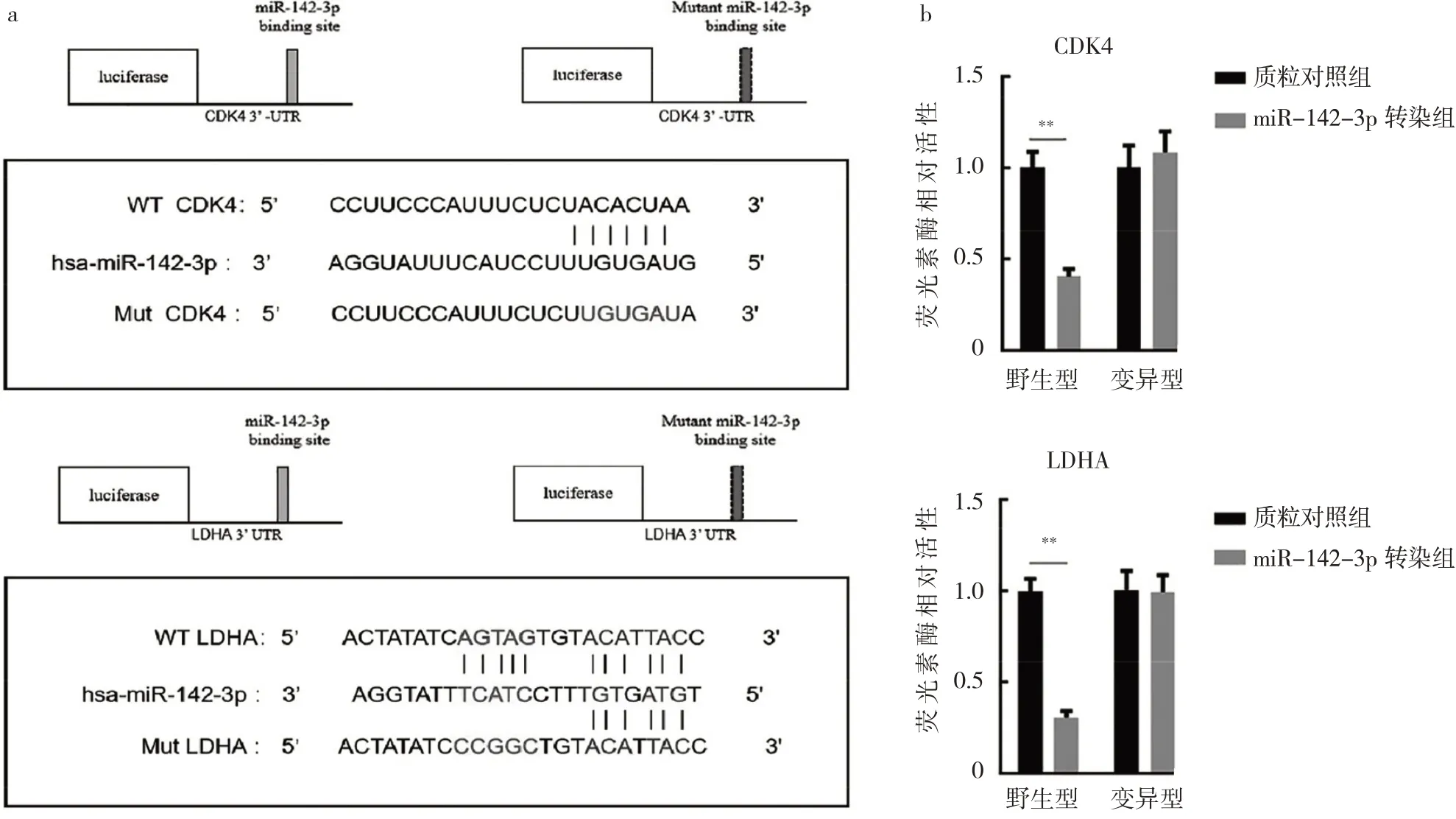
图4 miR-142-3p与不同型CDK4和LDHA基因序列的靶向预测及验证(a:miR-142-3p与不同型CDK4和LDHA基因的预测结果;b:不同型CDK4或LDHA与miR-142-3p结合后荧光素酶活性的影响)
注:miR为微小RNA;BC为膀胱癌;*P<0.05,**P<0.01
2.6 miR-142-3p对UMUC3和T24细 胞CDK4和LDHA蛋白表达的影响与质粒对照组相比,miR-142-3p转染组T24和UMUC3细胞CDK4和LDHA蛋白的相对表达量显著降低,差异均有统计学意义(均P<0.01),见图5。
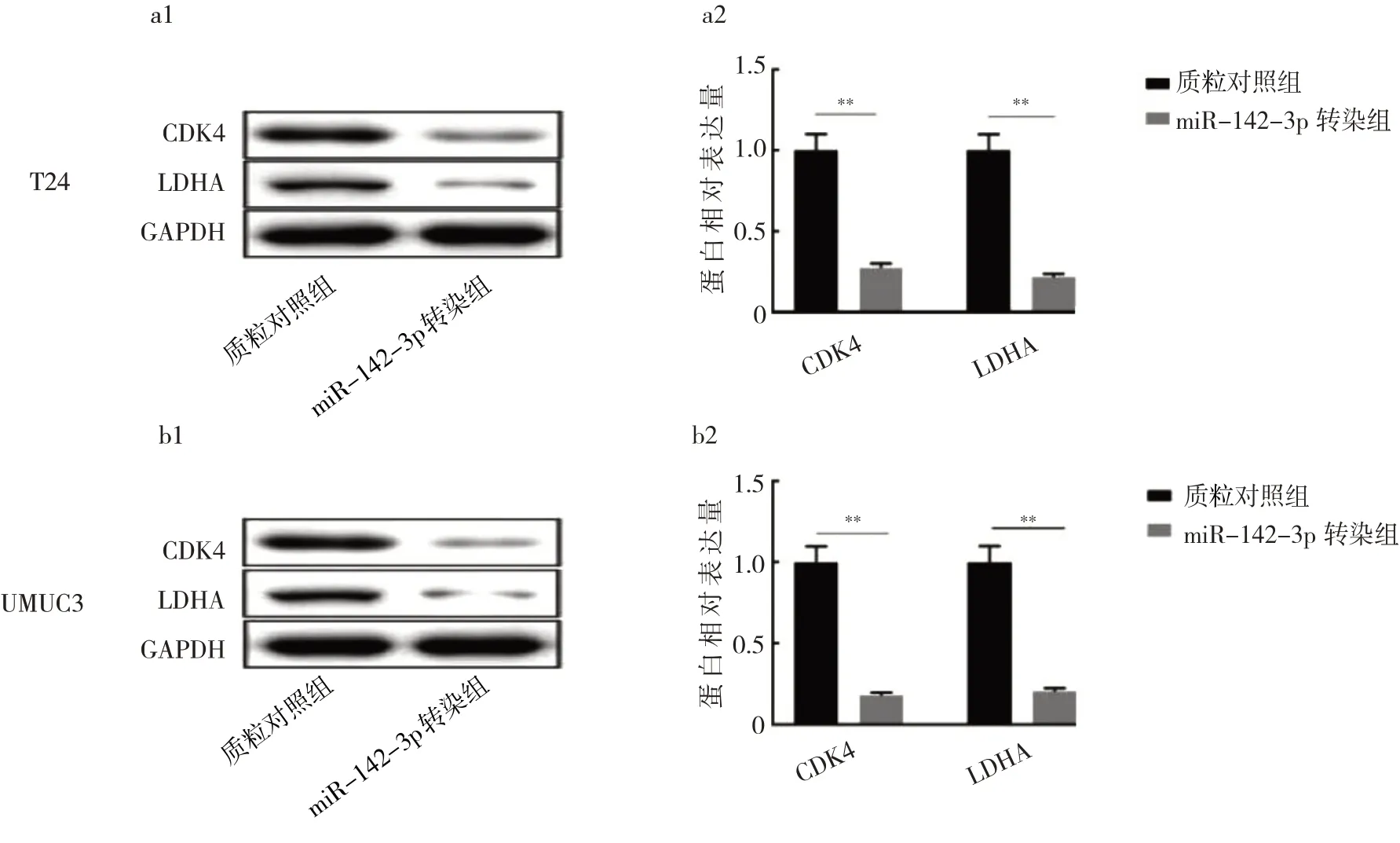
图5 过表达miR-142-3p对2种BC细胞有氧糖酵解相关蛋白表达的影响(a1和b1:蛋白电泳图;a2和b2:过表达miR-142-3p对2种BC细胞CDK4、LDHA蛋白表达的影响)
2.7 CDK4和LDHA过表达对miR-142-3p转染T24细胞的影响与miR-142-3p+空白载体组相比,miR-142-3p+CDK4组和miR-142-3p+LDHA组细胞的2-NBDG荧光强度显著增强(P<0.01)、葡萄糖消耗量显著上升(P<0.01),乳酸生成量显著上升(P<0.01),48 h及之后细胞存活率显著上升(P<0.01),见图6。
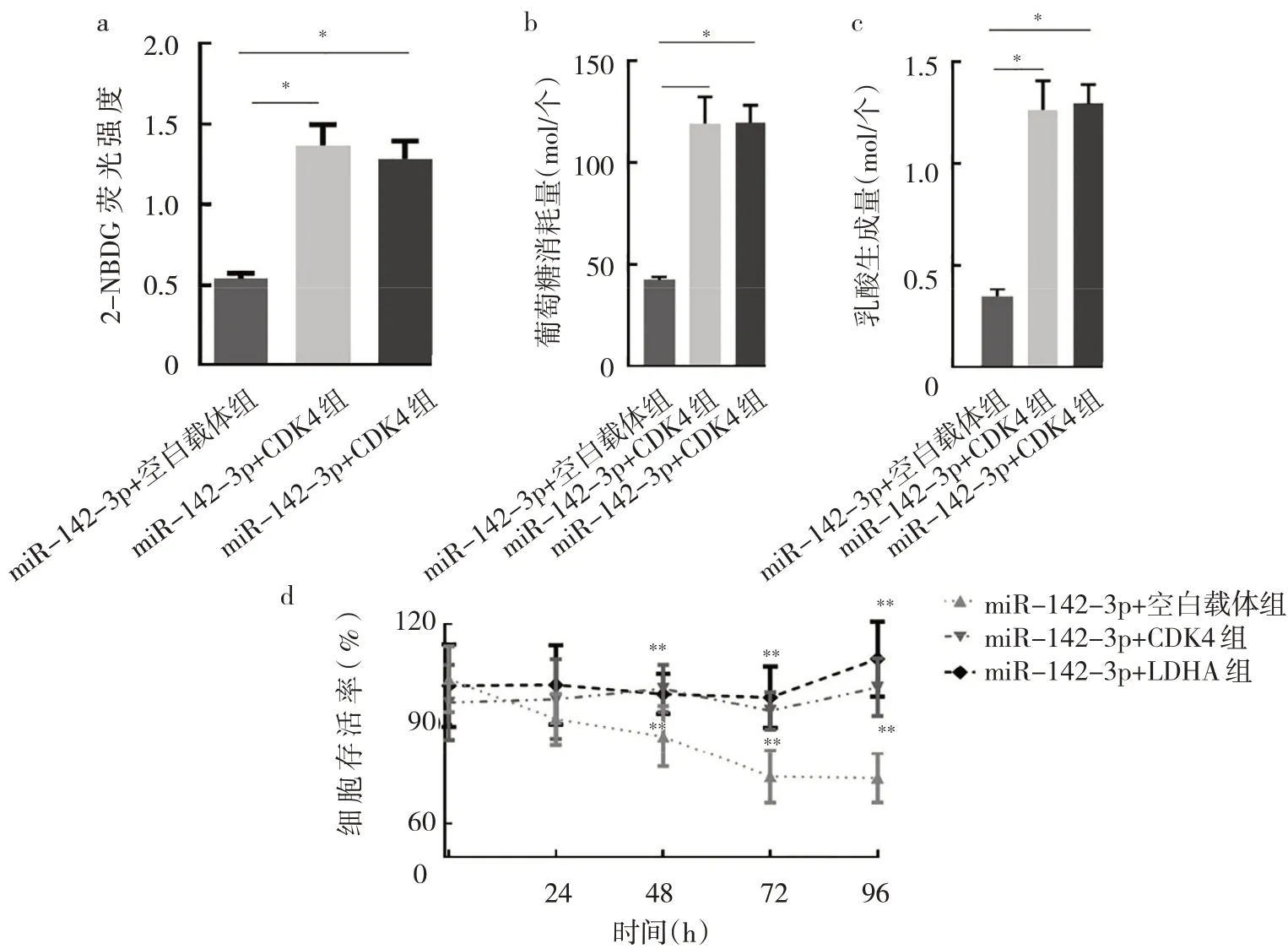
图6 过表达CDK4或LDHA对miR-142-3p转染T24细胞糖酵解、增殖的影响(a:过表达CDK4或LDHA对miR-142-3p转的T24细胞2-NBDG荧光强度的影响;b:过表达CDK4或LDHA对miR-142-3p转染的T24细胞葡萄糖消耗量的影响;c:过表达miR-142-3p对2种BC细胞乳酸生成量的影响;d:过表达CDK4或LDHA对miR-142-3p转染的T24细胞存活率的影响)
3 讨论
“瓦博格效应”为肿瘤细胞优先选择低效产能的糖酵解途径来满足快速代谢需求,表现为肿瘤细胞较正常细胞需摄取更多葡萄糖,生成更多乳酸,而过量的乳酸能够提供肿瘤细胞增殖和线粒体代谢[12-13]。据此,靶向有氧糖酵解途径的各种关键酶及相关转运蛋白以抑制肿瘤细胞增殖为肿瘤治疗带来了新的方向[14-15]。本研究发现miR-142-3p在BC细胞中显著低表达,提示miR142-3p在BC细胞中极可能具有抑癌作用。
既往研究表明,miR-142-3p通过调控BC细胞周期变化、诱导凋亡,抑制细胞的增殖和侵袭[8-10]。本研究将构建的miR-142-3p质粒转染BC细胞系的T24和UMUC3细胞后,2种BC细胞活性及克隆增殖能力均显著下降,细胞周期阻滞于G0/G1期,验证了miR-142-3p具有调控BC细胞周期、抑制细胞增殖的作用。本研究发现miR-142-3质粒转染能够减弱BC细胞的2-NBDG葡萄糖荧光强度,减少细胞葡萄糖消耗及乳酸生成,提示miR-142-3具有抑制BC细胞摄取葡萄糖、调控有氧糖酵解的作用。
肿瘤细胞的快速增殖依赖于大量能量物质,而糖酵解正是肿瘤细胞异常能量需求的主要来源[14,16]。研究显示miR-142-3p能够通过调节有氧糖酵解抑制肿瘤细胞的侵袭和迁移能力[17]。生物体内的有氧糖酵解途径涉及多过程,并有多种酶的参,LDHA是糖酵解途径中的关键酶,还可参与肿瘤免疫微环境的调控,与肿瘤的发生、发展极为密切[5,18]。研究表明,LDHA可在miR的调控下影响肿瘤细胞糖代谢,起到抑制细胞增殖的作用[19]。Hua等[20]发现miR-142-3p可以靶向LDHA调控有氧糖酵解抑制肝癌细胞的增殖和转移。CDK4是调控是肿瘤细胞从G1期进入下一细胞周期的重要信号分子,而有氧糖酵解可为肿瘤细胞周期改变提供所需能量[21]。研究显示,乳腺癌细胞对CDK4抑制剂的耐药性增加可导致细胞的有氧糖酵解加强[22]。研究表明,miR-142-3p能够靶向CDK4调控肿瘤细胞周期[23]。基因多态性与癌症相关[24],野生型基因是自然界中最常见的基因类型。本研究发现,miR-142-3p能与野生型的CDK4和野生型的LDHA基因结合,且过表达miR-142-3p可抑制BC细胞CDK4和LDHA的蛋白表达,提示CDK4和LDHA是miR-142-3p的作用靶点。如前所述,CDK4或LDHA的表达可促进肿瘤细胞增殖,LDHA可增强肿瘤细胞糖酵解[20],而LDHA和CDK4对BC细胞糖酵解的作用还未明确。本研究比较了过表达CDK4或LDHA对miR-142-3p转染T24细胞有氧糖酵解和活性的影响,结果显示,CDK4或LDHA过表达能够上调miR142-3p转染的T24细胞的葡萄糖摄取能力,增加细胞的葡萄糖消耗量和乳酸生成量,并促进细胞的活性,表明CDK4或LDHA表达可促进BC细胞的有氧糖酵解和增殖、逆转miR-142-3p对BC细胞糖酵解和增殖的抑制。而miR-142-3p可抑制BC细胞CDK4和LDHA蛋白的表达,故通过本实验结果可推测miR-142-3p通过靶向抑制CDK4和LDHA表达发挥对BC细胞增殖和糖酵解的抑制作用。
综上所述,本研究明确了miR-142-3p可通过靶向LDHA和CDK4抑制膀胱癌细胞的增殖和有氧糖酵解,为miR-142-3p可作为抑制BC细胞有氧糖酵解的治疗靶点提供了潜在依据。但本研究仅在体外开展了初步研究,后续还需要更多研究进一步明确miR-142-3p对膀胱癌的治疗作用,以及预后价值。
