环肽、3-苯乳酸与苯丙酸组合物对双菌生物被膜的影响
2022-10-11李佳珣张秋香毛丙永崔树茂赵建新
李佳珣, 张秋香, 唐 鑫, 毛丙永, 崔树茂, 赵建新,张 灏, 陈 卫
(江南大学 食品学院, 江苏 无锡 214122)
龋齿是较常见的口腔疾病之一,细菌和真菌共同参与牙菌斑生物被膜的形成是龋齿的始动因子。变异链球菌是龋齿的主要致病菌,具有很强的代谢蔗糖产酸并形成致龋性生物被膜的能力,是生物被膜形成过程早期的主要定植菌。它通过磷酸转移酶系统(phosphotransferase system,PTS)代谢膳食中可发酵糖类产生乳酸,并合成胞外多糖和胞外蛋白质从而启动生物被膜结构的形成[1],其中,PtxA蛋白可能对该菌生长代谢具有关键性作用[2]。近年来临床研究又发现白色念珠菌参与了龋齿的进程,2种菌相互作用会形成致龋性更强的生物被膜[3-4]。白色念珠菌可以耐受高酸性环境并产生高水平的有机酸,显著降低局部环境的pH值,促进牙釉质脱矿[5]。其中,果糖二磷酸醛缩酶(Fba)是白色念珠菌中含量最丰富的可溶性蛋白之一,是糖酵解中的关键酶,在白色念珠菌能量代谢中起重要作用[6]。本团队前期研究发现[7-8],食用植物乳杆菌CCFM8724可以预防儿童龋齿,该益生菌可产生多种代谢物来抑制生物被膜的形成,其中,环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸三者具有较好的抑制双菌生物被膜形成的效果。Bello等[9]发现植物乳杆菌产生的环亮氨酸脯氨酸二肽和环苯丙氨酸脯氨酸二肽可以抑制枯萎镰刀菌的生长,Zhao等[10]研究表明植物乳杆菌ZZUA493产生的3-苯乳酸、乳酸、醋酸抑制霉菌生长,延长馒头保质期。目前有关口腔益生菌产品的研究多数集中在益生菌的效果评价上,而对益生菌产生的物质作用效果和机制方面的研究鲜有报道。本研究以环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸作为组合物,探究组合物对双菌生物被膜形成、胞外多糖和胞外蛋白产量、群体感应系统及生物被膜结构的影响,最后通过分子对接的方式探究小分子代谢物结合于致病菌靶点的方式和构象,希望为植物乳杆菌CCFM8724及其组合物开发口腔益生菌和后生元产品提供理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌CCFM8724、哈维氏弧菌BB170,保藏于江南大学食品生物技术中心;变异链球菌ATCC25175、白色念珠菌ATCC18804,中国普通微生物菌种保藏管理中心,现保藏于江南大学食品生物技术中心。
结晶紫、甲醇、冰醋酸、苯酚、二甲基亚砜、硫酸,分析纯,国药集团化学试剂有限公司;BCA试剂盒,碧云天生物技术有限公司;康宁96孔细胞培养板,南通市海之星实验器材有限公司;2216E培养基,青岛高科技工业园海博生物技术有限公司;环亮氨酸脯氨酸二肽,南京莱昂生物科技有限公司;3-苯乳酸,上海沃凯生物技术有限公司;苯丙酸,上海阿拉丁生化科技股份有限公司。
TSB培养基(g/L):胰蛋白胨17.0、酵母粉6.0、氯化钠5.0、大豆蛋白胨3.0、葡萄糖2.5、磷酸氢二钾2.5,pH值7.0~7.4。YPD培养基(g/L):蛋白胨20、葡萄糖20、酵母粉10。MRS培养基(g/L):葡萄糖20.0、牛肉膏10.0、胰蛋白胨10.0、酵母粉5.0、无水乙酸钠5.0、柠檬酸氢二铵2.0、磷酸氢二钾2.0、硫酸镁0.58、硫酸锰0.25、吐温80 1.0 mL,pH值调整至6.2~6.4。这3种培养基115 ℃高压灭菌20 min。AB培养基(mol/L):NaCl 0.3、Mg2SO40.05,酸水解酪蛋白0.2 g,115 ℃高压灭菌20 min后加入10 mL 1 mol/L的无菌磷酸钾缓冲液、10 mL 0.1 mol/L的无菌精氨酸溶液和20 mL体积分数为50%无菌甘油。
1.2 仪器与设备
Multiscan Go型全波长酶标仪,美国赛默飞世尔科技有限公司;Centrifuge 5424R型台式冷冻高速离心机,德国Eppendorf公司;Quanta200型扫描电镜(SEM),荷兰Fei公司。
1.3 实验方法
1.3.1菌株的培养
取出-80 ℃保藏的植物乳杆菌CCFM8724及变异链球菌ATCC25175,以2%的接种量分别接种于5 mL的MRS液体培养基和TSB液体培养基中,37 ℃静置培养18 h。白色念珠菌ATCC18804接种于YPD液体培养基中,37 ℃摇床培养18 h。哈维氏弧菌BB170接种于2216E培养基,30 ℃摇床培养18 h。活化3代后用于后续实验。
为培养双菌生物被膜,活化后的变异链球菌和白色念珠菌分别接种于质量浓度为0.1 g/L蔗糖的TSB液体培养基和YPD液体培养基中,使变异链球菌和白色念珠菌菌悬液浓度约为107、106CFU/mL。
1.3.2植物乳杆菌发酵上清液和组合物的制备
植物乳杆菌CCFM8724的过夜培养液于4 ℃以6 000 r/min离心10 min,上清液用0.22 μm的滤膜过滤除菌后置于4 ℃冰箱备用。3-苯乳酸、苯丙酸和环亮氨酸脯氨酸二肽分别为200.0、200.0、50.0 μg/mL进行复配,随后用0.22 μm的滤膜过滤除菌后得到组合物。
1.3.3生物被膜量测定
采用结晶紫染色法测定生物被膜量。在96孔板中分别加入变异链球菌、白色念珠菌菌悬液各75 μL,随后将复配组合物以棋盘稀释法加入孔板中,37 ℃静置培养24 h。阴性对照组以同等体积的体积分数为5%的二甲基亚砜水溶液代替,阳性对照组以植物乳杆菌CCFM8724上清液代替。培养结束后去除培养液,用1 mol/L的磷酸盐缓冲液(phosphate buffer saline, PBS)小心清洗生物被膜2遍,室温静置晾干。向每孔中加入100 μL甲醇以固定生物被膜,10 min后除去甲醇,自然晾干,加入100 μL质量分数为0.1%的结晶紫溶液,将生物被膜染色30 min。染色结束后用PBS清洗2遍,每孔以100 μL体积分数为33%的冰醋酸溶解,用酶标仪读取600 nm处的吸光度。每组平行测定6次。
1.3.4胞外多糖产量测定
采用苯酚硫酸法测定胞外多糖产量。生物被膜培养方法同1.3.3,培养结束后用PBS仔细冲洗,再用100 μL的PBS将生物被膜洗脱,收集到1.5 mL离心管内,12 000 r/min离心10 min后弃上清,重复洗3遍,确保除去水溶性多糖。用500 μL 1.0 mol/L氢氧化钠在37 ℃下搅拌2 h提取水不溶性多糖[11]。12 000 r/min离心10 min取上清液,把水不溶性多糖的碱提液转移到装有1 mL体积分数为6%苯酚的试管中,再加浓硫酸5 mL,室温静置30 min,在490 nm处测定吸光度,代入标准曲线计算胞外多糖含量[12]。
1.3.5胞外蛋白产量测定
使用BCA试剂盒测定胞外蛋白产量。生物被膜培养方法同1.3.3节,培养结束后用PBS仔细冲洗,再用100 μL的PBS将生物被膜洗脱,收集到1.5 mL离心管内,加入适量的小磁珠,预冷条件下以高通量组织破碎仪破碎。高通量组织破碎仪参数设置为破碎45 s,停15 s,循环10次。破碎后12 000 r/min离心10 min取上清液。按BCA试剂盒的方法进行蛋白质的检测,于96孔板中每孔加入200 μL工作液,再加入20 μL上清液,置于37 ℃反应30 min,在562 nm处测定吸光度,代入标准曲线计算胞外蛋白含量。
1.3.6群体感应信号分子AI- 2产量测定
采用哈维氏弧菌BB170生物发光法检测组合物对变异链球菌和白色念珠菌种间的自诱导分子(AI- 2)活性的影响[13]。在24孔板中加入变异链球菌和白色念珠菌菌悬液各375 μL,再加入250 μL组合物,阴性对照组以同等体积的体积分数为5%的二甲基亚砜水溶液代替,阳性对照组以植物乳杆菌CCFM8724上清液代替。培养24 h后,收集、过滤获得无菌上清液,备用。活化后的哈维氏弧菌BB170接种于AB培养基,30 ℃、180 r/min培养12 h,调节菌液OD600为0.8左右,再用无菌新鲜AB培养基按体积比1∶2 000稀释该菌液,混匀备用。按体积比1∶50将植物乳杆菌发酵上清液与哈维氏弧菌BB170稀释菌悬液混合。30℃、100 r/min摇瓶培养5 h,避光条件下吸取200 μL于黑色不透明酶标板中,以多功能酶标仪于500 nm处检测哈维氏弧菌BB170化学发光情况。
1.3.7生物被膜结构观察
在6孔板放置无菌盖玻片,加入致病菌各1.5 mL,然后加入3-苯乳酸、苯丙酸和环亮氨酸脯氨酸二肽使它们的终质量浓度分别为200.0、200.0、50.0 μg/mL,双菌生物被膜培养24 h后,取出盖玻片,后用1 mL的体积分数为2.5%的戊二醛固定1 h,PBS冲洗后用乙醇(体积分数10%、25%、50%、75%、90%)梯度脱水,各个体积分数分别脱水20 min。随后,将盖玻片浸入体积分数为100%的乙醇中1 h,在室温下干燥1 d。将盖玻片转移到铜桩上喷金(160 s、40 mA)后进行扫描电镜观察[14]。
1.3.8化合物作用方式探究
分别将变异链球菌的PtxA 蛋白和白色念珠菌的Fba蛋白设置为分子对接受体,代谢物环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸设置为分子对接配体。使用软件Pymol对蛋白质结构进行处理,删除溶剂分子,使用AutoDock 4软件计算格点能地图并进行分子对接,使用Open Babel软件进行蛋白质和配体分子格式的转换,使用Seesar软件对分子对接结果进行可视化处理[15-16]。
1.4 数据处理
数据分析使用Graphpad Prism 8.4.3、R studio 4.0.1、SPSS软件,使用One-way ANOVA进行方差分析,P<0.05表示具有显著性差异。使用Graphpad Prism 8.4.3、配置了R包 ggplot2和ggsci的R studio 4.0.1软件进行数据可视化分析。
2 结果与分析
2.1 组合物对双菌生物被膜形成的影响
牙菌斑生物被膜的形成是龋齿发生的先决条件,本研究采用结晶紫染色法探究具有显著抑制生物被膜形成效果的组合物对变异链球菌和白色念珠菌双菌生物被膜形成的影响,结果见图1。在终质量浓度分别为0.0、12.5、25.0、50.0、100.0、200.0 μg/mL时,采用棋盘稀释法对3-苯乳酸、苯丙酸、环亮氨酸脯氨酸二肽进行复配。当3-苯乳酸和环亮氨酸脯氨酸二肽质量浓度分别为200.0、50.0 μg/mL,苯丙酸和环亮氨酸脯氨酸二肽质量浓度分别为200.0、50.0 μg/mL,或3-苯乳酸和苯丙酸质量浓度分别为200.0、200.0 μg/mL时,观察到较强生物被膜抑制效果。因此,选择3-苯乳酸、苯丙酸和环亮氨酸脯氨酸二肽质量浓度分别为200.0、200.0、50.0 μg/mL进行复配,检测3种物质的组合物对双菌生物被膜的抑制效果。由图1(d)可知,3-苯乳酸、苯丙酸和环亮氨酸脯氨酸二肽组合物显著抑制双菌生物被膜的形成,生物被膜与阴性对照组相比减少了79.4%,效果与阳性对照组植物乳杆菌发酵液(73.9%)类似。Strom等[17]研究表明:植物乳杆菌MiLAB393产生的环肽(L-Phe-L-Pro)和3-苯乳酸可协同抑制镰刀菌、烟曲霉等真菌生长,最低抑菌浓度(MIC)分别为7.5、20.0 mg/mL。
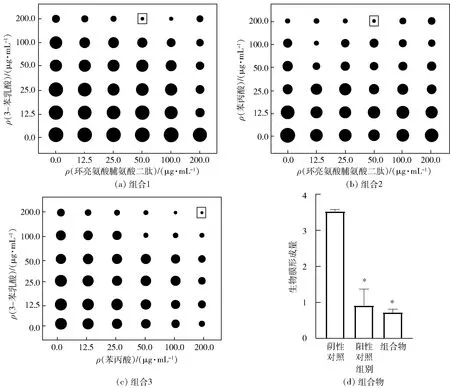
黑色圆点由小到大表示生物膜形成量逐渐增大,*表示与阴性对照组差异显著(P<0.05)。图1 不同质量浓度组合物对双菌生物被膜形成的影响Fig.1 Effect of compositions of different mass concentrates on dual-species biofilm formation
2.2 组合物对双菌生物被膜胞外基质的影响
除结晶紫染色法确定生物被膜量外,生物被膜中的大分子物质的检测也是生物被膜研究中的重要指标。水不溶性胞外多糖和胞外蛋白是生物被膜基质的重要组成成分,是构成生物被膜三维立体结构的关键因子[18-19]。通过苯酚硫酸法和BCA蛋白测定法测定了组合物对生物被膜中的胞外多糖和胞外蛋白产量的影响,见图2。结果表明,组合物达到了与阳性对照组同等的效果,与阴性对照组相比胞外多糖的产量减少了63.8%,胞外蛋白的产量减少了60.2%,因此组合物阻断了胞外聚合物的产生,减少了生物被膜的形成,这也与结晶紫染色法观察到生物膜量显著降低的结果一致。Chen等[20]用苯酚硫酸法和福林- 酚试剂法测定了食源性致病菌副溶血性弧菌和单核细胞增生李斯特菌单菌生物膜和双菌生物膜形成时的胞外多糖和胞外蛋白,结果表明双菌生物膜的胞外基质含量高于单菌生物膜。
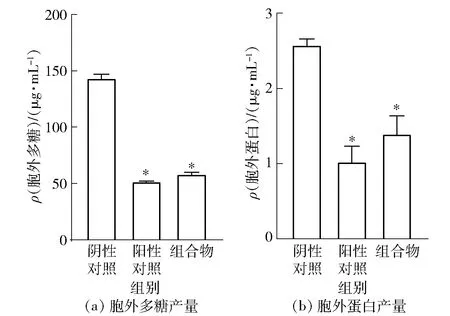
*表示与阴性对照组差异显著(P<0.05)。图2 组合物对双菌生物被膜胞外基质的抑制Fig.2 Inhibition of extracellular matrix of dual-species biofilm by compositions
2.3 组合物对双菌群体感应的影响
通过群体感应调控分析也可以从另一个角度反映生物被膜的形成。口腔环境复杂,通常为多菌共生,且不同菌种间通过信号分子传递信息,相互调节[21]。致龋菌形成的牙菌斑生物被膜与群体感应信号分子的调控密切相关,其中广泛存在于各微生物种间交流的AI- 2信号分子在微生物相互交流中起着重要作用[22]。本研究通过哈维氏弧菌BB170生物发光法检测组合物对变异链球菌和白色念珠菌种间的自诱导分子AI- 2活性的影响,见图3。结果表明:组合物显著减少了种间AI- 2信号分子的产生(减少率80.7%),效果与发酵液相近,说明组合物可以通过影响变异链球菌和白色念珠菌之间的群体感应进而影响生物被膜的形成。Nahar等[23]采用生物发光法发现风味酶具有群体感应淬灭活性,可以显著减少鼠伤寒沙门氏菌和大肠杆菌AI- 2信号的产生,并抑制生物膜形成。
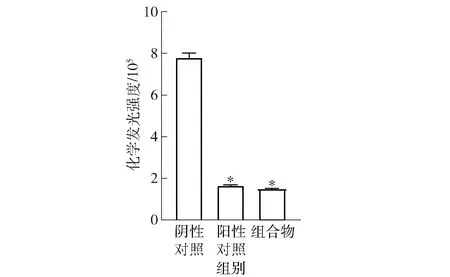
*表示与阴性对照组差异显著(P<0.05)。图3 组合物对双菌群体感应信号分子AI- 2 产生的抑制Fig.3 Inhibition of dual-species microbe quorum sensing signal molecule AI- 2 production by compositions
2.4 组合物对生物被膜结构的影响
成熟的生物被膜是由大量的胞外聚合物,如胞外多糖、蛋白质等大分子物质组成的三维立体结构,具有高倍成像的扫描电子显微镜是观察生物被膜形成和胞外基质的绝佳工具,在生物被膜结构研究中被广泛应用[24-25]。通过扫描电镜对生物被膜结构进行分析,见图4。阴性对照组生物被膜结构致密,具有一定厚度,呈明显的起伏波浪状;而植物乳杆菌CCFM8724和组合物组合干预后,生物被膜结构被明显破碎,在放大20 000倍下可以观察到明显的内陷,生物被膜变得疏松,且基质厚度明显减少,生理活性受到影响。Krzyciak等[26]在扫描电镜下观察了唾液乳杆菌对变异链球菌和白色念珠菌生物被膜结构的影响,也观察到了生物被膜厚度显著减少,结构松散。

图4 扫描电镜观察组合物对生物被膜结构的影响Fig.4 Effect of compositions on dual-species biofilm structure observed by scanning electron microscopy
2.5 双菌生物被膜抑制机理分析
为进一步探究组合物抑制双菌生物被膜生成的可能作用机理,将3种代谢物与变异链球菌PtxA蛋白、白色念珠菌Fba蛋白分别进行分子对接分析,结果见图5。变异链球菌中吸收并磷酸化抗坏血酸的PtxA蛋白可能对该菌能在接近无氧的口腔环境中旺盛生长具有关键性作用[2]。由PtxA基因编码的PtxA蛋白是PTS中的抗坏血酸家族的重要组成,它与变异链球菌抗坏血酸代谢过程相关,对该蛋白质的三维晶体结构解析和体外酶活实验也证明PtxA蛋白对抗坏血酸磷酸化具有特异性[27]。使用AutoDock软件进行簇分析时,默认标准为2.0 Å。将分子对接产生的10个对接结果按照结合能大小排序,找出结合能最小的构象结果,如图5(a)~图5(c),并将构象相近的对接结果结合成簇。PtxA蛋白与环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸的成簇分析结果如图5(d)~图5(f)。3个体系最优势簇占据绝对优势,表明结果收敛性较好。PtxA蛋白与3-苯乳酸、苯丙酸的结合能相差不大,分别为-22.0、-21.8 kJ/mol,PtxA蛋白与环亮氨酸脯氨酸二肽的结合能相对较弱,为-16.3 kJ/mol。
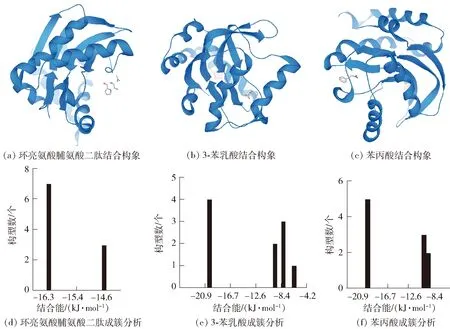
图5 3种代谢物与变异链球菌PtxA蛋白分子对接结果Fig.5 Molecular docking results of three metabolites with Streptococcus mutans PtxA protein
3种代谢物和白色念珠菌Fba蛋白分子对接分析结果见图6。将分子对接产生的10个对接结果按照结合能大小排序,找出结合能最小的构象结果,如图6(a)~图6(c),并将构象相近的对接结果结合成簇。Fba蛋白与环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸的成簇分析结果如图6(d)~图6(f)。3个体系最优势簇占据绝对优势,表明结果收敛性较好。Fba蛋白与3-苯乳酸、苯丙酸的结合能相差不大,分别为-17.7、-18.5 kJ/mol,而Fba蛋白与环亮氨酸脯氨酸二肽的结合能相对较强,为-23.1 kJ/mol。因此,环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸可以通过分子间相互作用力、范德华力、氢键等相互作用方式结合到变异链球菌和白色念珠菌的靶点蛋白上,从而发挥干预糖代谢,影响二者生物被膜形成的作用。
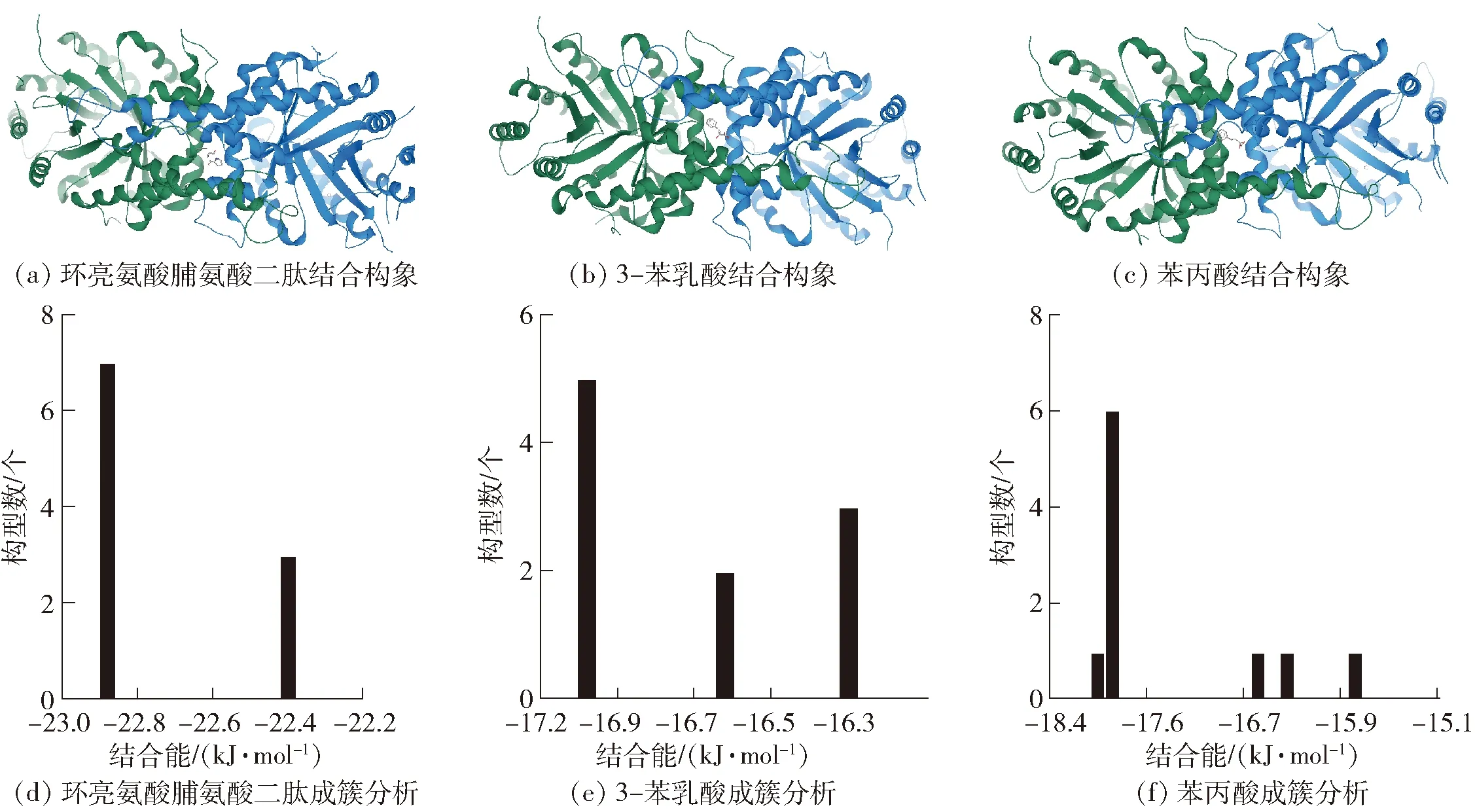
图6 3种代谢物与白色念珠菌Fba蛋白分子对接结果Fig.6 Molecular docking results of three metabolites with Candida albicans Fba protein
3 结 论
本研究揭示了环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸的组合物能够减少变异链球菌和白色念珠菌双菌生物被膜量、水不溶性胞外多糖及胞外蛋白产量、群体感应信号分子AI- 2产量,同时破坏生物被膜结构。分子对接结果从分子水平上揭示了组合物可能的作用机理,组合物可以与变异链球菌PtxA蛋白和白色念珠菌Fba蛋白靶点结合,其中,环亮氨酸脯氨酸二肽和白色念珠菌Fba蛋白具有较强的结合能力,而3-苯乳酸、苯丙酸与变异链球菌PtxA蛋白具有较强的结合能力,组合物与致病菌上的靶点蛋白结合进而影响其糖代谢,抑制二者形成生物被膜。本研究旨在为植物乳杆菌CCFM8724及其代谢物环亮氨酸脯氨酸二肽、3-苯乳酸、苯丙酸开发防龋的口腔益生菌和后生元产品提供一定的理论依据。
