基于GC×GC/TOF MS对不同等级食用酒精挥发性成分的判别分析
2022-10-11李良好孟士皓郑福平
李良好, 孟士皓, 景 思, 郑福平,*, 李 凡, 李 义, 佟 毅,*
(1.北京工商大学 食品质量与安全北京实验室/中国轻工业酒类品质与安全重点实验室, 北京 100048;2. 中粮生化能源(肇东)有限公司, 黑龙江 绥化 152001;3. 吉林中粮生化有限公司 玉米深加工国家工程研究中心, 吉林 长春 130033)
食用酒精是以谷物、薯类、糖蜜或其他可食用农作物为主要原料,经发酵、蒸馏精制而成的,供食品工业使用的含水酒精。GB 10343—2008规定,食用酒精可分为特级和优级。从感官上区分,特级和优级都具有乙醇固有的香气且香气纯正,口味纯净,微甜。从理化指标区分,特级酒精度(以乙醇计)不小于96.0%、氧化时间大于等于40 min、正丙醇质量浓度小于等于2 mg/L、酸(以乙酸计)质量浓度小于等于7 mg/L、酯(以乙酸乙酯计)质量浓度小于等于10 mg/L;优级酒精度不小于95.5%、氧化时间大于等于30 min、正丙醇质量浓度小于15 mg/L、酸(以乙酸计)质量浓度小于等于10 mg/L、酯(以乙酸乙酯计)质量浓度小于等于18 mg/L。因此,按照国标规定从感官品评上很难有效将优级和特级食用酒精准确区分。另外,由于食用酒精挥发性成分含量极低,而这些含量极低的挥发性成分又直接影响着食用酒精的口感及等级划分[1]。所以对食用酒精中挥发性成分及其含量的检测具有实际意义。目前国内外对食用酒精的分析主要集中在食用酒精中甲醇、杂醇油、乙酸乙酯等少数化合物的定性和定量分析,对食用酒精的全分析研究较少,且没有对不同等级食用酒精中的挥发性化合物进行分析研究。例如,李超等[2]应用GC- MS定量研究了食用酒精中甲醇、正丙醇、正丁醇、异丁醇、仲丁醇、正戊醇、异戊醇、仲戊醇和正己醇9种醇类化合物。华颖等[3]应用GC- MS测定了食用酒精中的氨基甲酸乙酯。除此之外,多篇文献也应用仪器分析法对食用酒精中的甲醇和杂醇油等进行研究[4-6]。
全二维气相色谱/飞行时间质谱(comprehensive two-dimensional gas chromatography/time of flight mass spectrometry, GC×GC/TOF MS)联用仪因高分辨率、高灵敏度、高峰容量等优点在白酒挥发性成分分析中广泛应用[7-9]。该技术结合标准品保留时间和NIST谱库定性,可高效分离并定性多种挥发性微量成分。因此,应用全二维气相色谱/飞行时间质谱联用技术对食用酒精中挥发性微量成分进行定性定量将更加有效。固液法白酒是以液态法白酒或以谷物食用酿造酒精为基酒,利用固态发酵酒醅或特制香醅串蒸或浸蒸,或直接与固态法白酒按一定比例调配而成的具有本品固有风格的白酒。由于调配时需加入食用酒精,因此加入食用酒精的质量等级不同将会影响固- 液法白酒的最终产品质量。李大和等[10]应用普通级、优级和特级三种不同等级食用酒精对固- 液法白酒生产进行感官品评分析,结果表明食用酒精等级越高,勾调出的白酒品质越好。然而对食用酒精等级区分的方法目前主要为感官评价法和仪器分析法[11-12]。感官评价法是依据品评师对酒精的外观、气味和口味作出评价进行分类。但由于品评师存在个体差异,以及长时间品评产生嗅觉疲劳等对样品等级评价造成系统误差。因此,为了使不同等级食用酒精的区分更加科学直观,利用现代仪器分析技术结合多元统计分析对其进行等级区分。主成分分析(principal component analysis,PCA)、偏最小二乘- 判别分析(partial least squares-discriminant analysis,PLS- DA)是目前应用比较成熟的多元统计分析方法,也广泛应用于酒类饮品不同香型、不同产地的判别区分[13-14]。Song等[15]通过液- 液萃取结合GC×GC/TOF MS对四川盆地和长江淮河流域的浓香型白酒进行检测,采用PCA和PLS- DA将二者进行有效区分和辨别,并采用层次聚类分析(hierarchical cluster analysis, HCA)对定量标记物进一步处理以进行目标分析,结果表明标记物具有很大的辨别力并且能有效将不同区域浓香型白酒区分。董画等[16]应用PEN3型便携式电子鼻结合PCA、线性判别分析(linear discriminant analysis, LDA)和方差分析(analysis of variance, ANOVA)等多元统计分析方法能有效地对哈达山纯粮食酒和掺兑酒精的酒进行鉴别区分。
本研究采用顶空固相微萃取(head space solid phase microextraction, HS- SPME)的前处理方法[17-18],结合GC×GC/TOF MS对优级、特级食用酒精中挥发性化合物进行分析,通过NIST14谱库、标准品保留时间和保留指数对挥发性物质进行定性分析,采用内标法定量。通过PCA、PLS- DA方法对两种等级食用酒精差异物进行分析,建立统计模型,可为不同等级食用酒精的客观辨别提供数据参考和理论支撑。
1 材料与方法
1.1 仪器与设备
全二维气相色谱/飞行时间质谱联用仪,美国LECO公司[具体配置如下:Agilent 7890B型气相色谱仪,美国Agilent公司;第二柱温箱,四喷口液氮型调制器及Pegasus 4D型飞行时间质谱仪,美国LECO公司,第一维柱为DB- WAX (30 m×0.25 mm×0.25 μm),第二维柱为Rxi- 5sill(0.1 m×0.15 mm×0.25 μm),两根色谱柱以串联方式连接];ML204T型电子分析天平,梅特勒- 托利多仪器(上海)有限公司;武仪酒精计,威尔仪表有限公司;DF- 101S型集热式恒温加热磁力搅拌器,予华仪器有限责任公司;VORTEX2型涡旋仪,德国IKA公司;10、100、200、1 000 μL移液枪,国药集团化学试剂有限公司;10 mL容量瓶,中科科仪有限公司;50/30 μm DVB/CAR/PDMS萃取头,德国Merck KGaA公司;固相微萃取手动进样器,美国Supelco公司。
1.2 材料与试剂
1.2.1实验材料
优级食用酒精编号YJ- 1、YJ- 2、YJ- 3,用酒精计测量酒精度(以乙醇计)为96.0%;特级食用酒精编号TJ- 4、TJ- 5、TJ- 6,用酒精计测量酒精度为97.5%。所有食用酒精样品均由中粮生化能源(肇东)有限公司提供。
1.2.2实验试剂
正丙醇、2-戊醇、异戊醇、正辛醇、正壬醇、苯乙醇、甲酸乙酯、乙酸乙酯、丙烯酸乙酯、丁酸乙酯、戊酸乙酯、己酸乙酯、庚酸乙酯、辛酸乙酯、壬酸乙酯、癸酸乙酯、苯甲酸乙酯、苯丙酸乙酯、乙酸、乙醛、2-甲基丁醛、3-甲基丁醛、庚醛、辛醛、壬醛、苯甲醛、丙酮、甲基庚烯酮、苯乙酮、乙缩醛、γ-丁内酯、2,6-二叔丁基对甲苯酚、2-正戊基呋喃、正己烷、正辛烷、苯乙烯、1-乙基-2-甲基苯、1-甲基萘、(-)-柠檬烯、邻二氯苯标准品,均为分析纯;C7~C27正构烷烃为色谱纯;氯化钠为分析纯;试剂均购自国药集团化学试剂有限公司。
1.3 食用酒精挥发性成分分析方法
1.3.1顶空固相微萃取方法
萃取条件参照课题组前期工作经验[8],以YJ- 1样品为例,取1.54 mL食用酒精样品放入顶空进样瓶中,加入13.46 mL煮沸冷却后的超纯水,使所测食用酒精样品稀释至酒精度为10%。加入4.5 g氯化钠至饱和,取质量浓度为200 mg/L邻二氯苯的乙醇溶液10 μL做为内标,加入磁力转子。在45 ℃恒温水浴下平衡20 min,萃取40 min。萃取结束后将其在250 ℃的进样口热解析5 min,进行GC×GC/TOF MS分析。每个样品平行实验3次。
1.3.2全二维气相色谱及质谱分析条件
全二维气相色谱条件。载气为He气,纯度99.999%,流速1 mL/min;进样口温度250 ℃;压力30 psi(206.84 kPa);手动进样;不分流。主柱温箱升温程序:初始温度50 ℃,保持2 min,以3 ℃/min升至120 ℃,以2 ℃/min升至150 ℃,以5 ℃/min升至230 ℃,保持10 min;第二柱温箱升温程序:高于主柱温箱5 ℃。调制器温度高于主柱温箱15 ℃。调制周期7 s;冷吹时间1 s。
飞行时间质谱条件。电子轰击(EI)离子源,电子能量70 eV,离子源温度250 ℃,传输线温度250 ℃,检测器电压-1 400 V,质量扫描区间范围m/z45~350,TOF MS采集频率100 Hz,离子源的灯丝在535~590 s时关闭。
1.3.3挥发性成分的定性和定量方法
GC×GC/TOF MS检测的总离子流图应用其自带的LECO Chroma TOF version 4D软件处理数据,采用NIST 2014谱库检索,选取匹配度在700以上的化合物,计算保留指数(RI)并比较测定保留指数与文献保留指数进行初步定性,部分化合物进一步通过标准品保留时间(S)准确定性。
采用内标半定量法来计算化合物含量。以邻二氯苯在总离子流图中的峰面积为对照,通过目标化合物与内标物的峰面积和含量对比,得到被检测物质的含量。根据公式(1)计算出挥发性成分的量。
(1)
式(1)中,mi为待测组分质量浓度;Ai为化合物的峰面积;ms为内标化合物质量浓度,mg/L;As为内标物峰面积;fi为待测组分对内标物的质量校正因子,令其为1。
1.4 数据统计
每组实验重复3次,如以YJ- 1- 1、YJ- 1- 2、YJ- 1- 3分别表示YJ- 1样品的3次平行实验结果,其他组编号与其相似。所有数据重复测量3次,计算平均值和标准偏差。采用SPSS 22.0统计分析软件对食用酒精样本均值、标准差及显著性进行分析。应用SIMCA 14.1软件对优级和特级食用酒精中主要挥发性化合物的含量差异进行主成分和偏最小二乘法判别分析,根据变量投影重要性(variable important for the projection,VIP)值判断2种等级食用酒精中主要差异性化合物。
2 结果与讨论
2.1 食用酒精挥发性成分分析结果
通过HS- SPME结合GC×GC/TOF MS对6种食用酒精样品中的挥发性成分进行定性和定量分析,结果见表1。
结果显示,6个食用酒精样品中共检测出60种化合物,其中醇类6种,酯类14种,酸类1种,醛类9种、酮类6种,缩醛类1种,内酯类1种,酚类1种,呋喃类1种,脂肪烃类4种,芳香烃类15种和萜烯类1种。采用保留指数的定性方法在6个酒样中共定性出化合物48种,其中,采用标准品保留时间对比的定性方法鉴定出化合物39种。
食用酒精样品中共检测到醇类化合物6种,除了1-壬醇和苯乙醇只在优级酒精中检出。其他所有醇类化合物均在两种酒精中检测到,且在优级酒精中醇类化合物的平均浓度高于特级酒精的。其中,2-戊醇含量最高,其在优级中质量浓度为5.61 μg/L,在特级中质量浓度为3.54 μg/L。
共检出酯类化合物14种,其中,己酸乙酯含量最高,在优级酒精和特级酒精中的平均质量浓度为573.06 μg/L和381.74 μg/L;乙酸乙酯次之,在优级酒精和特级酒精中的平均质量浓度为116.36 μg/L,51.06 μg/L。且乙酸乙酯在优级酒精中的平均含量是特级酒精的2.28倍,而己酸乙酯在优级酒精中的平均含量是特级酒精的1.5倍。月桂酸乙酯、苯甲酸乙酯和苯丙酸乙酯在特级酒精中均未检出。除此之外,丙烯酸乙酯、丁酸乙酯、戊酸乙酯、庚酸乙酯的平均浓度在优级酒精中高于特级酒精,甲酸乙酯、辛酸乙酯和壬酸乙酯在两种等级酒精中的含量相差不多。值得注意的是,癸酸乙酯和邻苯二甲酸二丁酯的平均浓度则在特级酒精中高于优级酒精,且癸酸乙酯在特级酒精中的平均浓度是优级酒精的2.5倍。
醛类化合物共9种,所有醛类化合物在两种等级酒精中均检出。其中,乙醛含量最高,在优级酒精和特级酒精中的平均质量浓度分别为170.76 μg/L和172.29 μg/L。壬醛含量次之,在两种酒精中的平均质量浓度分别为152.70 μg/L和80.96 μg/L。苯甲醛在优级酒精中的平均浓度是特级酒精的2.7倍,其他醛类化合物含量在优级酒精中略高于特级酒精。
酮类化合物共6种,除了2-戊酮只在优级酒精中检出,其他化合物在两种等级酒精中均检出。丙酮在优级酒精中的平均浓度高于特级酒精,苯乙酮、3-十一酮、甲基庚烯酮和3-十三酮的含量在两种等级酒精中大致相等。
脂肪烃类化合物4种,所有脂肪烃类化合物在两种等级酒精中均检出。其中,2,4,6-三甲基辛烷含量最高,且在优级酒精和特级酒精中的平均质量浓度分别为59.52 μg/L和83.95 μg/L;在特级酒精中浓度明显高于优级酒精。
芳香烃类化合物15种,1-甲基-2-异丙基苯只在优级酒精中检出,而1-甲基茚满只在优级酒精中检出,其他所有芳香烃类化合物在两种等级酒精中均检出。其中,苯乙烯含量最高,在优级酒精和特级酒精中的平均质量浓度分别为60.96 μg/L和19.85 μg/L。4-乙基甲苯和顺-β-甲基苯乙烯两种化合物在特级酒精中平均浓度高于优级酒精,1,2-二甲苯和1,2,4,5-四甲苯化合物在两种等级酒精中含量相差不多,其他所有芳香烃类化合物含量在优级酒精中都高于特级酒精。
在两种酒精中共检测到1种缩醛类化合物为乙缩醛,1种酸类化合物为乙酸,1种内酯类化合物γ-丁内酯,1种酚类化合物2,6-二叔丁基对甲苯酚,1种呋喃类化合物2-正戊基呋喃,1种萜烯类化合物(-)-柠檬烯。其中,乙酸只在优级酒精中检出,2-正戊基呋喃化合物在特级酒精中平均浓度高于优级酒精,其他类化合物在两种等级酒精中均检出且含量在优级酒精中都高于特级酒精。
因此,除了乙醛、甲基庚烯酮、3-十三酮、2-正戊基呋喃、正辛烷、2,4,6-三甲基辛烷、3-甲基十三烷、4-乙基甲苯、顺-β-甲基苯乙烯、1,2-二甲苯和1,2,4,5-四甲苯化合物含量在特级酒精中略高于优级酒精外,其他大多数化合物在优级酒精中的含量是高于在特级酒精中的。对于同一种化合物在优级酒精中的含量高于在特级酒精中的主要原因是生产工艺中操作流程的差异造成的。食用酒精生产工艺主要有五塔和七塔差压蒸馏,随着科学技术的进步,最新生产工艺已经达到八塔差压蒸馏。而该研究中特级酒精和优级酒精生产的主要差别在于生产工艺的控制操作上。特级酒精在回流塔、水洗塔、甲醇塔和精馏塔上的重复操作次数相比优级酒精更多,因此生产出的化合物在特级酒精中的种类和含量相比优级酒精中的也相对较少。同时实验所得的结果与GB 10343—2008《食用酒精》中规定的相符合,即特级酒精中存留的化合物种类和含量要小于优级酒精中的。
2.2 食用酒精等级判别模型的建立
2.2.1PCA辨别模型的建立
PCA是无监督模式下进行的探索性分析,在模型建立之前对不同样本初步的判断是否存在差异[19]。对不同等级食用酒精初步判别结果见图1,通过PCA得分图可以看出2种等级的酒精在第一主成分上是能明显区分的。并且前2个主成分对应特征值累计贡献率为51.3%,说明主成分分析能较好地分析判断不同等级酒精中挥发性化合物含量的大部分信息。实验样本数据从图2 Hotelling T2分布图可以得出所有样本数均在95%的置信区间内没有明显异常值,说明实验样本数据都在正常值范围内。
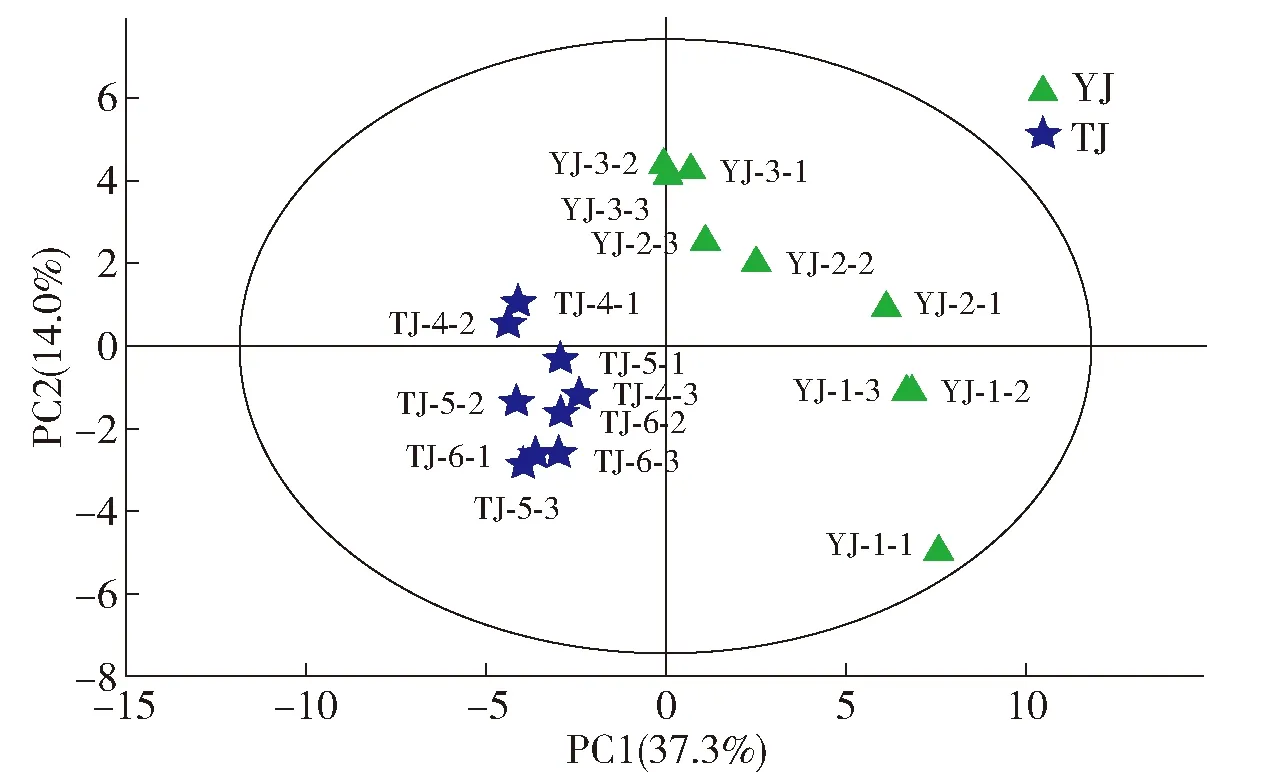
YJ为优级食用酒精样品;TJ为特级食用酒精样品。图1 优级和特级食用酒精的PCA判别Fig.1 PCA discrimination of superior and super grade edible alcohol
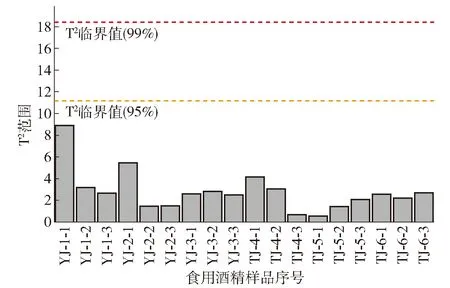
图2 优级和特级食用酒精的Hotelling T2分布Fig.2 Hotelling T2 value range plot of superior and super grade edible alcohol
2.2.2PLS-DA辨别模型的建立
PLS- DA为有监督性分析,通过对变量空间的投影旋转找出类别判别的潜在变量,可有效避免主成分分析中代表样本类别的方向与方差最大方向不一致的情况[20],能按照预先定义的分类最大化组间的差异,并可减少组内差异,进一步挖掘数据中的信息,量化特征化合物造成组分差异的程度。PLS- DA判别模型以从研究结果中筛选的49个挥发性化合物含量为X变量,以不同等级酒精样品为Y变量进行PLS- DA回归模型建立,分析结果见图3。从PLS- DA得分图中可以看出,两种不同等级的酒精被明显区分。因变量拟合指数(R2Y)为0.966,模型预测精度(Q2)为0.934,这说明该模型对分析不同等级酒精的化合物含量特征具有较好的稳定性和预测能力。
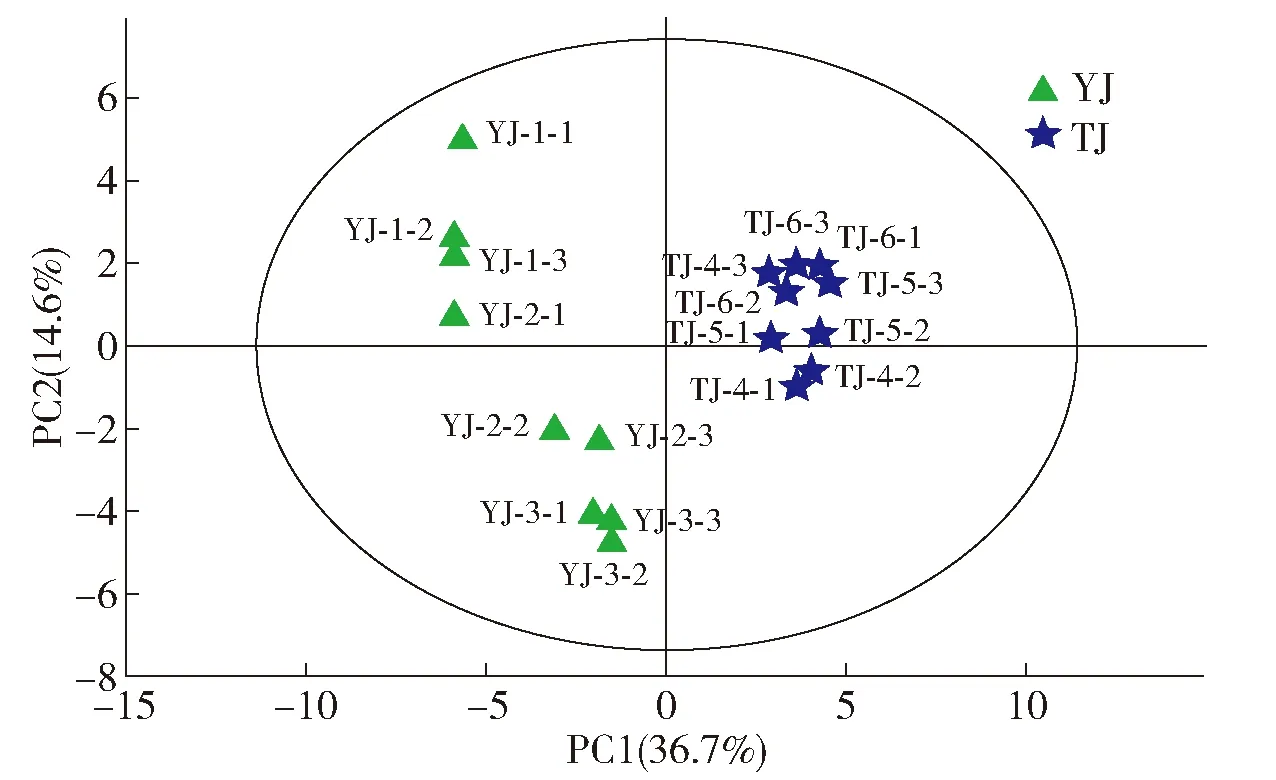
YJ为优级食用酒精样品;TJ为特级食用酒精样品。图3 优级和特级食用酒精的PLS- DA判别Fig.3 PLS- DA discrimination of superior and super grade edible alcohol
2.3 不同等级食用酒精中主要差异化合物
PLS- DA因子载荷图是反应每一个变量在得分图上的贡献。一般认为,分布越密集的自变量对不同等级酒精中化合物含量区分影响越小;反之,离密集区越远的自变量且接近因变量的变量对区分不同等级酒精中化合物含量影响越大[21]。图4、图5中数字编号为表1中的化合物序号。并且图4中,X的颜色表示不同化合物变量,Y的颜色代表两种等级酒精。对2种等级食用酒精做因子载荷图分析,结果如图4,乙缩醛(编号为37)、丁酸乙酯(编号为10)、2,6-二叔丁基对甲苯酚(编号为39)、苯乙烯(编号为46)、己酸乙酯(编号为12)、戊酸乙酯(编号为11)和庚酸乙酯(编号为13)共7个化合物组分含量相关且与优级酒精类别较接近,可以作为优级酒精的特征挥发性组分;异戊醇(编号为3)、癸酸乙酯(编号为16)和乙醛(编号为22)共3个化合物组分含量显著相关并与特级酒精类别较接近,故可以作为特级酒精的特征组分。
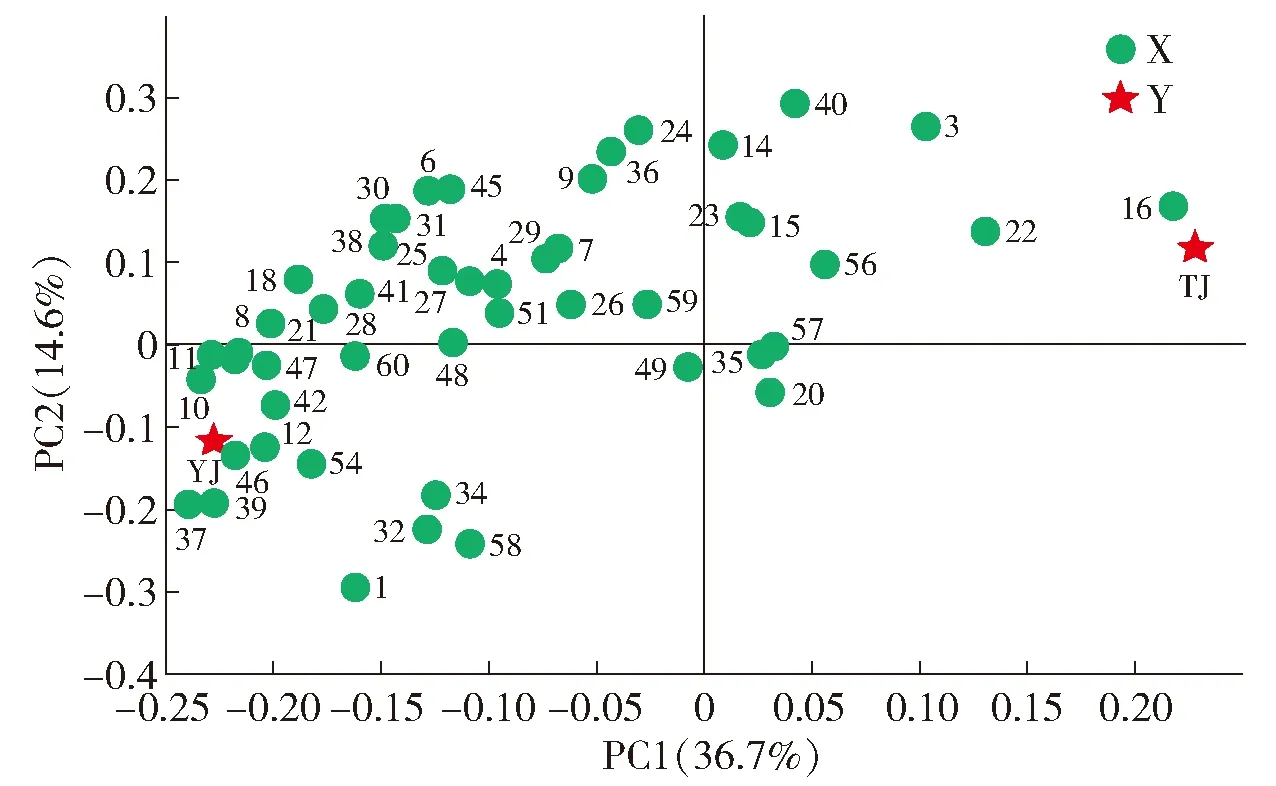
X为食用酒精中挥发性化合物;Y为2种等级食用酒精类别,YJ为优级食用酒精,TJ为特级食用酒精;图中化合物编号同表1。图4 优级和特级食用酒精挥发性成分的PLS- DA载荷Fig.4 Loading plot of PLS- DA of volatile components of superior and super grade edible alcohol
为了帮助选择贡献较大的差异组分,变量投影重要性(variable important for the projection,VIP)值被作为多维模型差异元素选择的指标。一般情况下认为,VIP值大于1的组分即为多维模型的贡献变量。VIP值大于1.5的组分可被标记为极显著的贡献变量[22]。为了从两种等级酒精中选择贡献较大的差异组分,对两种等级酒精做了变量投影重要性排序,结果如图5所示,VIP值大于1的化合物组分共23种,分别为乙缩醛(编号为37)、丁酸乙酯(编号为10)、2,6-二叔丁基对甲苯酚(编号为39)、戊酸乙酯(编号为11)、癸酸乙酯(编号为16)、苯乙烯(编号为46)、庚酸乙酯(编号为13)、乙酸乙酯(编号为8)、己酸乙酯(编号为12)、乙酸(编号为21)、正辛烷(编号为42)、苯甲酸乙酯(编号为18)、丙醇(编号为1)、1-甲基萘(编号为54)、壬醛(编号为28)、正己烷(编号为41)、苯甲醛(编号为30)、1,2,3,4-四氢萘(编号为49)、正丙苯(编号为47)、顺-β-甲基苯乙烯(编号为53)、(-)-柠檬烯(编号为60)、γ-丁内酯(编号为38)、己醛(编号为25)。其中VIP值大于1.5的化合物组分共4种,分别为乙缩醛(编号为37)、丁酸乙酯(编号为10)、2,6-二叔丁基对甲苯酚(编号为39)和戊酸乙酯(编号为11)。其中,特级食用酒精中的癸酸乙酯、正辛烷、顺-β-甲基苯乙烯含量显著高于优级食用酒精;优级食用酒精中乙缩醛、丁酸乙酯、2,6-二叔丁基对甲苯酚、戊酸乙酯、苯乙烯、庚酸乙酯、乙酸乙酯、己酸乙酯、乙酸、苯甲酸乙酯、丙醇、1-甲基萘、壬醛、正己烷、苯甲醛、1,2,3,4-四氢萘、正丙基苯、(-)-柠檬烯、γ-丁内酯、己醛含量显著高于特级食用酒精。这些化合物组分即为造成不同等级食用酒精差异的主要标志性化合物。而两种等级食用酒精挥发性成分相对含量差异最大的乙缩醛、丁酸乙酯、2,6-二叔丁基对甲苯酚和戊酸乙酯4种化合物是PLS- DA模型区分不同等级食用酒精的显著标志性化合物。
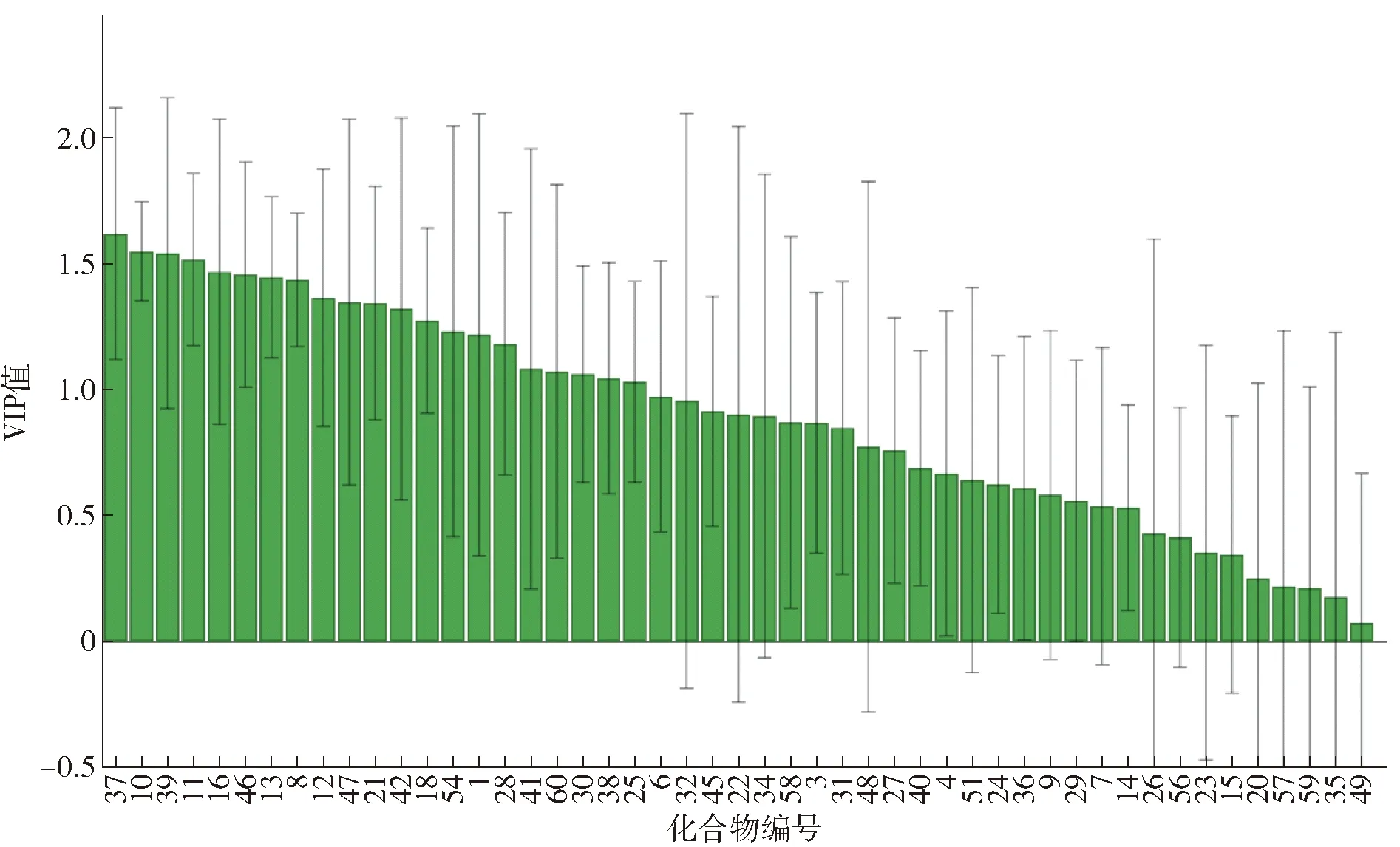
化合物编号同表1。图5 优级和特级食用酒精挥发性成分的PLS- DA变量投影重要性排序Fig.5 Projection importance ranking of PLS- DA variables for volatile components of superior and super grade edible alcohol
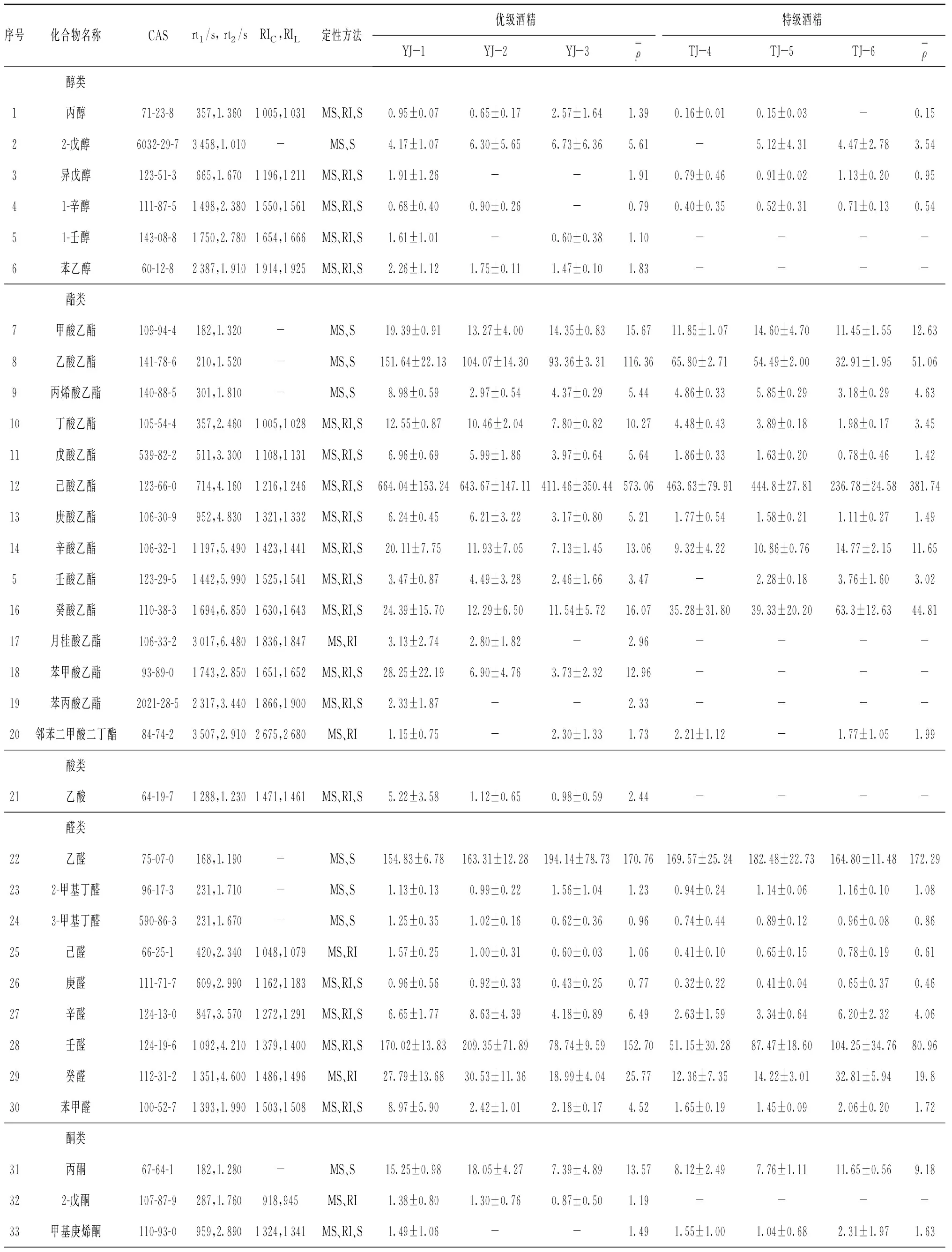
表1 优级和特级食用酒精中挥发性化合物
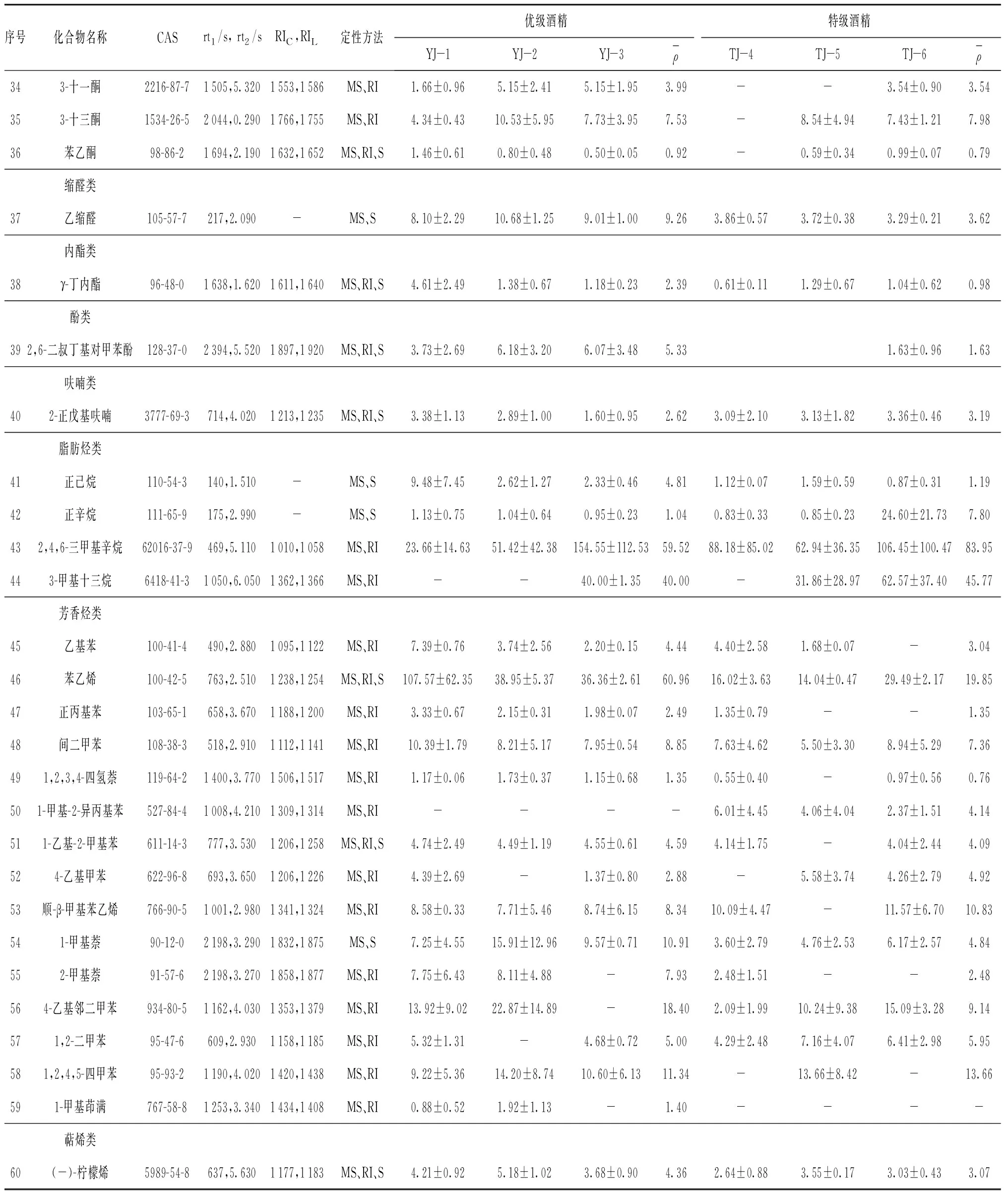
续表1
3 结 论
食用酒精中挥发性成分含量极低,而这些微量的挥发性化合物很难用一般的质谱检测出。因此,本研究采用顶空固相微萃取的前处理方法,结合全二维气相色谱/飞行时间质谱联用技术对两种等级食用酒精中挥发性化合物进行定性定量分析。结果共检测出60种挥发性化合物,其中,醇类6种,酯类14种,酸类1种,醛类9种,酮类6种,缩醛类1种,内酯类1种,酚类1种,呋喃类1种,脂肪烃类4种,芳香烃类15种,萜烯类1种。之后以不同等级食用酒精中挥发性成分为变量,采用主成分分析(PCA)、偏最小二乘- 判别分析(PLS- DA)等多元统计学方法建立了食用酒精等级判别模型,找出了两种等级食用酒精的主要差异化合物。其中,PCA辨别模型的前两个主成分贡献率为51.3%,说明模型具有较好的食用酒精等级区分能力;PLS- DA辨别模型的因变量拟合指数为0.966,模型预测精度为0.934,说明模型具有较好的稳定性和预测能力。基于变量投影重要性分析,从两种等级食用酒精定量出的挥发性化合物中判别出23种可区分优级、特级食用酒精的主要差异化合物。其中,特级食用酒精中的癸酸乙酯、正辛烷、顺-β-甲基苯乙烯含量显著高于优级食用酒精;优级食用酒精中乙缩醛、丁酸乙酯、2,6-二叔丁基对甲苯酚、戊酸乙酯、苯乙烯、庚酸乙酯、乙酸乙酯、己酸乙酯、乙酸、苯甲酸乙酯、丙醇、1-甲基萘、壬醛、正己烷、苯甲醛、1,2,3,4-四氢萘、正丙基苯、(-)-柠檬烯、γ-丁内酯、己醛含量显著高于特级食用酒精。这些化合物组分即为造成不同等级食用酒精差异的主要标志性化合物。而两种等级食用酒精挥发性成分相对含量差异最大的乙缩醛、丁酸乙酯、2,6-二叔丁基对甲苯酚和戊酸乙酯4种化合物是PLS- DA模型区分不同等级食用酒精的显著标志性化合物。因此,应用现代仪器分析技术结合多元统计分析对食用酒精进行等级区分是行之有效的方法,希望此研究结果可为不同等级食用酒精的客观辨别提供数据参考和理论支撑。
