全球重组蛋白疫苗研发态势简析*
2022-10-11杨潇逸欧阳昭连
杨潇逸,陈 娟,严 舒,卢 岩,欧阳昭连
(中国医学科学院医学信息研究所,北京 100020)
重组蛋白疫苗是一类不包含任何完整病原体,主要由可在异源表达系统中生产的特定蛋白质抗原配制而成的疫苗[1]。根据所需生产抗原的不同,可采用细菌、酵母菌、昆虫细胞、植物细胞、哺乳动物细胞系等不同的异源表达系统[2-3]。从目标病毒或细菌中提取特定抗原的DNA片段并插入细胞的基因组或质粒中,这些表达系统便能产生对应的蛋白质抗原,随后将蛋白质提纯作为疫苗的活性成分。此外,重组蛋白疫苗中通常会添加佐剂,以加强和延长接种者对疫苗的免疫反应[4]。与使用完整病原体配制而成的疫苗相比,重组蛋白疫苗能使免疫反应集中在识别少量目标抗原上,且对免疫功能低下者更安全。由于重组蛋白疫苗具有安全性高、稳定性强、成本较低等优点,已被广泛用于预防乙型病毒性肝炎(简称乙肝),百日咳、白喉、破伤风(简称百白破),流行性感冒(简称流感)等多种传染病。自新型冠状病毒肺炎(简称新冠肺炎)疫情暴发以来,全球已有多款针对新型冠状病毒的重组蛋白疫苗进入临床研究阶段[5]。为此,本研究中探讨了全球重组蛋白疫苗的研发态势。现报道如下。
1 资料与方法
采用计算机检索Cortellis数据库中全球已上市、处于注册或预注册状态、已启动Ⅲ期临床试验的重组蛋白疫苗的相关信息,检索时间为自建库起至2021年9月1日,形成数据集。分别从原研单位国家分布、首次上市/Ⅲ期临床试验启动时间、适应证等方面分析其全球研发概况,并基于原研单位国家分析各国在重组蛋白疫苗领域的研发进展。对于有多个适应证的产品,按其上市进展处于最高状态的适应证划分。由于样本量较小,本研究中仅作描述性分析,未进行统计学检验。
2 结果
2.1 全球研发概况
原研单位国家分布:截至检索时间,全球已有74个重组蛋白疫苗上市销售,或处于预注册或注册状态。从原研单位国家分布来看,中国原研产品数量最多(21个),美国位居第二(15个),其次为英国(11个)、古巴(5个)和法国(4个)。其中,36个产品在多个国家或地区上市或处于注册、预注册状态,39个产品仅在1个国家上市或处于注册、预注册状态。此外,全球范围内还有29个产品已进入Ⅲ期临床试验阶段,同样以中国原研产品数量最多(12个),其次为美国(7个)和日本(3个)。详见图1。

图1 全球重组蛋白疫苗原研单位国家分布Fig.1 Distribution of countries where institutions researching the recombinant protein vaccine located in the world
首次上市/Ⅲ期临床试验启动时间:由图2可知,23个产品于2016年至2021年首次启动Ⅲ期临床试验,超过该时间段内上市、注册或预注册的重组蛋白疫苗数量21个。
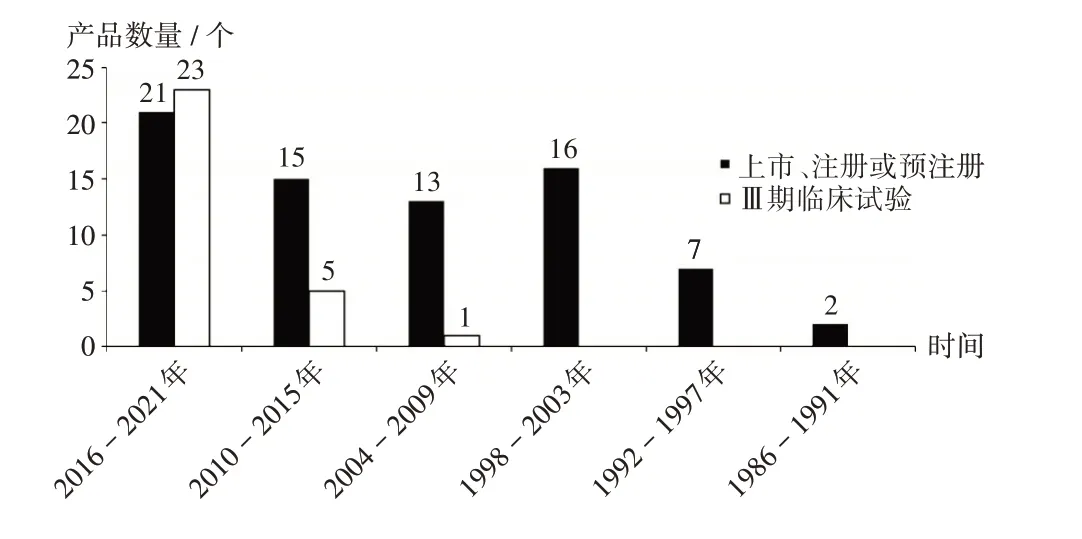
图2 全球重组蛋白疫苗首次上市或Ⅲ期临床试验启动时间分布Fig.2 Distribution of time to market for the first time or time to start the phaseⅢclinical trial of recombinant protein vaccine in the world
适应证分布:74个已上市、注册或预注册产品中,适应证涵盖乙肝病毒感染的产品数量最多(30个),其次为百白破(18个)、流感嗜血杆菌感染(12个)、流感病毒感染(11个)、脑膜炎奈瑟球菌感染(6个)、脊髓灰质炎病毒感染(6个)。其中,14个产品同时涵盖百白破和其他1种以上适应证。29个进入Ⅲ期临床试验阶段的产品中,适应证为流感病毒感染的产品数量最多(6个);其次为人乳头状瘤病毒(HPV)感染(5个)、非HPV感染引起的肿瘤(4个)、肺炎链球菌感染(3个),上述3类适应证的产品数量均超过对应的已上市产品数。对于有多个适应证的产品,仅统计已获批上市或已进入Ⅲ期临床试验阶段的适应证。
2.2 代表性国家研发进展
中国:有21个产品处于上市、预注册或注册状态,其中最早上市的产品为1997年由北京天坛生物制品股份有限公司、武汉生物制品研究所有限责任公司和兰州生物制品研究所共同研制的吸附无细胞百白破联合疫苗,14个产品于2014年及以前上市或预注册,11个产品的适应证为百白破、乙肝或流感嗜血杆菌感染;仅4个产品在中国以外的国家上市或注册,分别为中国疾病预防控制中心研制的重组乙型肝炎疫苗(CHO细胞)、国家传染病诊断试剂与疫苗工程技术研究中心研制的重组戊型肝炎疫苗(商品名益可宁,大肠埃希菌)、中国科学院微生物研究所和重庆智飞生物制品股份有限公司研制的重组新型冠状病毒疫苗(商品名智克威得,CHO细胞)[6]和中国医药集团有限公司研制的重组新型冠状病毒疫苗(CHO细胞)。12个处于Ⅲ期临床试验阶段的疫苗中,8个产品在2020年及以后启动,其中5个产品为全球仅有的处于Ⅲ期临床试验阶段的HPV疫苗,原研单位分别为成都生物制品研究所有限责任公司、上海博唯生物科技有限公司(2个产品)、北京康乐卫士生物技术股份有限公司和江苏睿捷生物科技有限公司;其他产品适应证涵盖脑膜炎奈瑟球菌感染、流感病毒感染、伤寒沙门菌感染、肺炎链球菌感染和新型冠状病毒感染。
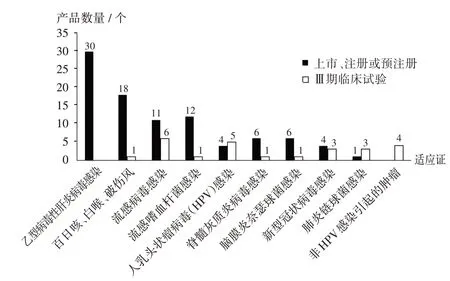
图3 全球重组蛋白疫苗适应证分布Fig.3 Distribution of indications of recombinant protein vaccine in the world
美国:有15个产品处于上市、预注册或注册状态,其中最早上市的产品为1986年于原德意志联邦共和国上市的由Merck&CO.,Inc.研发的乙肝疫苗Recombivax HB,同时也是全球最早上市的重组蛋白疫苗[7],8个产品于2014年及以前上市;除美国Chiron公司(已被瑞士诺华公司收购)开发的B型脑膜炎疫苗(新西兰菌株)仅在新西兰上市外,其他14个产品均在全球多个国家和地区上市。7个处于Ⅲ期临床试验的疫苗中,适应证涵盖流感病毒感染、呼吸道合胞病毒感染、艰难梭状芽孢杆菌感染、非小细胞肺癌和获得性免疫缺陷综合征;除美国Protein Sciences公司的流感疫苗FluNhance和美国诺瓦瓦克斯医药公司的流感疫苗NanoFlu外,其他5个产品均在美国及以外的多个国家开展临床试验。
英国:有11个产品处于上市或注册状态,且原研单位均为英国葛兰素史克公司,最早上市的产品为1997年于德国上市的甲型病毒性肝炎和乙肝疫苗Twinrix,除1款预防恶性疟原虫感染的疟疾疫苗于2019年上市外,其余产品均在2005年及以前上市;除百白破和乙肝四联疫苗Infanrix Hep B仅在新西兰与百白破、乙肝和脊髓灰质炎五联疫苗Pediarix仅在美国上市外,其余产品均在包括英国在内的多个国家和地区上市。截至检索时间,英国尚无处于Ⅲ期临床试验阶段的重组蛋白疫苗。
古巴:有5个产品上市,适应证涵盖乙肝、丁型病毒性肝炎、流感、百白破和脑膜炎,除1991年于古巴上市的B型脑膜炎疫苗由古巴芬莱研究院研制外,其余4个产品均由古巴遗传工程与生物技术中心研制;4款疫苗仅在古巴上市,最新产品为2018年上市的乙肝疫苗ABX-203。截至检索时间,古巴尚无处于Ⅲ期临床试验阶段的重组蛋白疫苗。
日本:尚无已上市产品,仅3个产品进入Ⅲ期临床试验阶段,启动时间均在2017年及以前,且适应证全部与肿瘤相关,分别为久留米大学研制的用于治疗激素抵抗性前列腺癌肽疫苗、Onco Therapy Science,Inc.研制的用于治疗食道肿瘤的疫苗S-588410、Tella公司研制的用于治疗胰腺肿瘤的疫苗Vaccell[8]。
3 讨论
3.1 研发和上市时间趋势
全球首次上市或进入Ⅲ期临床试验阶段的产品数量随时间的推移,均呈现稳步上升趋势。自乙肝疫苗Recombivax HB于1986年上市以来,蛋白质重组技术在疫苗中的应用得到飞速发展[7],有6个产品于1997年获批上市,为截至检索时间重组蛋白疫苗上市数量最多的年份。2017年至2021年,上市、注册或预注册的重组蛋白疫苗数量达19个(25.68%),处于Ⅲ期临床试验阶段的达20个,超过同期已上市产品数量的总和,预计在未来5~10年内有更多产品上市。
3.2 适应证分布
早期获批上市产品的适应证以全球患病人口基数较大、通过公共卫生防治措施较难根除的流行病为主,如乙肝、脊髓灰质炎、流感等,全球有多家研究机构和企业进行研制,产品同质性较高。随着新生儿需要接种疫苗数量的逐渐增加及技术的逐渐成熟,同时涵盖多种适应证的联合疫苗开始获批上市。最常见的联合疫苗为以百白破三联疫苗为基础的百白破+乙肝疫苗(如英国葛兰素史克公司研制的Infanrix Hep B)、百白破+流血嗜血杆菌疫苗(如法国赛诺菲巴斯德公司研制的Actacel)、百白破+脊髓灰质炎病毒(如英国葛兰素史克公司研制的Kinrix)等四联疫苗,以及上述适应证间进一步组合形成的五联甚至六联疫苗,能减少接种次数。目前,中国仅有1款国产四联疫苗上市,即由北京民海生物科技有限公司研制的无细胞百白破b型流感嗜血杆菌联合疫苗,但五联和六联疫苗尚未有成熟产品。
近年来,全球重组蛋白疫苗的适应证逐渐多元化,出现一批适应证为HPV感染、脑膜炎奈瑟球菌感染、肺炎链球菌感染、恶性疟原虫感染、呼吸道合胞病毒感染等的产品,但目前多数仍处于临床研究阶段。自新冠肺炎疫情暴发以来,已有4款预防新型冠状病毒感染的重组蛋白疫苗上市,分别为美国诺瓦瓦克斯医药公司研制的NVX-CoV2373[9]、中国科学院微生物研究所和重庆智飞生物制品股份有限公司研制的重组新型冠状病毒疫苗(CHO细胞)[6]、中国医药集团有限公司研制的重组新型冠状病毒疫苗(CHO细胞)和俄罗斯“矢量”国家病毒学与生物技术国家科学中心研制的肽疫苗;3款预防新型冠状病毒感染的疫苗处于Ⅲ期临床试验阶段,分别为三叶草生物制药有限公司研制的SCB-2019[10]、法国赛诺菲巴斯德公司研制的Vidprevtyn[11]和越南Nanogen Biopharmaceutical公司研制的Nanocovax[12]。
除传染病外,部分重组蛋白疫苗围绕肿瘤等适应证进行开发,如日本有3个产品分别针对激素抵抗性前列腺癌、食道肿瘤和胰腺肿瘤[8],以及法国OSE Immunotherapeutics公司研制的治疗非小细胞肺癌的OSE-2101[13]。然而,这些产品仍处于Ⅲ期临床试验研究阶段,且首次启动日期均在2017年及之前,至2021年以来再无新产品进入Ⅲ期临床试验阶段。因此,重组蛋白疫苗应用于癌症治疗的前景尚不明朗,可能需要在技术层面取得进一步突破后才能迎来大规模应用。
3.3 上市地点
研制这类产品的主要目的是满足本国群众对相应传染病预防的基本需求,故大部分产品的首次上市地点均为原研单位所在国家,如1992年由韩国株式会式LG生命科学研制的韩国首个乙肝疫苗,1997年由印度Shantha Biotechnics公司研制的印度首个乙肝疫苗Shanvac-B,1997年由北京天坛生物制品股份有限公司、武汉生物制品研究所有限责任公司和兰州生物制品研究所研制的中国首个吸附无细胞百白破联合疫苗等。总体而言,大部分发达国家原研单位研制的产品上市地点遍布全球多个国家和地区,而中国、印度、古巴和俄罗斯等国研制的产品大多仅在本国上市。究其原因:1)国外产品研发和上市起步较早,可在没有同类产品竞争的情况下优先抢占大部分市场,如Merck&Co.,Inc.于1986年便已上市首款乙肝病毒疫苗;2)国外产品更新迭代和技术积累较快,后发国家的产品与之相比无优势,如英国葛兰素史克公司在2001年上市的百白破、流感嗜血杆菌、脊髓灰质炎和乙肝六联疫苗Infanrix hexa[14],涵盖适应证数量超过其他所有同类疫苗;3)早年中国制药企业国际化能力普遍较弱,不熟悉国外药品的监管法规,取得上市许可的难度较大,但随着产业成熟度的提升,这一现象将逐渐改善,如中国科学院微生物研究所和重庆智飞生物制品股份有限公司联合开发的重组蛋白新型冠状病毒疫苗(CHO细胞)已在乌兹别克斯坦和哥伦比亚等国获得紧急使用授权,为全球抗疫贡献中国力量。
3.4 原研单位及所在国家
国外产品的原研单位以大型制药企业为主,如英国葛兰素史克公司上市产品数量全球最多(11个),其次为美国Chiron公司(6个)和法国赛诺菲巴斯德公司(4个)。中国和古巴的原研单位以研究机构为主,如古巴遗传工程与生物技术中心和兰州生物制品研究所均拥有4个上市产品。近年来,越来越多的产品由新兴小型企业率先进行研发,如上海博唯生物科技股份有限公司研制的目前处于Ⅲ期临床试验阶段的四价和九价HPV疫苗,以及厦门万泰沧海生物技术有限公司研制的已上市的双价人乳头瘤病毒疫苗(大肠杆菌)等。
全球重组蛋白疫苗商业化起步较早,上市产品数量逐渐增加,获批适应证以传染性疾病为主,自新冠肺炎疫情暴发以来也有多款针对新型冠状病毒的预防性疫苗获批上市或进入临床试验阶段,但在肿瘤治疗领域的产品开发程度还较有限。中国重组蛋白疫苗产品的上市和处于Ⅲ期临床试验阶段的数量均全球领先,但许多早期产品的同质化程度较高,在海外成功上市的产品数量较少,未来有待进一步提升。
