磷脂酰肌醇-4-磷酸酯代谢酶及抑制剂研究进展*
2022-10-11李艳平
李艳平,李 晨
(中国人民解放军陆军军医大学大坪医院药剂科,重庆 400042)
磷酸肌醇(PIs)又称磷脂酰肌醇磷酸酯,是磷脂酰肌醇(PtdIns)的磷酸化产物。PtdIns的肌醇部分包含5个羟基,其中第3,4,5位羟基被激酶磷酸化后,形成7种磷酸肌醇。磷脂酰肌醇-4-磷酸酯(PI4P)由4位羟基磷酸化生成,广泛分布于高尔基体、溶酶体、内质网、晚期内体、质膜[1]。PI4P作为一种膜磷脂,在维持细胞功能稳定中起着重要作用,其代谢是一个复杂、多酶调控的生物过程。PI4P代谢酶在炎症、肿瘤、病毒复制中的作用研究已取得一定进展,相关抑制剂的研发也在推进中。现综述如下。
1 PI4P的生理功能
PI4P主要分布在高尔基体,是囊泡运输、信号传导和代谢功能的主要调节剂[2]。囊泡萌发是高尔基体到质膜运输的关键步骤,PI4P影响高尔基体囊泡产生的主要作用机制:1)PI4P与高尔基体磷蛋白3(GOLPH3)结合后,诱导细胞内高尔基体膜弯曲,为高尔基体到质膜的有效囊泡运输创造条件[3]。2)四磷酸适配蛋白与PI4P结合,靶向高尔基体,形成PI4P-四磷酸适配蛋白域而作用于膜运输[4]。3)高尔基体相关蛋白激酶Cε通过与PI4P相互作用而调节高尔基体囊泡的形成[5]。PI4P含量的改变直接或间接作用于高尔基体的囊泡运输、信号传导等功能。研究发现,核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)与反式高尔基体上的PI4P结合,促进凋亡相关斑点样蛋白(ASC)聚集,激活NLRP3,且NLRP3与PI4P结合募集在反式高尔基体发生在NLRP3炎性体激活前[6]。该研究首次揭示了反式高尔基体与炎症激活之间的联系。
2 PI4P的代谢酶及抑制剂
2.1 总体研究情况
PI4P是PtdIns的磷酸化产物,也是磷脂酰肌醇(3,4)-双磷酸酯[PI(3,4)P2]和磷脂酰肌醇(4,5)-双磷酸酯[PI(4,5)P2]的前体物质[2]。作为磷酸肌醇的重要中间产物,调控PI4P稳态的代谢酶共有6种,分别为磷脂酰肌醇-3-激酶(PI3K)、磷脂酰肌醇-4-激酶(PI4K)、磷脂酰肌醇-4-磷酸-5-激酶(PI4P5K)3种脂质激酶,以及磷脂酰肌醇磷酸酶1(SAC1)、磷酸肌醇5-磷酸酶(PI5-phosphatases)、磷酸酶和张力蛋白同源物(PTEN)3种磷酸酶。PI4P代谢转化过程见图1。

图1 PI4P代谢转化过程Note:refers to the lipid kinases,and refers to the phosphatases.Fig.1 Metabolism and transformation process of PI4P
2.2 单项研究情况
2.2.1 PI4K
PI4K可促进PtdIns肌醇环D-4羟基磷酸化,是生成PI4P的主要激酶,抑制其活性能下调PI4P表达,即使后续通路中PI3K及PI4P5K代偿性增加,由于前体物质PI4P的缺少,PI(3,4)P2和PI(4,5)P2仍会减少。不同物种的PI4K存在一定差异,如酵母和果蝇可编码Lsb6,Pik1,Stt43种不同的PI4K;哺乳动物细胞中有4种不同的PI4K亚型,分别为PI4KⅡα(PI4K2A,Lsb6),PI4KⅡβ(PI4K2B),PI4KⅢα(PI4KA,Stt4),PI4KⅢβ(PIK1,PI4KB)。细胞不同部位的PI4P由不同的PI4K催化生成,如:1)高尔基体上的PI4P主要由PI4KⅢβ催化产生,PI4KⅡα和PI4KⅡβ也有催化作用[2,7];2)在内质网、溶酶体运输中起调节作用的是PI4KⅡα与其同系物PI4KⅡβ[8];3)PI4KⅢα负责质膜上PI4P的合成[9]。PI4K除与乳腺癌[10]、肺腺癌[7]、前列腺癌[11]等肿瘤细胞迁移和增殖有关外,还是治疗病毒感染及疟疾的重要 新 靶 点。其 中,PI4K的 抑 制 剂UCT943(1)[12]、MMV390048(2)又名MMV048[13]作为抗疟药均已进入临床研究阶段,已发现PI4KⅢβ和PI4KⅢα的相关抑制剂T-00127-HEV1(3)、PIK93(4)等有抗病毒作用[14],表明均具备新型抗病毒复制药物的潜力。化学结构式见图2。
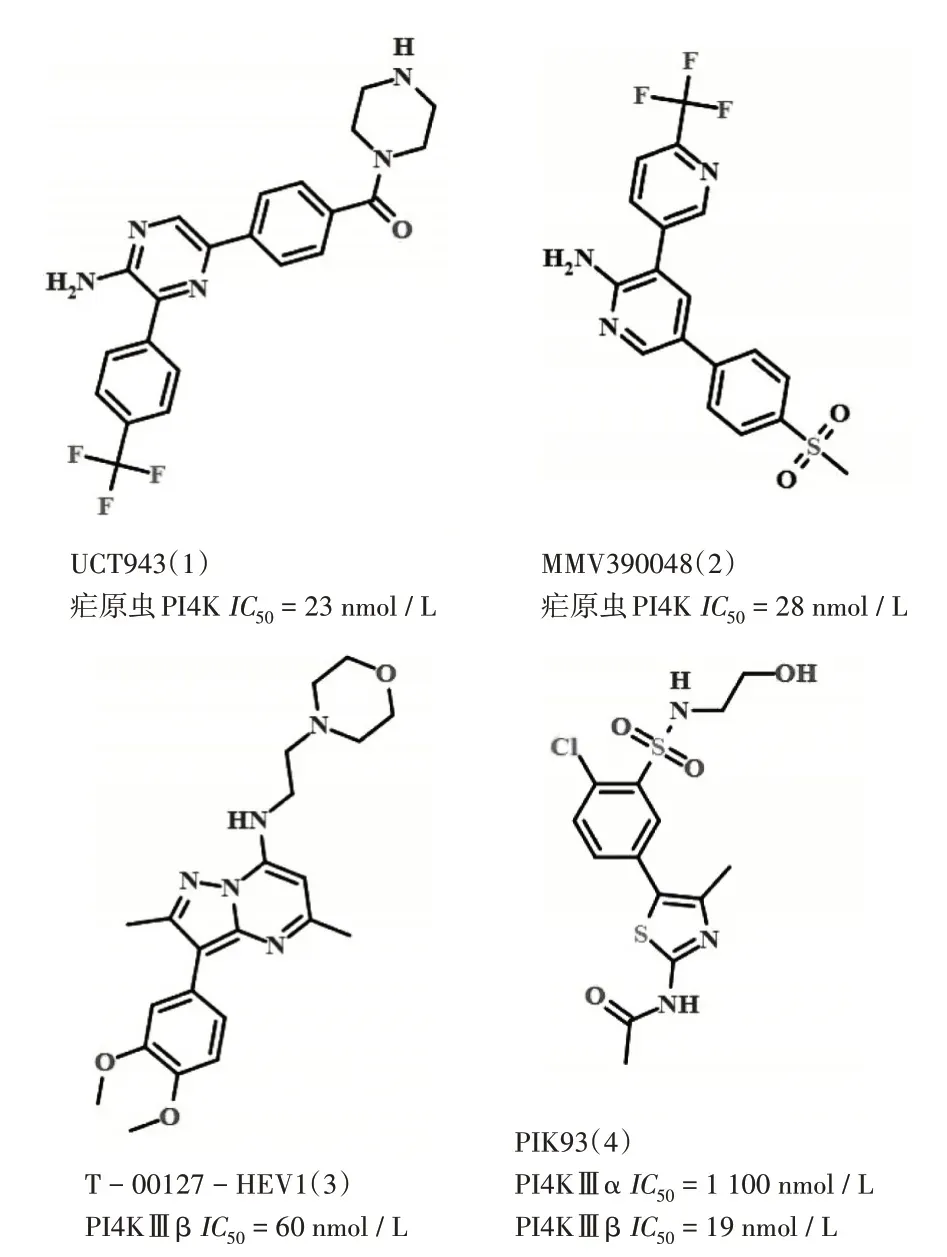
图2 PI4K抑制剂化学结构式Fig.2 Chemical structures of PI4K inhibitors
2.2.2 SAC1
SAC1包含1个由500个氨基酸组成的保守结构域,称为SAC结构域,体外具有磷酸酶活性[15],与PI4K相互拮抗,可使PI4P肌醇环D-4位去磷酸化为PtdIns,从而减少PI4P的生成。SAC1可顺式作用于PI4P,后者通过氧固醇结合蛋白1从反式高尔基体转移至内质网,与胆固醇反向交换,调控特定位置的PI4P库[16];SAC1能反式作用于PI4P,主要通过四磷酸适配器蛋白1介导,但作用强度远小于顺式[17]。SAC1失活会导致内质网及高尔基体膜上的PI4P浓度显著提升。目前,4种PI4K亚型生成的PI4P是否均受SAC1调控尚存争议。SHCORR等[18]的研究发现,酵母中SAC1充当PI4KⅢβ的拮抗剂。TAHIROVIC等[19]的研究发现,SAC1的失效会导致PI4KⅢα特异生成的PI4P增加。在SAC1突变的果蝇中,敲低PI4KⅢα可抑制PI4P的增加,而敲低PI4KⅢβ则不能[20]。在哺乳动物中,SAC1作用于何种PI4K产生的PI4P库目前尚无定论。在酵母中,SAC1基因的表达与肌醇水平无关,但对PI4P水平高度敏感。细胞内PI4P的增加会上调SAC1启动子的活性[21],有利于确保PI4P的稳定性,但目前尚不清楚上述反馈的控制机制。
SAC1在内质网和高尔基体间的穿梭能有效响应外界条件,控制膜特异性PI4P的富集,从而帮助细胞更好地适应外界环境的变化。营养缺乏或饥饿状态下,SAC1通过外被体蛋白(COP)Ⅱ囊泡募集到高尔基体,使高尔基体上PI4P减少,从而阻止其分泌、运输,延缓细胞生长[22]。营养充足时,SAC1依赖COPⅠ囊泡从高尔基体转运到内质网,高尔基体上PI4P富集,增加分泌运输,使细胞快速生长[23]。
SAC1在早期非转移性乳腺癌中表达增加,在晚期转移性乳腺癌中表达降低[24]。敲低SACI导致参与聚糖加工的甘露糖苷酶Ⅱ和N-乙酰氨基葡萄糖转移酶-Ⅰ分布到异常的细胞内结构[25],提示SAC1的丧失可能与肿瘤进展有关。此外,人体细胞中SAC1功能丧失会诱导染色体不稳定和非整倍性[26]。
2.2.3 PI4P5K
PI4P5K可磷酸化PI4P,使其转化为PI(4,5)P2,且PI4P5K作为T淋巴细胞受体激活的分子传感器,能控制突触中肌动蛋白的募集,确保T淋巴细胞受体信号传导和细胞毒性T淋巴细胞分泌,构成机体抗病毒、抗肿瘤免疫的重要防线[27]。人体中PI4P5K有α,β,γ 3个亚型,分别由PIP5K1A,PIP5K1B,PIP5K1C编码。在癌症中,肿瘤抑制因子p53及人类RAS小GTP酶家族中的KRAS,NRAS,HRAS常发生突变,PIP5K1A可增加突变p53的稳定性,进而增强其致癌活性[28],还能介导致癌性KRAS信号传导和肿瘤细胞增殖[29]。另外,PIP5K1A作用于PI3K/AKT/PTEN途径可调节细胞的增殖、凋亡、迁移等功能,其与雄激素受体相互作用与前列腺癌的发生相关[30]。由此推测,PIP5K1A可作为抗肿瘤治疗靶点。氧化应激时腺苷酸活化蛋白激酶和蛋白激酶C协同作用可诱导PIP5K1B磷酸化而降低其活性,促使细胞凋亡[31]。PIP5K1B基因突变被发现可能与霍奇金淋巴瘤多药耐药性有关[32]。PIP5K1C参与囊泡运输、钙信号传导、细胞黏附等多种生物学过程,与小泛素样修饰剂结合可驱动角质细胞迁移和生长,对于伤口修复具有重要意义[33]。此外,PIP5K1C在大肠癌高表达,通过激活AKT-STAT3信号通路,从而促进肿瘤相关巨噬细胞浸润[34]。
抑制PI4P5K活性会减少PI4P向PI(4,5)P2的转化及后续PI(3,4,5)P3的生成。目前,PIP5K1A抑制剂仅有ISA-2011B(5),是一种二酮哌嗪稠合的C-1吲哚-3-基取代的1,2,3,4-四氢异喹啉衍生物。研究发现,其在转移性乳腺癌[35]及转移性前列腺癌[36]的靶向治疗中具有重要作用。STRÄTKER等[37]通过体外筛选程序发现,具有2-氨基-3-氰基-4氢-吡喃苯醌骨架的化合物能有效抑制PIP5K1A。目前,尚无PIP5K1B的有效抑制剂。WRIGHT等[38]通过高通量筛选发现了几种有效的PIP5K1C抑制剂,其中最有效的是UNC3230(6),但其溶解度有限,需要进一步优化结构。PI4P5K抑制剂的研究还有很大空间。PI4P5K抑制剂的化学结构式见图3。
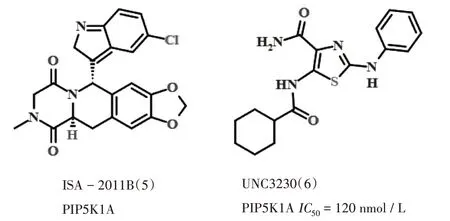
图3 PI4P5K抑制剂化学结构式Fig.3 Chemical structures of PI4P5K inhibitors
2.2.4 PI5-phosphatases
PI5-phosphatases与PI4P5K相互拮抗调控PI4P的表达水平,抑制PI5-phosphatases可减少由PI(4,5)P2去磷酸化产生的PI4P。PI5-phosphatases主要分为4类,Ⅰ型有INPP5A,Ⅱ型 有SYNJ1,SYNJ2,OCRL,INPP5B,INPP5J,SKIP 6种,Ⅲ型 有SHIP1和SHIP2,Ⅳ型 有INPP5E,其中仅Ⅰ型不具有脂质磷酸酶活性。OCRL,INPP5B,SYNJ1/2,SKIP,INPP5J,INPP5E去磷酸化PI(4,5)P2生成PI4P,可调控细胞的迁移、黏附、侵袭等功能[39]。PI5-phosphatases与多种人类遗传疾病密切相关,其中SHIP2与视神经发育不良有关[40];OCRL突变与Lowe综合征有关。FESTA等[41]研究发现,导致疾病的机制是突变的OCRL破坏了溶酶体途径的磷酸肌醇稳态,导致位于肾近端小管内的细胞功能异常。OSBORN等[42]研究发现,SKIP突变会导致先天性肌营养不良综合征。SOMASUNDARAM等[43]统计发现,部分克罗恩病患者中SHIP1蛋白水平显著降低,表明SHIP1与克罗恩病有关。此外,SHIP2,INPP5J等还在鳞状细胞癌、胃癌、黑素瘤中作为肿瘤抑制因子[44]。
PI5-phosphatases中,SHIP1和SHIP2抑制剂研究较多,目前未发现针对PI5-phosphatases其他亚型的有效抑制剂。SHIP1抑制剂3α-Aminocholestane(7)能诱导酪氨酸激酶激活,从而克服人急性淋巴细胞白血病耐药性的问题[45]。SHIP2抑制剂SHIP2-IN-1(8)可降低β-淀粉样蛋白诱导的tau蛋白过度磷酸化而改善阿尔茨海默病模型小鼠的记忆障碍。除神经系统疾病方面的作用外,SHIP2抑制剂AS 1949490(9)被发现可增加胰岛素诱导的Akt磷酸化,增强葡萄糖代谢。ICHIHARA等[46]在AS 1949490(9)结构基础上设计出一种新型的有效SHIP2抑制剂CPDA(10),发现其在增强胰岛素诱导的Akt磷酸化方面表现出较AS1949490(9)更高的效价,可有效改善3T3-L1脂肪细胞中的胰岛素抵抗。但其药代动力学参数不理想,生物利用度差,多种SHIP2抑制剂未被选用。研究发现,二甲双胍可直接结合并降低SHIP2磷酸酶活性而增强葡萄糖的摄取,并起到肾脏保护作用[47]。上述PI5-phosphatases的化学结构式见图4。研究表明,现有临床药物进行研究或许能发现有效的PI5-phosphatases抑制剂。

图4 PI5-phosphatases抑制剂化学结构式Fig.4 Chemical structures of PI5-phosphatases inhibitors
2.2.5 PI3K
PI3K是关键的脂质激酶,可磷酸化肌醇环的3-OH,是控制细胞增殖、运动、代谢信号通路的重要物质。哺乳动物有8种PI3K同工酶(4个Ⅰ类同工型,3个Ⅱ类同工型和1个Ⅲ类同工型)[48]。其中,Ⅰ类主要将PI(4,5)P2转化为PI(3,4,5)P3,有PI3Kα,PI3Kβ,PI3Kδ,PI3Kγ 4个亚型;Ⅱ类生成PI3P及将PI4P转化为PI(3,4)P2,有PI3K-C2α,PI3K-C2β,PI3K-C2γ 3个亚型;Ⅲ类产生PI3P,只有PIK3C3(Vps34)1个亚型。抑制Ⅱ类PI3K可减少PI4P向PI(3,4))P2的转化,使PI4P表达增加。
在实体瘤中,编码PI3K的基因常发生突变,PI3K及其同工酶很可能成为相关肿瘤的有效治疗靶标。乳腺癌及其他肿瘤中,PIK3CA常发生双突变,双突变肿瘤对PI3Kα抑制剂作用更敏感[49]。此外,抑制PI3Kδ可在减少血液系统肿瘤细胞增殖的同时保持正常免疫细胞的生物功能[50]。PI3Kγ抑制后可降低肿瘤微环境巨噬细胞的炎性反应,延缓肿瘤进展[51]。除了抗肿瘤作用,PI3K抑制剂对生长障碍、免疫缺陷也有治疗作用。PI3Kα特异性抑制剂对PIK3CA突变导致的过度生长综合征有显著疗效[52]。编码PI3Kδ的PIK3CD基因突变是原发性免疫缺陷的病因,选择性PI3Kδ抑制剂CDZ173(11)可能成为治疗该病的有效药物[53]。肌管性肌病是一种严重的小儿磷酸肌醇(PIP)代谢性神经肌肉疾病,目前尚无治疗方法。在小鼠模型中发现,PI3K-C2β抑制剂可改善小鼠的运动功能,并延长其寿命[54]。
Wortmannin(12),LY294002(13),LY3023414(14),PI-103(15)等均为广谱PI3K抑制剂。在肿瘤方面有4种临床批准的PI3K抑制剂,分别为PI3Kα特异性抑制剂BYL719(16)[55]、PI3Kα和PI3Kδ双重抑制剂BAY 80-6946(17)[56]、PI3Kδ抑制剂Idelallsib(18)[57]、PI3Kδ和PI3Kγ双重抑制剂IPI-145(19)[58],均对PIK3CA突变乳腺癌、白血病、惰性非霍奇金淋巴瘤、难治性顽固性淋巴瘤显示良好的治疗作用。研究发现,胰岛素信号传导增加可降低PI3Kα抑制剂的功效,改善胰岛素反馈有望提高PI3K抑制剂作为肿瘤治疗药物的功效[59]。可见,对PI3K抑制剂的进一步研究有望给某些难治性疾病带来新的治疗方案。PI3K抑制剂的化学结构式见图5。

图5 PI3K抑制剂化学结构式Fig.5 Chemical structures of PI3K inhibitors
2.2.6 PTEN
PTEN是一种3-磷酸酶,具有脂质和蛋白双重磷酸酶活性,与PI3K磷酸化PI4P生成PI(3,4)P2相反,PTEN可使PI(3,4)P2去磷酸化生成PI4P,广泛分布于细胞质、细胞核、线粒体、内质网中,参与细胞生长、蛋白质合成及DNA修复。研究发现,PTEN不仅在胞内定位,也存在于细胞外基质中,其胞外分泌是对肿瘤细胞异常增殖的一种应答[60]。PTEN是编码PI3K基因突变癌症常见的抑癌基因。在前列腺癌模型小鼠中,PTEN的缺失导致PI(3,4)P2的高表达,并使其在增生上皮细胞中累积,揭示PTEN充当了肿瘤抑制因子的另一种作用机制[61]。
3 展望
PI4P在治疗相关疾病的研究中已取得一定进展,但其代谢酶调控疾病的具体分子机制仍不明确,这方面的深入研究对于药物研发及疾病治疗有显著意义。相关研究发现,癌症的恶化往往伴随PI3K,PI4K,PI4K5P等激酶的高表达,或SAC1,PI5-phosphatases,PTEN等磷酸酶的缺失,是否意味着降低激酶活性和增加磷酸酶活性可有效控制癌症进展。PI4P作为磷酸肌醇代谢网络的中间产物,以其为相关疾病的治疗靶点或许效果更好,但当调节PI4P的某个代谢酶被抑制后,其他5个代谢酶如何进行代偿调控,相应通路是否均会发生改变,相关研究甚少,有待进一步探究。虽已有4种PI3K抑制剂作为抗肿瘤药物被批准上市,但单用的抗肿瘤效果并未到达预期,亟须探究适宜的提高疗效、降低副作用的联合用药方案。另外,PI4K代谢酶相关抑制剂对疟原虫、病毒的特异性是其发展为临床药物的关键。其他代谢酶抑制剂对于相关疾病的治疗作用仍处于初级研究阶段,有待更多的基础实验、临床实验对其安全性及有效性进行研究。
