LncRNA NR2F2-AS1靶向抑制miR-129-5p调控子宫内膜癌细胞增殖和凋亡研究〔1〕
2022-10-11华金仁程慧明严菁曾丹潘玫
华金仁,程慧明,严菁,曾丹,潘玫
(江西省妇幼保健院,江西 南昌 330006)
子宫内膜癌是常见的妇科恶性肿瘤之一。目前的治疗手段主要有手术、化疗、放疗及靶向治疗等。约有70%的子宫内膜癌诊断时,肿瘤局限于子宫体,属于临床早期,预后较好。然而晚期子宫内膜癌患者复发率高(66.7%)、预后差、生存期短,5年生存率仅为16.0%。现阶段,围绕子宫内膜癌发病分子机制展开深层次研究,从中找出个性化精准治疗靶点,已成为子宫内膜癌基础性、全面性研究的重心所在[1]。报道[2]指出,长链非编码RNA(LncRNA)可能参与信号通路调控机制,与microRNA(miRNA)相互作用,从而对子宫内膜癌的生长与发展造成影响。另有研究[3]强调,核受体亚家族2组F成员2反义RNA1(NR2F2-AS1)在非小细胞肺癌、结肠癌、直肠癌及前列腺癌组织中表达上调,且与癌细胞的凋亡和增殖相关,但其在子宫内膜癌中的作用尚未明了。本文经Lnc Base预测得知,微小RNA-129-5(miR-129-5p)可能是NR2F2-AS1的靶基因。在子宫内膜癌细胞中,miR-129-5p的表达下调。针对过表达miR-129-5p来分析,其不仅能够有效抑制子宫内膜癌细胞的增殖,而且能抑制其迁移与侵袭,另外还可以对细胞凋亡实施相应诱导。本研究围绕子宫内膜癌细胞(Ishikawa),就miR-129-5p和LncRNA NR2F2-AS1对子宫内膜癌细胞增殖及凋亡的影响进行探讨。报告如下。
1 材料与方法
1.1 材料
选取2020年4月—2020年12月收治的经病理学检查确诊的子宫内膜癌患者50 例,术前均没有进行放疗和化疗,年龄(43.25±5.49) 岁,子宫内膜癌分期:Ⅳ期12 例、Ⅲ期15 例、Ⅱ期10 例、Ⅰ期13 例。
美国Gibco公司生产的高糖杜尔贝科改良鹰培养基(DMEM)和胎牛血清(FBS);美国ATCC公司生产的人子宫内膜癌细胞株(Ishikawa);美国Sigma-Aldrich公司生产的二甲基亚砜(DMSO)、噻唑蓝(MTT)、胰蛋白酶;赛默飞世尔科技公司生产的反转录试剂盒(RT-PCR);宝生物工程(大连)有限公司生产的实时荧光定量聚合酶链式反应(Real-time PCR)试剂盒、Lipofectamine 2000转染试剂盒、Trizol试剂;美国BD公司生产的流式细胞仪和流式试剂;上海吉玛制药技术有限公司生产的双荧光素酶报告载体(NR2F2-AS1野生型和突变型)、真核表达载体(pcDNA,阴性对照)、miRNA阴性对照(miR-NC)、miR-129-5p抑制剂、miR-129-5p模拟物(miR-129-5p)、NR2F2-AS1过表达载体(pc DNA-NR2F2-AS1)、NR2F2-AS1干扰剂(si-NR2F2-AS1);美国Santa Cruze公司生产的甘油醛-磷酸脱氢酶(GAPDH)抗体、B淋巴细胞瘤-2基因(Bcl-2)抗体、转染p21基因(p21)、细胞周期蛋白D1(CyclinD1);美国Promega公司生产的兔抗人单克隆(Bax)抗体和双荧光素酶报告系统;美国Bio-Rad公司生产的全自动酶标仪和Real-time PCR仪。
1.2 方法
1.2.1 细胞培养
采用高糖DMEM培养液(内含1%青-链霉素、10% FBS)进行培养,然后把培养瓶置入到二氧化碳(CO2)(5%)培养箱(温度设为37 ℃)中,湿度控制在95%。当细胞生长至对数期时,进行洗涤消化,并按照1∶3传代。
1.2.2 细胞转染
收集子宫内膜癌组织样本转染后的Ishikawa细胞,依据特定比例,接种在6孔板中(每孔2×105个)。需要指出的是,在细胞培养过程中,当融合成一层时,便可进行转染操作。采用当前比较常用的Lipofectamine 2000,把pc DNA-NR2F2-AS1,miR-129-5p和真核表达质粒(pc DNA)等转染到Ishikawa细胞中,培养时间控制在4 h,然后向完全培养基进行转染,转染48 h后,收集细胞。
1.2.3 Real-time PCR检测RNA表达
收集子宫内膜癌组织样本转染后的Ishikawa细胞,对组织样本和细胞总RNA进行提取,反转录合成cDNA,然后将cDNA当作模板,实施Real-time PCR反应,合成miR-129-5p和LncRNA NR2F2-AS1。反应程序:72 ℃ 40 s,59 ℃ 40 s,94 ℃40 s,95 ℃ 5 min,35个循环;72 ℃ 10 min。
1.2.4 经四唑盐比色法准确测定细胞活性
收集已经完成转染的Ishikawa细胞,同样依据特定比例(每孔2×103个),围绕96微孔板,实施逐一接种操作,完成后,均置入事先准备好的培养箱中,继续培养。在培养过程中,分别在24 h,48 h,72 h进行MTT实验。各孔均置入20 μL MTT(5 mg/mL),培养4h,弃上清,加入DMSO,每孔150μL,振荡10 min,用酶标仪对吸光度(OD)(490 nm)进行测定。
1.2.5 测定细胞凋亡率
Ishikawa细胞均培养至对数期,实施转染,然后接种于6孔板,培养48 h;收集细胞进行洗涤,次数不易过多,两次为宜。根据凋亡试剂盒说明书展开各项操作,用流式细胞仪获取凋亡率。
1.2.6 用双荧光素酶报告系统进行相关实验
参照上述手段,以Ishikawa细胞为研究对象,进行培养、转染等操作。选取两种双荧光素酶报告载体[一种为野生型LncRNA NR2F2-AS1(WT-NR2F2-AS1),另一种为突变型LncRNA NR2F2-AS1(MUT-NR2F2-AS1)],联合miR-129-5p,以Ishikawa细胞为对象,进行共转染处理,48 h后对细胞实施各项操作(如收集、裂解等)。最后进行离心操作,收集上清液,检测其荧光素酶活性。
1.3 统计学方法
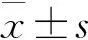
2 结 果
2.1 子宫内膜癌组织中miR-129-5p和LncRNA NR2F2-AS1的表达
子宫内膜癌组织中LncRNA NR2F2-AS1含量明显高于正常子宫内膜组织(P<0.05),miR-129-5p含量显著低于正常子宫内膜组织,差异均有统计学意义(P<0.05)(见表1)。
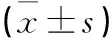
表1 子宫内膜癌组织当中miR-129-5p和LncRNA NR2F2-AS1的表达
2.2 干扰LncRNA NR2F2-AS1表达对Ishikawa增殖的抑制情况si-NR2F2-AS1组LncNR2F2-AS1表达量
低于si-NC组(P<0.05)(si-NR2F2-AS1表示加入NR2F2-AS1干扰剂;si-NC表示阴性对照),OD490在各时间段(24 h,48 h,72 h)及CyclinD1表达量都低于si-NC组(P<0.05),p21表达量显著高于si-NC组(P<0.05)(见图1与表2),提示干扰LncNR2F2-AS1表达能够抑制Ishika增殖。

图1 增殖相关蛋白表达
2.3 干扰LncRNA NR2F2-AS1表达对Ishikawa凋亡的影响
si-NR2F2-AS1组Ishikawa凋亡率和Bax含量高于si-NC组(P<0.05),Bcl-2含量低于si-NC组(P<0.05)(见图2和表3),表明干扰LncRNA NR2F2-AS1表达可诱导Ishikawa凋亡。
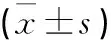
表2 干扰LncRNA NR2F2-AS1表达对Ishikawa增殖的影响

(a)为凋亡相关蛋白表达;(b)为细胞凋亡流式图
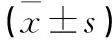
表3 干扰LncRNA NR2F2-AS1表达 对Ishikawa凋亡的影响
2.4 miR-129-5p过表达可抑制Ishikawa增殖和诱导其凋亡
miR-129-5p组在48 h和72 h时OD490明显低于miR-NC组(P<0.05)(miR-129-5p表示miR-129-5p模拟物,miR-NC表示阴性对照),细胞凋亡率高于miR-NC组(P<0.05),CyclinD1和Bcl-2含量低于miR-NC组(P<0.05),p21和Bax含量高于miR-NC组(P<0.05)(见图3和表4),提示过表达miR-129-5p能够抑制Ishikawa细胞增殖,加速细胞凋亡。
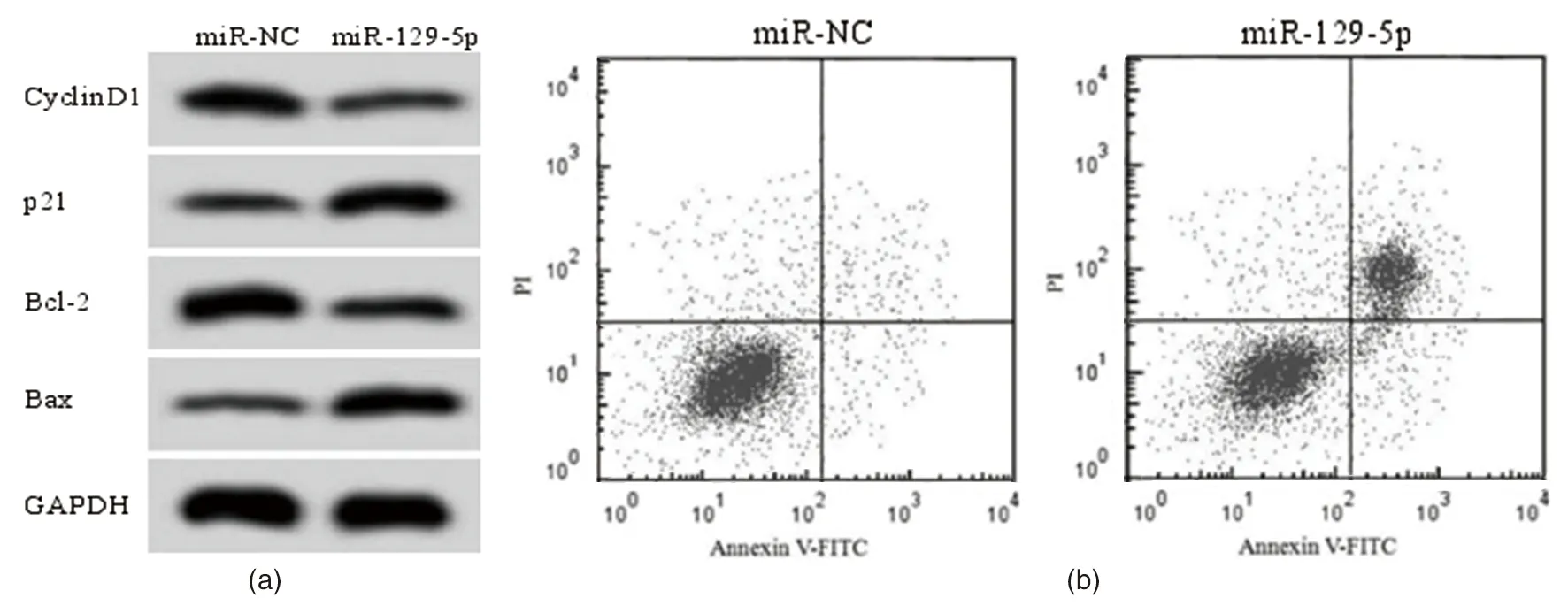
(a)为增殖和凋亡相关蛋白表达,(b)为细胞凋亡流式图
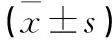
表4 过表达miR-129-5p对Ishikawa细胞增殖与凋亡的影响
2.5 LncRNA NR2F2-AS1靶向调控miR-129-5p表达
LncBase预测结果显示,LncRNA NR2F2-AS1序列中含有与miR-129-5p互补的序列(见图4)。双荧光素酶报告实验结果显示,过表达miR-129-5p组野生型WT-NR2F2-AS1的萤火虫荧光素酶相对活性显著下降(P<0.05),而突变型MUT-NR2F2-AS1的萤火虫荧光素酶相对活性无明显变化(见表5)。提示LncRNA NR2F2-AS1在细胞中与miR-129-5p之间可能存在相关性。

(a)为增殖和凋亡相关蛋白表达,(b)为细胞凋亡流式图
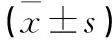
表5 双荧光素酶报告实验结果
2.6 LncRNA NR2F2-AS1与miR-129-5p的调控关系
qRT-PCR结果发现,pcDNA的miR-129-5p为(1.00±0.08),pcDNA-NR2F2-AS1的miR-129-5p为(0.51±0.04),si-NC的miR-129-5p为(0.99±0.07),si-NR2F2-AS1的miR-129-5p为(2.47±0.23)。pcDNA-NR2F2-AS1的miR-129-5p水平低于pcDNA(t=3.741,P<0.05),si-NR2F2-AS1的miR-129-5p水平高于si-NC(t=4.162,P<0.05),提示过表达NR2F2-AS1可显著下调miR-129-5p含量;干扰NR2F2-AS1表达显著上调miR-129-5p表达量。
3 讨 论
LncRNA不仅在子宫内膜癌发病机制中发挥重要作用,而且在子宫内膜癌细胞的代谢、侵袭及转移过程中扮演非常重要的角色[4]。对于LncRNA NR2F2-AS1来说,当前已证实,其在许多类型的肿瘤组织中均存在不同程度的表达异常[5]。针对此情况,适当下调其表达,可以达到有效抑制癌细胞增殖的目的,另外还可促进细胞的快速凋亡[6-7]。既往研究[6]还发现,miR-129-5p在乳腺癌、胃癌、前列腺癌中均存在明显的低表达;miR-129-5p过表达不仅可以抑制肿瘤增殖,加速细胞凋亡,而且对肿瘤的迁移、侵袭同样有着良好的抑制作用。本研究发现,与正常子宫内膜组织相比,子宫内膜癌组织中的LncRNA NR2F2-AS1呈现高表达,miR-129-5p呈现低表达,表明LncRNA NR2F2-AS1与miR-129-5p在子宫内膜癌中发挥着重要作用。干扰LncRNA NR2F2-AS1表达后,LncRNA NR2F2-AS1在Ishikawa细胞中的含量明显下降,各时间段OD490及Cyclin D1的表达量都有降低,p21表达则与之相反,呈现明显升高趋势,提示干扰NR2F2-AS1表达可抑制Ishikawa细胞的增殖。还需指出的是,在过表达miR-129-5p后,Ishikawa细胞中的miR-129-5p含量有明显增加;48 h和72 h OD490明显下降,miR-129-5p细胞凋亡率高于miR-NC,CyclinD1和Bcl-2含量降低,p21和Bax含量升高,提示过表达miR-129-5p能够抑制Ishikawa细胞增殖,加速细胞凋亡。从LncBase预测得知,在LncRNA NR2F2-AS1序列中,含有互补于miR-129-5p的核苷酸序列,提示miR-129-5p与NR2F2-AS1之间可能存在调控关系,或者是结合位点,这为LncRNA NR2F2-AS1靶向调控miR-129-5p的表达提供理论基础。提示LncRNA NR2F2-AS1与miR-129-5p之间可能存在相关性。从qRT-PCR结果得知,pcDNA-NR2F2-AS1的miR-129-5p水平低于pcDNA,si-NR2F2-AS1的miR-129-5p水平高于si-NC,提示过表达NR2F2-AS1可显著下调miR-129-5p含量;干扰NR2F2-AS1表达显著上调miR-129-5p表达量,表明miR-129-5p与NR2F2-AS1之间可能存在调控关系,这为LncRNA NR2F2-AS1靶向调控miR-129-5p的表达提供理论基础。
综上所述,干扰LncRNA NR2F2-AS1可以靶向促进miR-129-5p的表达,从而抑制子宫内膜癌细胞增殖,诱导细胞凋亡,可望为子宫内膜癌的治疗提供新的靶点。但是本研究样本量较少,在之后的研究中,我们会扩充样本量,进行进一步研究。
