Circ-WHSC1通过靶向miR-95-3p上调真核起始因子3B的表达促进非小细胞肺癌细胞增殖的机制研究〔1〕
2022-10-11曾省都钟斌唐晓媛
曾省都,钟斌,唐晓媛
(赣南医学院第一附属医院,江西 赣州 341000)
肺癌是全球患病人数最多的恶性肿瘤,世界卫生组织将肺癌分为两大组织学亚型[非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)],其中NSCLC占肺癌总病例数的85%[1]。NSCLC的亚型又被分为腺癌(占所有肺癌的38.5%)、鳞状细胞癌(20%)和大细胞癌(3%)[2]。近几十年来,随着NSCLC早期诊断和治疗技术的不断进步,NSCLC的病死率有所下降[3]。然而,大部分NSCLC患者初次确诊时已进入中晚期,导致患者失去手术根治机会,预后较差,5 年生存率只有10%~15%[4]。因此,寻找有效的NSCLC早期诊断生物标志物和治疗靶点具有重要意义。
非编码RNA是一类不能编码任何蛋白质的RNA,微小RNA和长链RNA 是目前研究最多的非编码RNA[5]。环状RNA(circRNA)是新发现的广泛表达于不同细胞中的非编码RNA。研究表明[6],circRNA的异常表达有助于各种癌症的发生发展,如肺癌、肝细胞癌和结直肠癌。肺癌中circRNA的发现和对其具体分子机制的深入研究可能会提高肺癌的治疗水平。公共基因芯片数据库(GEO)显示Circ-WHSC1在NSCLC 组织中异常高表达[7],然而Circ-WHSC1在NSCLC中的影响作用及其潜在机制尚不清楚。
微小RNA在包括NSCLC在内的各种癌症的发生和进展中发挥重要作用[8]。早期通过生物信息学分析预测Circ-WHSC1与miR-95-3p结合的可能性最大,并且miR-95-3p与真核起始因子3B(EIF3B)存在靶向结合位点。研究发现[9],EIF3B在NSCLC细胞中高度表达且与疾病发展和预后相关。本研究旨在探究Circ-WHSC1通过靶向miR-95-3p上调EIF3B的表达促进NSCLC细胞增殖的机制。
1 材料与方法
1.1 细胞培养与转染
NSCLC细胞系包括NCI-A549,NCI-H460,NCI-H125,NCI-H358,SW1537和正常肺上皮细胞BEAS-2B。BEAS-2B在Lonza BEBM基础培养基中培养。A549和NCI-H460细胞在含10%胎牛血清的杜氏改良伊格尔培养基(DMEM)中培养。其余细胞在含10%胎牛血清的RPMI1640培养基中培养。所有细胞添加100 U/mL青霉素和100 mg/mL链霉素,在37 °C培养箱培养。随机将所有细胞分为空载对照组(转染空质粒载体,即转染si-NC)、敲低组(转染si-Circ-WHSC1)、过表达组(转染Circ-WHSC1过表达质粒)、敲低Circ-WHSC1+上调miR-95-3p组(转染si- Circ-WHSC1、miR-95-3p模拟物各一半)、上调miR-95-3p组(转染miR-95-3p模拟物,miR-95-3p mimics)及其对照组miR-NC、下调miR-95-3p组(转染miR-95-3p抑制剂,miR-95-3p inhibitor) 及其对照组inh-NC。
1.2 主要试剂与材料
NSCLC细胞系A549细胞、NCI-H460细胞、NCI-H125细胞、NCI-H358细胞、SW1537细胞及正常肺上皮细胞BEAS-2B均购于全球生物资源中心 (ATCC);10%胎牛血清购于GE公司;RPMI-1640培养基、胰蛋白酶和脂质体Lipofect-amine2000购于Invitrogen公司(美国);空质粒载体(NC)、Circ-WHSC1过表达质粒、Circ-WHSC1特异性小干扰RNA(si-Circ-WHSC1)及其阴性对照物si-NC,miR-95-3p模拟物及其对照物miR-NC,miR-95-3p抑制剂及其对照物inh-NC均购于RiboBio公司(广州);细胞计数试剂盒-8(CCK8)购于MedChemExpress公司(美国);一抗HMGA2抗体、内参GAPDH抗体及对应二抗、Ago2抗体和IgG抗体购于Abcam公司(上海);双荧光素酶报告基因检测试剂盒购于Promega公司(Madison,WI,USA);EZMagnaRIP试剂盒购于Millipore公司(美国)。
1.3 实时定量聚合酶链反应
通过使用RNA提取试剂盒,从肺癌细胞和正常上皮细胞中分离RNA,根据Total试剂说明书提取总RNA,将分别提取得到的细胞总RNA逆转录成互补DNA(cDNA)。同时扩增各个样本的目的基因和内参基因,每组细胞设计6 个重复孔。采用2-ΔΔCT分析法检测Circ-WHSC1相对表达量。
1.4 CCK8实验检测细胞增殖
通过CCK8检测细胞增殖情况。在每孔中植入了5 000个肺癌细胞,根据试剂盒操作说明进行实验,应用酶标仪检测450 mm处的吸光度,分别测定A549细胞转染及共转染后24 h,48 h,72 h增殖变化。
1.5 Western blot 实验
收集细胞用磷酸盐缓冲液(PBS)清洗,加入150 μL裂解液,采用蛋白定量(BCA)试剂盒测定蛋白质浓度。各组取等量蛋白进行电泳,将凝胶上的蛋白转移至聚偏二氟乙烯(PVDF)膜上,4 ℃封闭1 h,加入一抗(1∶1 000)于4 ℃孵育过夜。随后,加入二抗(1∶2 000)室温杂交1 h,基于Tris的免疫印迹洗涤缓冲液(TBST)洗涤3 次,每次5 min。将电化学发光(ECL)化学发光底物均匀加在PVDF膜上,显色、拍照,用凝胶图像处理系统进行蛋白条带的灰度测定,以甘油醛-3-磷酸脱氧酶(GAPDH)为内参,比较各组蛋白质表达水平。每个实验重复3 次。
1.6 双荧光素酶报告实验
由Promega公司构建荧光素酶报告载体Circ-WHSC1野生型(Circ-WHSC1-WT)、Circ-WHSC突变型(Circ-WHSC1-MUT)、EIF3B野生型 (EIF3B-WT) 和EIF3B突变型 (EIF3B-MUT)。将上述载体分别与miR-95-3p mimics 或 miR-95-3p inhibitors转染A549细胞,培养24 h。随后,检测各组的荧光素酶活性。
1.7 RNA免疫共沉淀实验
EZMagnaRIP试剂盒用于RNA免疫共沉淀实验。首先提取蛋白,将A549细胞置于灭菌的离心管中,加入预冷的RIPA裂解液和蛋白酶抑制剂,于冰上充分研磨后,在冰上静置30 min。于4 ℃下以1 500 r/min离心20 min,小心吸取上清液。随后,准备免疫沉淀磁珠,离心管中加入50 μ LA/G磁珠悬液,再加入500 μL RIPA洗涤液,轻轻搅拌混合均匀,将离心管置于磁力架上,使磁珠聚集到离心管管壁的一侧,去除上清。离心管中加入500 μL RIPA洗涤液,轻轻晃动,洗涤磁珠,去上清。随后,在离心管中加入100 μL RIPA洗涤液,再加入人Ago2抗体,阴性对照组加入IgG抗体,室温孵育30 min。取上清,再次洗涤磁珠,吸出上清。离心管中加入500 μL RIP洗涤液,短暂涡旋后,将离心管转移至冰上,去上清。得到的RNA-目的蛋白复合物进行纯化,随后进行荧光定量聚合酶链反应(RT-qPCR)分析以进一步分析Circ-WHSC1和miR-95-3p的表达。
1.8 统计学方法
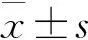
2 结 果
2.1 Circ-WHSC1在NSCLC细胞系中表达
我们设计了发散型和收敛型引物来扩增Circ-WHSC1外显子和线性WHSC1外显子。使用cDNA和基因组DNA进行RT-qPCR。RT-qPCR数据显示,聚合引物可以扩增基因组DNA和cDNA中的线性WHSC1外显子,而发散引物只能扩增cDNA中的Circ-WHSC1外显子(见图1a)。在总RNA和多聚核糖体(PolyA) RNA中均可扩增出WHSC1的线性mRNA,而在PolyA RNA中Circ-WHSC1水平显著降低。此外,Circ-WHSC1在NSCLC细胞系中的表达高于正常肺上皮BEAS-2B细胞(见图1b)。

(a):采用随机引物或寡核苷酸T对A549细胞进行RT-qPCR实验。(b):检测NSCLC细胞中Circ-WHSC1的表达
2.2 Circ-WHSC1对细胞增殖的影响
我们进一步研究了Circ-WHSC1在非小细胞肺癌中的生物学作用。首先检测了Circ-WHSC1对肺癌细胞生长的影响。在A549细胞中成功转染Circ-WHSC1(见图2a)。Circ-WHSC1的沉默显著抑制了癌细胞的增殖(见图2b)。而过表达Circ-WHSC1则促进了癌细胞的增殖(见图2c)。
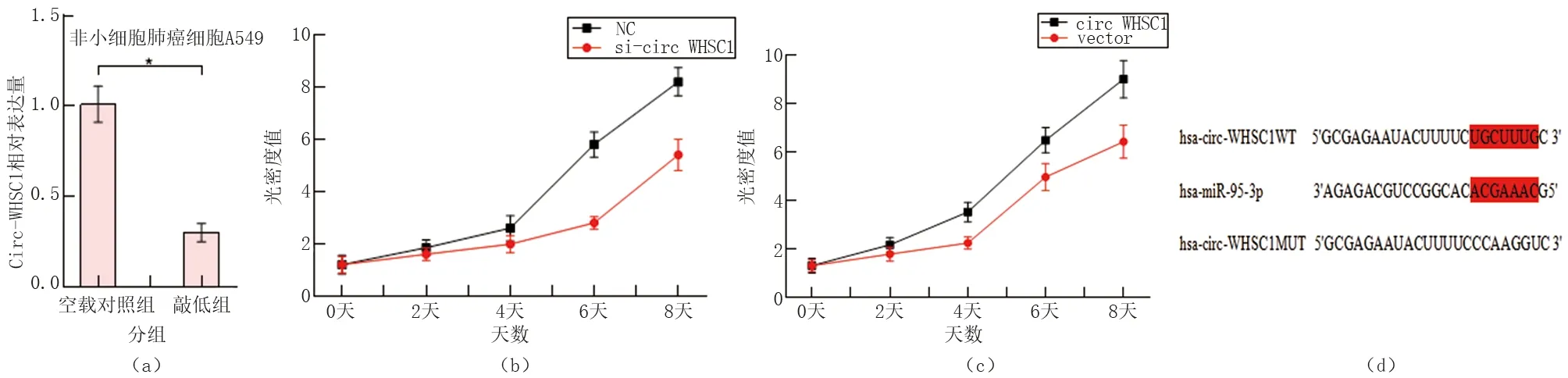
(a):将无义siRNA和Circ-WHSC1 siRNA分别转染A549细胞;(b):si-Circ-WHSC1抑制细胞增殖;(c):过表达Circ-WHSC1促进细胞增殖;(d):生物信息学分析预测miR-95-3p与Circ-WHSC1之间可能存在的结合位点
2.3 Circ-WHSC1与miR-95-3p的靶向关系
为了进一步探究Circ-WHSC1的下游机制,我们通过生物信息学网站预测发现miR-95-3p与Circ-WHSC1之间可能存在结合位点(见图2d)。随后,我们采用双荧光素酶报告实验验证二者的结合关系,结果显示上调miR-95-3p显著抑制Circ-WHSC1-WT的荧光素酶活性,下调miR-95-3p显著促进Circ-WHSC1-WT的荧光素酶活性;而上调或下调miR-95-3p对Circ-WHSC1-MUT的荧光素酶活性无显著影响(见图3a)。随后,采用免疫共沉淀实验进一步验证二者的结合关系,结果显示miR-95-3p与Circ-WHSC1在Ago2组中高度富集,这表明二者可直接结合(见图3b)。
2.4 Circ-WHSC1通过吸附miR-95-3p对NSCLC细胞的增殖作用
为了进一步验证Circ-WHSC1是否通过吸附miR-95-3p对 NSCLC 细胞增殖和凋亡发挥调节作用,我们将si-Circ-WHSC1和 miR-95-3pmimics单独或共转染A549细胞。CCK8实验和流式细胞术结果显示,与si-NC组相比,敲低Circ-WHSC1抑制A549细胞增殖,上调miR-95-3p促进增殖,共转染si-Circ-WHSC1+miR-95-3p mimics可逆转敲低Circ-WHSC1对细胞增殖的抑制作用(见表1)。

表1 转染后细胞OD值
2.5 Circ-WHSC1通过吸附miR-95-3p上调EIF3B的表达
随后,我们试图进一步探究miR-95-3p的下游机制,通过数据库,我们发现EIF3B是miR-95-3p的潜在靶基因之一,双荧光素酶报告基因实验结果显示,上调miR-95-3p可显著抑制EIF3B-WT的荧光素酶活性,下调miR-95-3p可显著促进EIF3B-WT的荧光素酶活性;而miR-95-3p对 EIF3B-MUT 的荧光素酶活性无影响(见图4a)。Western blot 结果显示,相比于对照组,敲低Circ-WHSC1可显著抑制EIF3B的表达,而上调miR-95-3p可逆转敲低Circ-WHSC1对EIF3B表达的抑制作用 (见图4b、图5)。

(a):miR-95-3p与EIF3B的双荧光素酶实验;(b):WB法检测Circ-WHSC1通过吸附miR-95-3p上调EIF3B对A549细胞EIF3B蛋白表达的影响
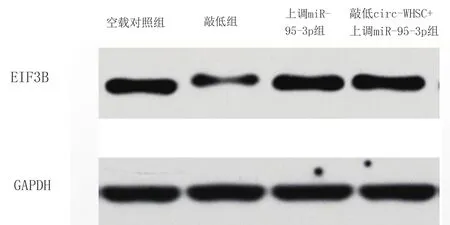
WB法检测Circ-WHSC1通过吸附miR-95-3p上调EIF3B对A549细胞EIF3B蛋白表达条带图
3 讨 论
肺癌已经成为全球健康的沉重负担。近几十年来,非小细胞肺癌的诊断和治疗发展缓慢,晚期患者的5 年生存率在20%以下,局部晚期或转移性疾病的患者大多失去了手术机会[10]。临床上对非小细胞肺癌研究不断深入,研究者在分子生物学领域寻找非小细胞肺癌细胞潜在的靶点与标志物,用于治疗非小细胞肺癌患者,提高患者生存率。研究非小细胞肺癌的早期诊断和致癌因素有助于寻找新的靶向治疗方法。CircRNA是新发现的RNA形式,在哺乳动物细胞中广泛表达,稳定性和基因保守性是CircRNA的两个最重要的特征[11]。所有这些特征表明,与其他非编码RNA(如微小RNA和长链RNA)相比,CircRNA作为癌症生物标志物更有前景[12]。近年来,CircRNA在癌症中的作用越来越受到研究人员的关注,研究CircRNA的功能将为癌症的治疗提供更多的新思路。通过改变CircRNA在肿瘤中的表达水平,可以间接调节肿瘤的良性或恶性发展,如在肝癌细胞中,过表达Circ-100395可抑制细胞增殖、诱导细胞凋亡、降低细胞的迁移和侵袭能力[13]。本文主要报告了Circ-WHSC1通过靶向miR-95-3p上调EIF3B的表达促进NSCLC细胞增殖。
非小细胞肺癌的进展是一个涉及多种因素的复杂过程。已有研究报道了CircRNA在非小细胞肺癌组织中的表达谱,然而,CircRNA的具体功能至今仍不清楚。因此,对非小细胞肺癌中CircRNA的研究对非小细胞肺癌的治疗具有重要意义。Circ-WHSC1是由WHSC1基因产生的。据报道[14],WHSC1在癌症中起致癌作用。然而,Circ-WHSC1直到近几年才被发现,Circ-WHSC1在癌症中的作用至今研究较少。CircRNA最重要的功能是通过海绵吸附微小RNA来调节基因的表达。本文通过生物信息学分析预测Circ-WHSC1与miR-95-3p结合位点,通过双萤光素酶实验报告以及免疫共沉淀实验验证了Circ-WHSC1与miR-95-3p的靶向调控关系。已有报道miR-95-3p可调控多种癌基因,上调miR-95-3p可促进肿瘤进展机制。此外,miR-95-3p的上调激活了mTOR通路,促进了细胞增殖。研究报道[15],miR-95-3p可以靶向肿瘤相关通路中的许多致癌基因(如EGFR,PIK3CD等),表明在癌症中具有显著的促进作用。微小RNA是长度为19~25 个核苷酸的内源性短链非编码RNA,在调控基因表达中起关键作用。微小RNA可参与调控与癌症发展过程相关的多种信号通路,包括 DNA损伤修复通路、凋亡信号通路和成纤维细胞生长因子受体信号通路等[16]。我们进行RT-qPCR、荧光素酶报告实验证实Circ-WHSC1是miR-95-3p的海绵。通过生物信息学分析,我们注意到了EIF3B。EIF3B是EIFs家族中常见的成员之一,已发现在许多癌症中过表达,包括食管鳞状细胞癌、透明细胞肾癌和前列腺癌。此外,在肾透明细胞癌患者中,EIF3B高表达与侵袭性肿瘤表型相关,在膀胱癌和前列腺癌患者中,EIF3B的表达与肿瘤分级呈正相关[17]。表明EIF3B的过度表达与多种癌症的发展有关。本研究发现,miR-95-3p靶基因上调EIF3B促进NSCLC细胞增殖,推测可能原因是EIF3B通过调节多种基因表达或通路激活,包括下调整合素α5的表达、抑制肿瘤坏死因子的表达或激活β-catenin信号通路,促进细胞增殖、细胞迁移或抑制细胞凋亡,导致非小细胞肺癌细胞扩散。
本研究进行了诸多实验,证明Circ-WHSC1是非小细胞肺癌进展过程中的致癌因子,Circ-WHSC1通过上调miR-95-3p的水平和增加EIF3B的表达来促进肺癌的发展。Circ-WHSC1通过靶向miR-95-3p上调EIF3B的表达可能成为NSCLC的治疗靶点。既往也有研究发现,EIF3B与NSCLC细胞周期、上皮间质转化、自噬和耐药等密切相关,但本研究未对此进行分析,需要未来深入探讨。
