番茄酵素自然发酵过程中主要功效酶的变化
2022-10-11秦宇蒙王艳丽周笑犁董平坤吴栋斐
秦宇蒙,王艳丽,周笑犁, ,董平坤,吴栋斐
(1.贵阳学院食品与制药工程学院,贵州贵阳 550005;2.贵州省普通高等学校功能食品重点实验室,贵州贵阳 550005)
微生物酵素是指含有丰富的维生素、矿物质、酶和次生代谢产物等营养成分的功能性微生物发酵产品,一般以一种或多种新鲜水果、蔬菜、菌菇、中草药等为原料,经多种有益菌发酵而得,具有抗菌、抗氧化、提高免疫力、保护心血管以及抑制肥胖等作用。由于发酵是一个复杂的微生物代谢过程,通过其自身的物质代谢,使发酵原料在分子水平上发生分解和结构改变,产生了复杂的中间代谢或交叉代谢产物,实现物质之间的代谢转化,从而产生新的生物活性成分,并代谢产生多种生物酶等。目前对于酵素的研究大多关于其发酵工艺的优化,生物活性的探究,发酵过程中微生物群落的动态变化以及代谢物质的研究。如,以酵母菌和植物乳杆菌等菌株发酵枣汁或荔枝等果蔬汁,均发现发酵能影响其功效酶活性及其生物活性物质;在苹果酒发酵过程中,-葡萄糖苷酶、果胶酶和蛋白酶活性与其中酯类物质、醇类物质、酸类物质以及醛酮类物质的含量具有很强的相关性,说明果蔬经过微生物代谢酶催化碳水化合物等前体物质的水解可以影响发酵产品的风味类型与强度。但对于果蔬自然发酵过程的代谢规律研究还较少,目前主要对苹果、枇杷等果蔬自然发酵开展了生物活性物质变化规律等研究,而对于果蔬自然发酵过程中功效酶变化规律的全面评价还鲜有报道。
本团队前期对番茄酵素在自然发酵过程中的微生物区系和理化特性进行了探究,发现不同阶段发酵液中均涵盖了细菌和真菌两大类,且以细菌占绝对优势,而细菌中优势菌主要包括乳杆菌属、明串珠菌属和魏斯氏属等;且随着发酵时间的延长,活性物质和抗氧化能力发生了显著性变化。但是这些变化规律是否与发酵体系中的代谢酶的活性强弱具有一定的关联性,因此,番茄酵素自然发酵过程中功效酶的动态变化亟待进一步探究。本研究以番茄自然发酵液为研究对象,分析其在发酵过程中淀粉酶、纤维素酶、果胶酶、脂肪酶、蛋白酶、超氧化物歧化酶的活力及其变化规律,以期为阐明番茄酵素功能活性机理和综合开发利用提供相关理论依据。
1 材料与方法
1.1 材料与仪器
新鲜小番茄、白砂糖 购自沃尔玛超市;三羟甲基氨基甲烷、三氯乙酸、TritonX-100、亚硫酸钠、羟甲基纤维素钠、果胶、没食子酸 分析纯,天津鼎盛鑫华化工有限公司;冰醋酸、三水合乙酸钠、结晶酚、醋酸钠、半乳糖醛酸 分析纯,上海麦坤化工有限公司;碳酸钠、乙二胺四乙酸二钠、磷酸氢二钠、磷酸二氢钠 分析纯,天津市科密欧化学试剂有限公司;盐酸、无水乙醇、氢氧化钠、硼酸钠、3,5-二硝基水杨酸 分析纯,国药集团化学试剂有限公司;对硝基苯酚、对硝基苯酚棕榈酸酯、氯化钠、酒石酸钾钠分析纯,天津市北辰方正试剂厂。
FA124 型电子天平 上海舜宇恒平科学仪器有限公司;PHS-3C pH 计 上海仪电科学仪器有限公司;UV-2550 型紫外可见光度计 济南海能仪器股份有限公司;TCL-16A 型冷冻离心机 长沙平凡仪器仪表有限公司;AA605112 型恒温水浴锅 上海梅香仪器有限公司。
1.2 实验方法
1.2.1 番茄发酵液的制备与取样 将处理好的新鲜番茄与白砂糖按质量比3:1 的比例放入灭菌发酵罐中,于室温下避光固态发酵90 d,发酵前期每天上下翻转摇晃玻璃瓶使白砂糖均匀融化,定期排气防止胀罐,然后取0、10、20、30、60、90 d 的发酵液用于酶活力的测定。
1.2.2 酶提取液的制备 称取适量样品,研磨成匀浆后用磷酸盐缓冲液稀释,然后于4000 r/min 离心15 min,收集上清液,即为酶提取液。
1.2.3 淀粉酶活性的测定 参考陈爽等的方法。标准曲线的制作:分别吸取0、0.2、0.6、1.0、1,4、1.8、2.0 mL 的1 mg/mL 麦芽糖标准液于试管中,加入蒸馏水使溶液体积至2 mL,最后向每支试管加入2 mL 3,5-二硝基水杨酸试剂。置于沸水浴中煮沸5 min,冷却后加蒸馏水至20 mL,在波长540 nm 处测吸光度值。以麦芽糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
淀粉酶活力的测定:试管A(对照):1 mL 淀粉酶提取液(沸水浴,5 min)+1 mL 1%淀粉溶液(50 ℃,5 min)+2 mL DNS 试剂(沸水浴,5 min)+蒸馏水至20 mL;试管B(样品):1 mL 淀粉酶提取液+1 mL 1%淀粉溶液(50 ℃,5 min)+2 mL DNS 试剂(沸水浴,5 min)+蒸馏水至20 mL。每个样品做三个平行,均于540 nm 处测吸光度值。
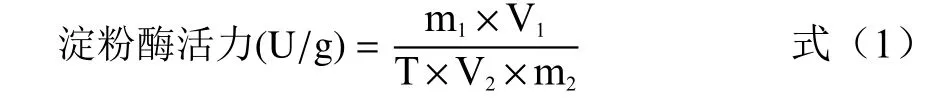
式中,m为反应体系中麦芽糖含量,mg;V为淀粉酶提取液总体积,mL;T 为酶促反应时间,min;V为酶促反应时消耗的淀粉酶提取液体积,mL;m为样品质量,g。
1.2.4 纤维素酶活性的测定 参照QB 2583-2003纤维素酶制剂羧甲基纤维素-还原糖酶活力(CMCADNS)测定法。标准曲线的制作:分别吸取0、0.2、0.4、0.6、0.8、1.0、1.2 mL 的1 mg/mL 葡萄糖标准液于试管中,加入蒸馏水使溶液体积至2 mL,最后向每支试管加入1.5 mL 3,5-二硝基水杨酸试剂。将试管置于沸水浴中煮沸5 min,冷却后加蒸馏水至25 mL,在波长540 nm 处测吸光度值。以葡萄糖含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
纤维素酶活性的测定:试管A(对照):0.5 mL 纤维素酶提取液(沸水浴,5 min)+1.5 mL 10 mg/mL CMC-Na(50 ℃水浴保温30 min)+1.5 mL DNS 试剂(沸水浴,5 min)+蒸馏水至25 mL;试管B:0.5 mL纤维素酶提取液+1.5 mL 10 mg/mL CMC-Na(50 ℃水浴保温30 min)+1.5 mL DNS 试剂(沸水浴,5 min)+蒸馏水至25 mL。每个样品做三个平行,均于540 nm处测吸光度值。
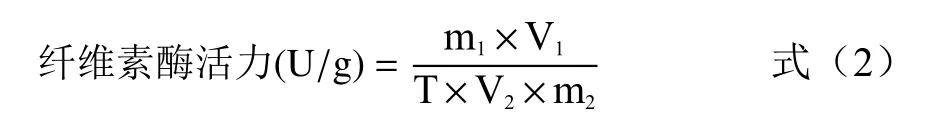
式中,m为反应体系中葡萄糖含量,mg;V为纤维素酶提取液总体积,mL;T 为酶促反应时间,min;V为酶促反应时消耗的纤维素酶提取液体积,mL;m为样品质量,g。
1.2.5 果胶酶活性的测定 参考Oliveira 等所报道的方法。标准曲线的制作:分别吸取0、0.2、0.6、1.0、1.4、1.8、2 mL 的1 μg/mL 半乳糖醛酸标准溶液于试管中,加入pH 为5.0 醋酸盐缓冲液,使溶液体积至4 mL,最后向每支试管加入2 mL DNS 试剂。将试管置于沸水浴中煮沸5 min,冷却后加磷酸盐缓冲液至20 mL,在波长540 nm 处测吸光度值。以半乳糖醛酸质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
果胶酶活力的测定:取酶提取液0.2 mL,加0.5% pH 4.0 果胶溶液3.8 mL,37℃恒温反应30 min后加入2.5 mL DNS 试剂,沸水浴5 min,冷水浴至室温后用缓冲液定容至25 mL。取10 mL 定容待测样液于离心管中,10000 r/min 离心5 min,离心完后立即转入预冻处理过的EP 管内,放入盛放生物冰袋采样箱内于波长540 nm 测吸光值,每个样品做三个平行。

式中,m为反应体系中半乳糖醛酸含量,μg;V为果胶酶提取液总体积,mL;T 为酶促反应时间,min;V为酶促反应时消耗的果胶酶提取液体积mL;m为样品质量,g。
1.2.6 脂肪酶活性的测定 对硝基苯酚标准曲线的绘制:将对硝基苯酚标准溶液用无水乙醇溶液稀释成适当的梯度,加入5 mL 0.5 mol/L 的三氯乙酸混合,再加入15 mL 0.5 mol/L NaOH 调pH,直至pH 与加酸前一致,分别测定吸光度。
脂肪酶活力的测定:取4 mL p-NPP 底物溶液,37 ℃预热5 min 后加入1 mL 脂肪酶提取液,反应10 min 后立即加入5 mL 0.5 mol/L 的三氯乙酸混合均匀,放置5 min 终止反应,再加入15 mL 0.5 mol/L NaOH 调pH,直至pH 与反应前一致,用1 mL 蒸馏水替换作为对照,于410 nm 测定吸光度。

式中,C 由标曲查得的对硝基苯酚浓度,μmol/L;V为酸碱度调节后的反应液总体积mL;V为样品处理液总体积,mL;T 为酶促反应时间,min;V为酶促反应时消耗的脂肪酶提取液体积,mL;m 为样品质量,g。
1.2.7 蛋白酶活性的测定 参照GB/T 23527-2009《蛋白酶制剂》中的福林法进行测定。标准曲线的制作:分别配制0、10、20、30、40、50 μg/mL L-酪氨酸标准溶液,分别吸取上述溶液1 mL,加入5 mL 碳酸钠和1 mL 福林酚试剂,振荡均匀,置于37 ℃水浴中显色20 min,以蒸馏水代替酪氨酸作为空白对照,用分光光度计在波长680 nm 下测定其吸光度。以酪氨酸的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
蛋白酶活性的测定:取1 mL 蛋白酶提取液,加入酪蛋白溶液1 mL 摇匀,在37 ℃恒温水浴锅中反应10 min 后,加入2 mL 三氯乙酸,摇匀静止10 min后过滤,取1mL 滤液加碳酸钠溶液5 mL 和1 mL 福林酚试剂,在37 ℃水浴中显色20 min,用1 mL 蒸馏水替换酶提取液作为空白对照,在波长680 nm 处测定吸光度。
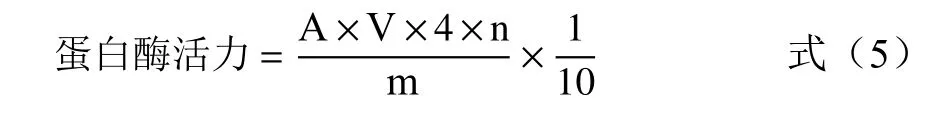
1.2.8 超氧化物歧化酶活性的测定 在碱性条件下,邻苯三酚会发生自氧化,可根据SOD 抑制邻苯三酚自氧化能力测定SOD 酶活力,具体测量方法参照GB/T 5009.171-2003《保健食品中超氧化物歧化酶(SOD)活性》。
邻苯三酚自氧化速率的测定:在试管中加入2.35 mL Tris-HCl 缓冲液、0.1 mL 蒸馏水和0.7 mL 邻苯三酚溶液,然后涡旋处理3 s,立即将混合液在325 nm 波长条件下读取30 s 吸光值。
样品抑制邻苯三酚自氧化速率测定:冰浴保存的样品放入25 ℃水浴锅中水浴3 min 后避光保存。以邻苯三酚自氧化速率实验为参比,于25 ℃环境中,向离心管中加入2.35 mL Tris-HCl 缓冲液,0.1 mL 酶提取液,0.7 mL 邻苯三酚溶液,涡旋处理3 s。立即将混合液在325 nm 波长条件下读取吸光值。
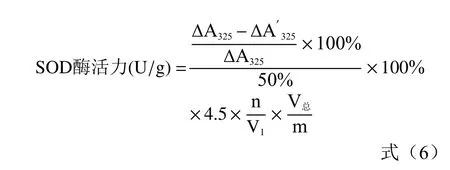
式中:△A为邻苯三酚自氧化速率;△A′为SOD 酶液抑制邻苯三酚自氧化速率;4.5 为反应液总体积mL;V为所加样液体积,mL;V为样液总体积,mL;n 为样液的稀释倍数;m 为样品质量,g。
1.3 统计分析
每组试验重复3 次,结果以平均值±标准差(X±SD)表示,试验数据采用单因素方差分析(ANOVA)和SPSS 25.0 软件进行单次实验统计检验数据性状分析,采用Duncan 多重极差法进行统计检验,确定各试验数据性状的显著性(<0.05),采用Excel 2016 软件进行作图。
2 结果与分析
2.1 番茄酵素自然发酵过程中淀粉酶活力的变化
由图1 可知,番茄酵素在发酵0~30 d 时其淀粉酶活力变化较小,随后其活力显著上升(<0.05),在发酵第90 d 时酶活达到了79.289 U/g。有研究发现,发酵液中过高的可溶性固形物含量具有较高的渗透压,对微生物活力具有一定的抑制作用,从而影响代谢酶的积累。本团队前期研究发现,番茄酵素发酵过程中可溶性固形物含量随着发酵时间的延长逐渐降低,这可能有助于淀粉酶的产生。并且番茄酵素在发酵后期,酵母菌逐步成为了真菌中的优势菌,它在分解多糖时需要在细胞水平将碳水化合物分解为双糖,才能被转移到细胞内部,并在细胞内部进一步降解为单糖,在这一过程中酵母菌是通过在环境中分泌生物胞外酶来实现代谢的。因此,在番茄发酵后期淀粉酶活力骤然升高。

图1 淀粉酶活力变化Fig.1 Change of amylase activity
2.2 番茄酵素自然发酵过程中纤维素酶活力的变化
由图2 可知,在番茄酵素自然发酵的过程中,纤维素酶活力逐渐上升(<0.05),并于发酵第90 d 达到38.180 U/g。其变化趋势与淀粉酶的变化趋势相近,可能是由于在发酵中后期,发酵体系中的碳源不足以维持菌种的生命活动,促使产酶微生物代谢产生了糖类水解酶,使得纤维素酶得以快速累积。并且前期研究也发现在发酵过程中能产生纤维素酶的曲霉属相对丰度也有所增加,这与纤维素酶活力的递增形成相互佐证。
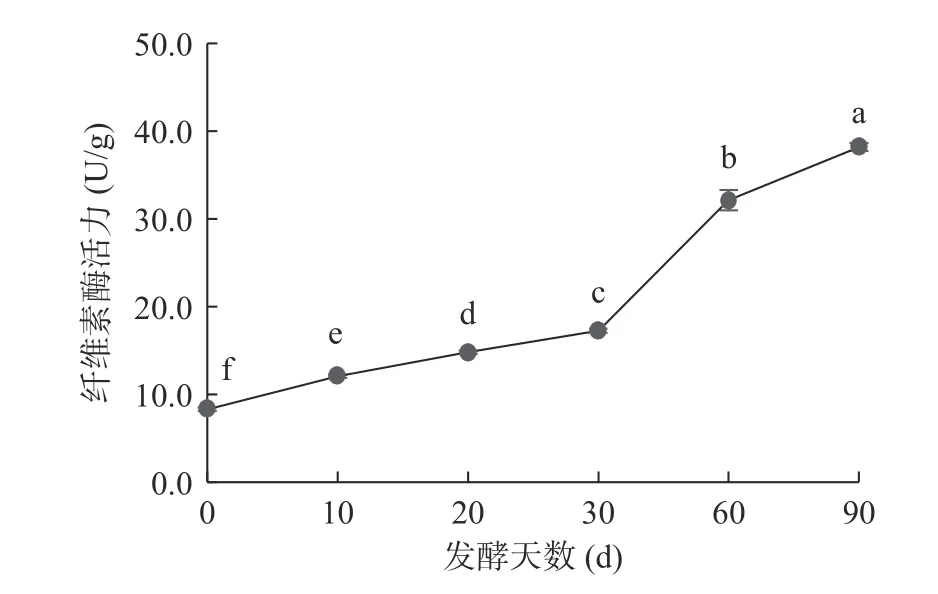
图2 纤维素酶活力变化Fig.2 Change of cellulase activity
2.3 番茄酵素自然发酵过程中果胶酶活力的变化
果胶酶作为一类分解果胶质的酶,它可以协同纤维素酶破坏植物的细胞壁,促进有效成分的溶出。由图3 可知,果胶酶活力在番茄酵素自然发酵的不同阶段存在显著性差异(<0.05),随着发酵时间的延长,酶活呈先上升后下降的趋势,且均高于发酵前(<0.05),并于20 d 达到了最大值(3.733 U/g)。本团队在前期研究发现,能够产生果胶酶的青霉属与假单胞菌属为发酵前的优势菌属,其在适宜的环境大量产生果胶酶,使得果胶酶在发酵前期具有较高的酶活力。而随着发酵进行,发酵环境发生改变,微生物之间存在竞争关系,使其产果胶酶相关微生物的数量减少,且在发酵过程中,随着体系pH 逐渐降低,通过引起细胞膜电荷的变化,从而影响着微生物对营养物质的吸收,使得代谢过程中酶活发生了改变,因此在发酵30 d 后体系中果胶酶活力出现了降低的现象。微生物在生长发育过程中会不断向外分泌胞外酶,用以分解外界复杂的有机物,从而获取有机营养物质。其中较重要的是与多糖降解相关的酶,如淀粉酶、纤维素酶和果胶酶等。本研究发现,淀粉酶、纤维素酶和果胶酶活力都较发酵前高,因此酵素体系中的微生物可以很好的将大分子糖类进行水解,而某些微生物可以利用低分子糖类生成醇和酸,从而使得体系的酒精度和pH 发生变化。
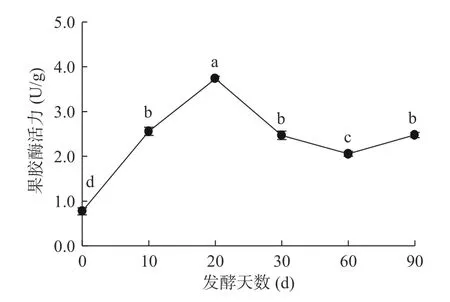
图3 果胶酶酶活力变化Fig.3 Change of pectinase activity
2.4 番茄酵素自然发酵过程中脂肪酶活力的变化
番茄自然发酵过程中脂肪酶活性变化如图4 所示。番茄酵素自然发酵过程中脂肪酶活力最大值为0.856 U/g,活力较其他酶活低,该结果与苹果酵素、水果酵素等一致。这可能因为这些酵素的发酵原料为脂肪含量较少的果蔬,以至于微生物代谢产生的脂肪酶较少。番茄酵素发酵过程中脂肪酶活力在0~60 d 呈现较平稳的上升趋势,并在第60 d 取得最大值,其原因可能是发酵过程中番茄酵素的发酵体系适宜产脂肪酶微生物进行生长代谢,使得发酵后的脂肪酶活力提高。然而随着发酵进行到90 d 时,其活性显著下降(<0.05)。本团队前期研究发现番茄酵素在发酵过程中乳酸菌逐渐成为优势菌种,使得体系pH 下降至3.3,整体呈酸性,而脂肪酶的最适pH 在中性或碱性范围内。因此,在发酵后期,其活性显著降低。

图4 脂肪酶活力变化Fig.4 Change of lipase activity
2.5 番茄酵素自然发酵过程中蛋白酶活力的变化
蛋白酶是一类具有复杂结构并能够催化蛋白质水解生成多肽及小分子氨基酸的酶,来源广泛,在动植物细胞及微生物的新陈代谢和调控过程中发挥重要作用。由图5 可知,番茄酵素自然发酵过程中蛋白酶活力变化规律较为复杂,在发酵0~60 d 时呈波动变化,在发酵90 d 时其活力骤然上升至45.6 U/g(<0.05)。有研究发现,苹果酵素自然发酵过程中蛋白酶活力随着发酵时间的延长呈逐渐升高趋势,并于发酵60 d 后趋于稳定,香蕉酵素自然发酵过程中蛋白酶活力呈先上升后下降的趋势,由此可知酵素采用不同原料进行发酵时蛋白酶活力的变化规律存在一定差异。番茄酵素在发酵前期呈波动变化,可能原因是0~60 d 酵素中产生蛋白酶的微生物和其他菌种之间存在竞争关系,并且发酵前期菌种不断产酸,pH 的下降对蛋白酶活性存在影响,但在60 d 之后,体系逐渐形成了优势菌种且环境趋于稳定,使得蛋白酶活力迅速增加。

图5 蛋白酶活力变化Fig.5 Change of protease activity
2.6 番茄酵素自然发酵过程中超氧化物歧化酶活力的变化
番茄酵素不同发酵阶段的SOD 酶活力变化规律如图6 所示。SOD 酶活力在0~20 d 时呈现显著上升趋势(<0.05),随后变化缓慢,在发酵60 d 时趋于最大。贾丽丽等发现,SOD 酶活力与生物量变化之间呈现显著正相关。由此推测,随着发酵的进行,微生物增加,有利于SOD 酶的产生。但是在发酵后期,发酵产物和菌种之间存在竞争或者菌种可利用的营养物质变化趋于稳定,使得SOD 酶活力也渐渐趋于稳定。由于SOD 酶具有清除自由基和过氧化氢等抗氧化能力,是细胞防御系统中的主要抗氧化酶。基于本团队前期对番茄酵素抗氧化能力变化的分析,将本实验中测定的SOD 酶活力变化规律与抗氧化指标进行了相关性分析(表1),发现SOD 酶活力与ABTS自由基清除率、DPPH 自由基清除率呈极显著正相关(<0.01)。这表明,发酵体系中具有能够产生SOD 酶的微生物,从而可以增加发酵体系的抗氧化活性,并且SOD 也是番茄酵素抗氧化活性功效酶的来源之一。而SOD 与还原力之间无显著相关性(>0.05),这可能是由于番茄酵素中的SOD 不是主要参与体系的还原能力,并且也说明对番茄自然发酵酵素功效物质与抗氧化能力之间的全面评价需多种测定方法体系和多种活性物质共同进行,这有待于进一步研究。

表1 SOD 酶活力与抗氧化活性指标的相关性分析Table 1 Correlation analysis between SOD enzyme activity and antioxidant activity index

图6 超氧化物歧化酶活力变化Fig.6 Change of superoxide dismutase activity
3 结论
本文通过对番茄酵素自然发酵过程中淀粉酶、纤维素酶、果胶酶、脂肪酶、蛋白酶和超氧化物歧化酶的变化进行了研究。结果表明,随着番茄酵素自然发酵时间的延长,淀粉酶和纤维素酶活力逐渐增加,发酵结束时,其酶活分别为79.289、38.180 U/g;而果胶酶、脂肪酶整体呈先上升后下降的趋势,分别于发酵20、60 d 达最大酶活力;蛋白酶活力则在发酵前期呈波动变化,随后显著上升;表明自然发酵后的番茄酵素,体系中功效酶的活性均有着明显变化。另外,SOD 酶活力呈先迅速上升后趋于平缓,于60 d达到了最大值;并与ABTS自由基清除率、DPPH 自由基清除率呈极显著正相关(<0.01),这为番茄酵素抗氧化能力的主要功效物质探究奠定了基础。综上所述,发酵不仅可以提高酵素的酶活性,还能促进体系中物质转换和活性物质生成,从而提升酵素的品质;研究结果可为番茄酵素的发酵机理以及产品的综合开发利用提供一定的理论指导。
