一株降解牛血液蛋白菌株的分离鉴定及其降解条件优化
2022-10-10马子豪张福梅周丽艳廖庆艳宋汶哲卢丽媛纪晓岚周雪雁
马子豪,向 军,张福梅,周丽艳,廖庆艳,宋汶哲,卢丽媛,纪晓岚,周雪雁,3*
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730124;2.西北民族大学 医学院,甘肃 兰州 730030;3.西北民族大学 生物医学研究中心,甘肃 兰州 730030)
根据国际粮农组织(FAO)统计,在2019、2020、2021年我国受疫情影响下肉类生产总量分别达到了7.759×107、7.748×107、8.887×107t。按家畜血液占其肉重的6%,蛋白质含量占血液的18%计算,可获得的蛋白质分别达8.38×105、8.37×105、9.60×105t。由于原料血液易被污染、极难保存、血腥味浓、消化性和适口性差、色泽感官极差、禁止作为饲料原料等因素严重制约了畜禽血液的综合利用,致使大量宝贵的畜禽血资源浪费,并造成环境污染[1]。屠宰场产生的血污是屠宰场污水最重要的组成部分,在众多污染物中,血液污染的污染指数最大,因此衍生出了多种处理方法[2]。国内外常见的处理方法有化学水解法、焚烧法、微生物水解等方法。焚烧法不仅加剧了环境污染,也造成了营养资源的浪费;化学水解方法受工艺复杂、投资成本高、营养成分易被破坏等诸多因素的限制。而微生物法在微生物的发酵过程中,将可再生碳水化合物转化为各种有用产品,如氨基酸、维生素、抗生素、酶制剂、生物杀虫剂、生物碱、类固醇等物质,适合生产氨基酸肥料[3]。微生物处理后的氨基酸水解液可经过浓缩干燥处理直接制备成固体氨基酸粉末,该粉末可直接以液体形式喷施于作物,也可以营养剂的形式加入肥料中制备成氨基酸生态肥、氨基酸复合肥、氨基酸水溶肥、氨基酸叶面肥等氨基酸肥料[4]。故畜禽血液进行微生物降解能解决血液污染问题,其处理产物又可用于氨基酸肥料的制备,且因其投入低、能耗省、氨基酸含量高而被公认为血液综合利用的一个方向[5]。近年来,研究发现能够降解血液蛋白的菌株主要有黑曲霉、米曲霉、毛霉等真菌以及蜡样芽胞杆菌、枯草芽胞杆菌、苏云金芽胞杆菌等细菌[6-7]。国内外对于乙酰微小杆菌的研究不多,研究方向大致可分为菌株的分离鉴定、降解作用、生物合成物质三个方面的研究。且其降解研究大多与虾壳废物的降解有关[8-9]。本研究于日喀则地区屠宰场血污堆积土壤采集样品,分离筛选并首次研究了一株能高效降解牛血的乙酰微小杆菌(Exiguobacteriumacetylicum),并为探究菌株血液降解效率提供了简单可参考的方法;同时为乙酰微小杆菌功能理论研究以及用微生物法转化血污为有机氨基酸肥料,保护生态环境做出可行性探索。
1 材料与方法
1.1 材料
1.1.1 样品采集 土壤样品采自西藏日喀则市江孜县英雄路6号屠宰场(E89°60′92.18″,N28°91′74.00″),海拔4 000 m左右。
1.1.2 培养基 ①LB(液体)培养基(g/L):胰化蛋白胨10,酵母提取粉5,NaCl 10;②LB固体培养基(g/L):胰化蛋白胨10,酵母提取粉5,NaCl 10,琼脂粉20;③酪蛋白培养基a(g/L):KH2PO40.36,MgSO40.5,ZnCl20.014,NaCl 0.6,Na2HPO4·7H2O 1.07,CaCl20.002,FeSO40.002,酪蛋白4,胰蛋白胨0.05,琼脂15,pH值7.0;④酪蛋白培养基b(g/L):酪素10,牛肉浸粉3,NaCl 5,K2HPO42,琼脂20,pH值7.0;⑤血琼脂平板:哥伦比亚血平板;⑥液体发酵培养基(g/L):牛肉膏0.5,蛋白胨10,葡萄糖15,酵母提取物5,Na2HPO44,NaCl 5,发酵专用豆粕粉2,发酵专用玉米淀粉4;⑦探究菌株生长条件所用培养基;⑧探究菌株血液降解所用培养基。
1.1.3 主要试剂与仪器设备 革兰染色试剂盒(北京陆桥技术股份有限公司),细菌DNA提取试剂盒(TaKaRa-美谷生物科技(浙江有限公司)),细菌生化试剂盒(杭州微生物试剂有限公司),蛋白胨、牛肉膏、琼脂粉、福林酚试剂(博精索拉博科技有限公司),NaCl、CaCl2(天津市大茂化学试剂厂),酵母提取物、胰蛋白胨(北京双旋微生物培养基制品厂),干酪素(上海阿拉丁生化科技股份有限公司),NaOH(国药集团化学试剂有限公司),其他试剂大都购自北京索莱宝生物科技有限公司,罐装牦牛血采集于西藏日喀则市江孜县英雄路6号屠宰场。紫外可见分光光度计(1800PC,北京普析通用仪器有限责任公司);pH计(SG2-FK,梅特勒-托利多);PCR扩增仪(846-X-070-280,德国Biometra);蒸汽灭菌器(MOST-T,山东新华医疗器械股份有限公司);电子天平(AR224CN,奥豪斯仪器常州有限公司);立式恒温振荡器(IS-ROV1,上海智城分析仪器制造有限公司);BME显微镜(13395H2X,莱卡);电泳仪(DYY-6D,北京六一仪器设备);恒温水浴锅(DK-S24,上海精宏实验设备有限公司);隔水式恒温培养箱(GNP-9270,上海精宏实验设备有限公司)。
1.2 方法
1.2.1 菌株纯化及保存 将采集的样品用无菌水10倍递增稀释103~105,移液枪取50 μL稀释液涂布于血琼脂平板,37 ℃培养24 h。挑选有溶血环的菌落划线接种在血平板上,以相同条件培养纯化。纯化好的菌落划线接种于LB培养基,以相同条件培养。取80 μL菌液和80 μL 50%甘油于冻存管混合均匀,在-80 ℃微生物菌种保藏冰箱中长久保存。
1.2.2 形态学鉴定 分离得到的菌株划线接种于LB固体培养基、血平板、酪蛋白培养基a、酪蛋白培养基b,37 ℃培养24 h,观察菌落形状、大小、颜色、边缘、透明等形态特征。将菌落划线接种于LB固体培养基上,分别在37 ℃、12 h和37 ℃、24 h的条件下培养,轻挑少量菌落革兰染色后镜检,光学显微镜下观察菌体细胞的形状、大小及染色结果。
1.2.3 生理生化鉴定 取菌种冻存液200 μL于LB培养基中,180 r/min、37 ℃培养24 h。取培养菌液2 mL于LB培养基中,以相同条件培养。将二代培养菌液50 μL接种于葡萄糖、麦芽糖、肌醇、枸橼酸、尿素、硝酸盐、鸟氨酸、苯丙氨酸等生化试管中按照生化试管所需条件进行培养,观察并判定实验结果。
1.2.4 药敏试验 取二代菌液200 μL于LB固体培养基中均匀涂布,在培养基上放置等间隔的不同抗生素药片,37 ℃培养24 h,记录实验结果。
1.2.5 16S rRNA基因序列鉴定 取二代菌液(第二代培养时间为12 h)2 mL于无菌离心管中,DNA提取试剂盒提取目标菌株DNA。使用引物27F:5′-AGAGTTTGATCMTGGCTCAG-3′,1492R:5′-TACGGYTACCTTGTTACGACTT-3′进行PCR扩增。PCR扩增产物测序由生物工程(上海)股份有限公司完成,测序结果在NCBI的Nucleotide数据库中进行BLAST序列比对,与GenBank中已知的16S rRNA基因序列进行同源性比较,并使用MEGA 7.0构建Neighbor-Joining系统发育树[10]。
1.2.6 菌株生长条件研究 以二代培养液作为后续实验的种子液,实验所用培养基均为100 mL,后续培养基接种2 mL菌液,以180 r/min、37 ℃培养24 h为常规培养条件,每组实验设3个平行并设对照,测定OD值时稀释菌液直至吸光度在0.2~0.8之间。①不同碳源对菌株生长的影响:将六种碳源(葡萄糖、麦芽糖、小麦、蔗糖、玉米淀粉、乳糖)以10 g/L替换LB培养基中的酵母提取物,常规培养条件培养后测定OD600。②不同氮源对菌株生长的影响:将六种氮源(牛肉膏、蛋白胨、酵母提取物、黄豆饼粉、胰蛋白胨、麦麸)以10 g/L替换LB培养基中的胰蛋白胨,常规培养条件培养后测定OD600。③不同无机盐对菌株生长的影响:将七种无机盐(NaCl、ZnCl2、KCl、Na2HPO4、MgSO4、K2HPO4、MgCl2) 以10 g/L替换LB培养基中的NaCl,常规培养条件培养后测定OD600。④pH值对菌株生长的影响:配置不同pH梯度的LB培养基常规培养条件培养后测定OD600。对最适pH、高pH、低pH条件下菌液进行革兰染色并在光学显微镜下观察。⑤不同温度对菌株生长的影响:用含有最适碳源和氮源的LB培养基在不同温度梯度于常规培养条件下培养,测定OD600。对最适温度、高温、低温条件下菌液进行革兰染色并在光学显微镜下观察。
1.2.7 蛋白酶活力的测定 将二代菌液接种于发酵培养基中,27 ℃、180 r/min培养48 h。之后4 ℃、10 000 r/min离心20 min收集上清液,作为蛋白酶测定的粗酶液[6]。采用福林酚法测定蛋白酶活性(GB/T23527-2009)[11]。
1.2.8 菌株血液降解条件的探究 ①最适碳源的筛选:NaCl(5 g/L)为无机盐,10 mL搅拌机低速搅拌1 min的牦牛血为氮源,蔗糖、葡萄糖、麦麸、麦芽糖、可溶性淀粉、乳糖为碳源,加入90 mL纯水制备成100 mL培养基。接种二代菌液200 μL,32 ℃培养75 h后测定总氮和游离氮,计算降解效率。②最适无机盐的筛选:以麦麸为碳源,10 mL搅拌机搅拌后的牦牛血为氮源,NaCl、KCl、MgCl2、Na2HPO4、NH4Cl、K2HPO4为无机盐,分别加入90 mL纯水制备成100 mL培养基,只含牦牛血的培养基作为对照组。接种二代菌液2 mL,37 ℃培养85 h后测定总氮和游离氮,计算降解效率。总氮采用GB5009.5-2016《食品安全国家标准食品中蛋白质的测定》[12]中凯式定氮法测定。氨基酸液态氮采用GB5009.5-2016《食品安全国家标准食品中蛋白质的测定》[12]中甲醛滴定法测定。测底物所含总氮,然后根据公式计算发酵液降解度。
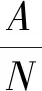
式中,DH为发酵液降解度(%),A为发酵液中氨基酸态氮含量(mg),N为底物中所含总氮含量(mg)。
2 结果与分析
2.1 菌落形态学鉴定
二代菌液接种于不同培养基上培养24 h,肉眼可观察到菌落的不同形态(表1)。

表1 分离菌株在不同培养基上形态特征Table 1 Morphological characteristics of isolated strains on different media
菌株革兰染色后在光学显微镜下观察可见两端圆钝的链杆菌,成对或链状排列,菌体颜色为蓝紫色,革兰染色阳性。培养12 h时,菌体多呈对或断链排列(图1A),培养24 h时,菌体多呈长链状(图1B)。
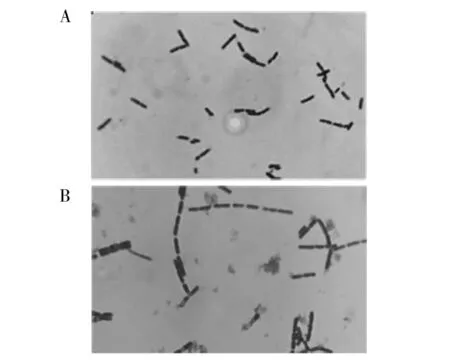
图1 12 h(A)、24 h(B)培养菌革兰染色结果Fig.1 Gram staining results of bacteria cultured for 12 h(A) and 24 h(B)
2.2 生理生化鉴定
对菌株进行糖类发酵、硝酸盐还原、氧化酶、枸橼酸利用试验等生化特性的测定结果见表2。

表2 分离菌株生化反应试验结果Table 2 Biochemical reaction test of the isolate
2.3 药敏试验
实验结果(表3)表明,该分离菌株对磷霉素、头孢西丁、阿米卡星、环丙沙星高度敏感,对头孢他啶、万古霉素敏感性较低,菌株对头孢噻吩、阿莫西林、氨苄西林等抗生素不敏感。
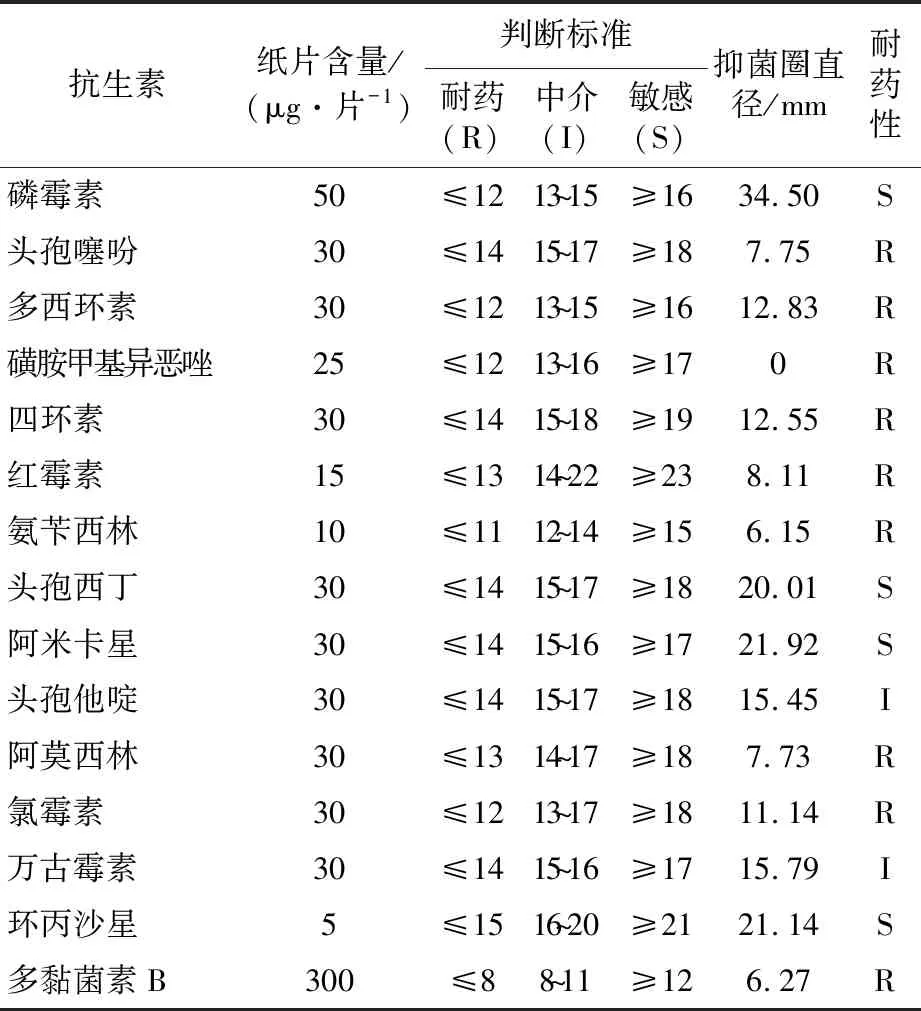
表3 菌株耐药性检验Table 3 Strain resistance test
2.4 16S rRNA基因序列鉴定
采用细菌通用引物对筛选的菌株全基因组DNA序列进行PCR扩增,菌株扩增产物大小约为1 400 bp。将该菌株送样拼接后得到的16S rRNA基因序列在NCBI上使用BLAST软件与GenBank数据库中已知的16S rRNA基因序列进行同源性比较。结果显示,该菌株与乙酰微小杆菌(Exiguobacteriumacetylicum) DSM 20416序列同源性高达99.72%,与Exiguobacteriumacetylicumstrain NBRC 12146序列同源性高达99.58%,与Exiguobacteriumindicumstrain HHS 31序列同源性高达99.51%,使用MEGA7.0将获得的菌株和BLAST结果中15条核酸序列进行多重比对并绘制系统进化树(图2)。该菌株与乙酰微小杆菌(Exiguobacteriumacetylicum)的同源性高达99%以上,遗传距离较近。综合形态学、生理生化、16S rRNA基因序列鉴定结果,鉴定该菌株为微小杆菌属(Exiguobacterium)的乙酰微小杆菌。将测得的16S rRNA基因序列提交NCBI获得GenBank登录号MZ148480,命名为Exiguobacteriumacetylicumstrain NWMCC0047。
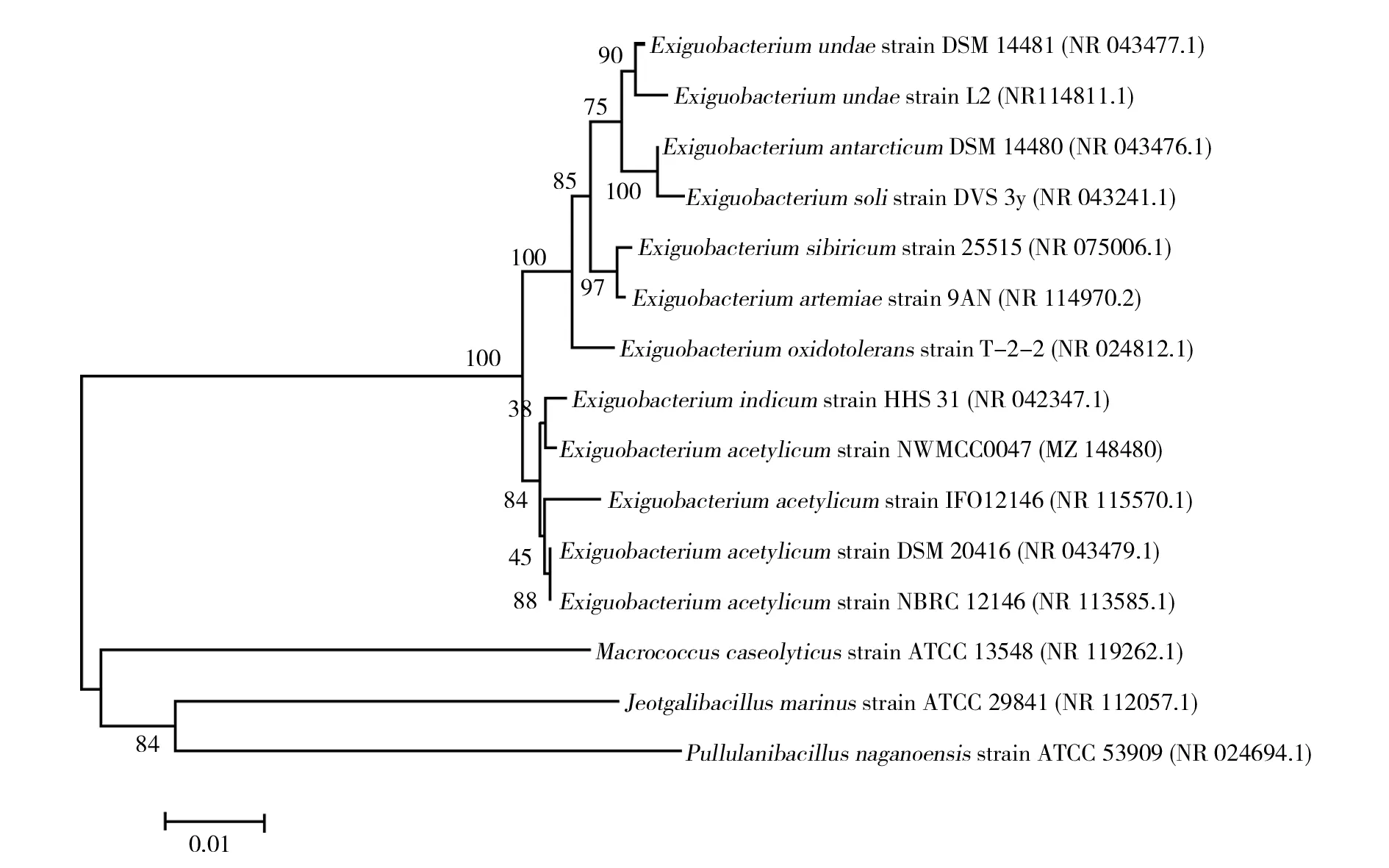
图2 基于 16S rRNA基因序列建立的菌株NWMCC0047系统进化树Fig.2 Phylogenetic tree of NWMCC0047 strain based on 16S rRNA gene sequence
2.5 碳源、氮源、无机盐、pH值、温度对菌株生长的影响
菌株NWMCC0047以葡萄糖作为碳源时OD600值高,而且明显优于其他碳源,表明葡萄糖是该菌株生长的最佳碳源(图3A)。生化反应试验结果显示菌株NWMCC0047乳糖和蔗糖试验呈阴性,麦芽糖和葡萄糖试验呈阳性。各种碳源对菌株生长的影响由大到小依次为葡萄糖、玉米淀粉、蔗糖、乳糖、小麦、麦芽糖(图3A),与生化反应试验结果不一致,原因是由于菌株生长需要多种营养条件所致。菌株NWMCC0047以牛肉膏作为碳源时,OD600值高,明显优于其他氮源,表明牛肉膏是该菌株生长的最佳氮源(图3B)。可能和牛肉膏中含有多肽类、氨基酸类、核苷酸类、有机酸类、矿物质类及维生素类的水溶性物质,为菌体生长提供了丰富的营养物质有关。菌株NWMCC0047以Na2HPO4作为无机盐时,OD600值最高,优于其他无机盐,表明Na2HPO4是该菌株生长的最佳无机盐(图3C)。磷酸盐是许多细菌生长所必须的营养物质,可作为基本营养成分添加到多种培养基中,添加一定量的Na2HPO4对本菌株生长有明显的促进作用。菌株NWMCC0047OD600值在pH值<7.0时呈上升趋势,在pH值>7.0时呈下降趋势。菌株在pH值为7.0时,生长情况好,因此,该菌株生长的最适生长pH值为7.0(图3D)。革兰染色结果表明,细菌在不同pH环境中有形态差异。pH值为5.5时,菌体大部分单个排列,部分菌体染色为淡紫色或粉红色(图4A);pH值为7.0时,菌体形态为两端圆钝的链杆菌,成对或链状排列,菌体形态大致相似,染色为蓝紫色(图4B);pH值为8.5时,菌体单个或成对排列,菌体染色偏深蓝,镜下可见部分半透明的深蓝色物弥散分布,可能为菌体代谢产物(图4C)。
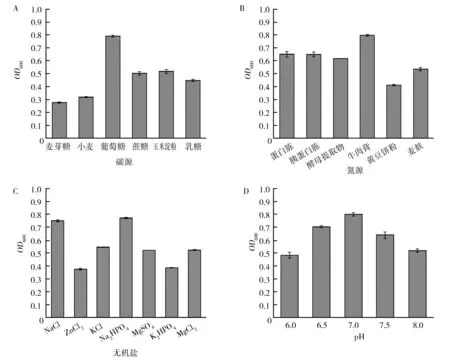
图3 碳源(A)、氮源(B)、无机盐(C)、pH值(D)对菌株NWMCC0047生长的影响Fig.3 Effects of carbon source(A),nitrogen source(B),inorganic salt(C) and pH(D) on the growth of strain NWMCC0047
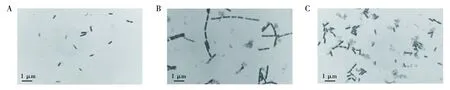
图4 pH值为5.5(A)、7.0(B)、8.5(C)时菌株NWMCC0047革兰染色结果Fig.4 Gram staining results of cultured bacteria at pH 5.5(A),7.0(B) and 8.5(C)
菌株NWMCC0047OD600值在温度低于20 ℃时呈上升趋势,温度高于20 ℃时呈下降趋势,菌株在温度为20 ℃生长情况好,因此20 ℃是该菌株生长的最适生长温度(图5)。革兰染色结果表明,细菌在不同温度环境中有形态上的差异。温度为37 ℃时,菌体为两端圆钝的链杆菌,成对或链状排列,菌体形态大致相似,染色呈蓝紫色(图6A);温度为42 ℃时,菌体单个或成对排列,视野下可见菌体死亡后部分或全部萎缩的粉红色菌体(图6B);温度为27 ℃时,菌体单个或成对排列,长短不一形态不同(图6C)。
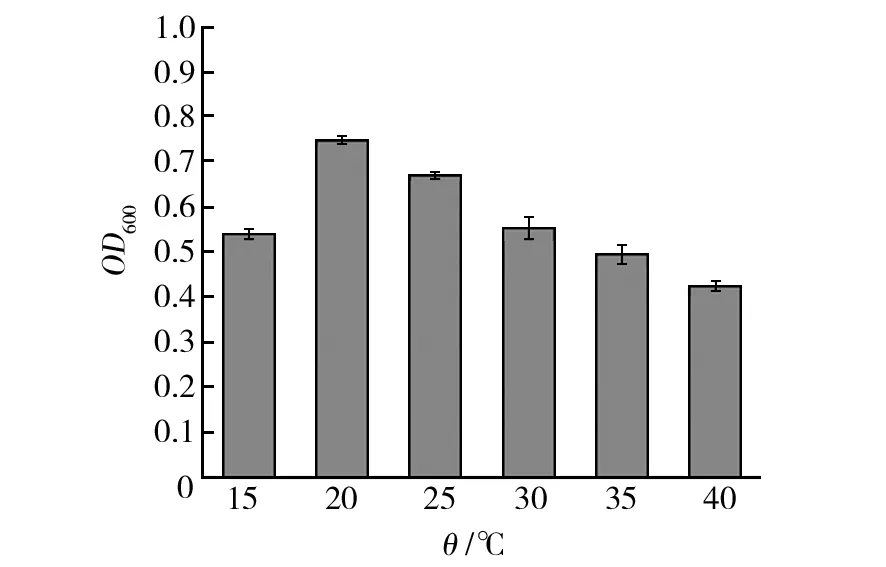
图5 温度对菌株 NWMCC0047 生长的影响Fig.5 Effects of temperature on the growth of strain NWMCC0047
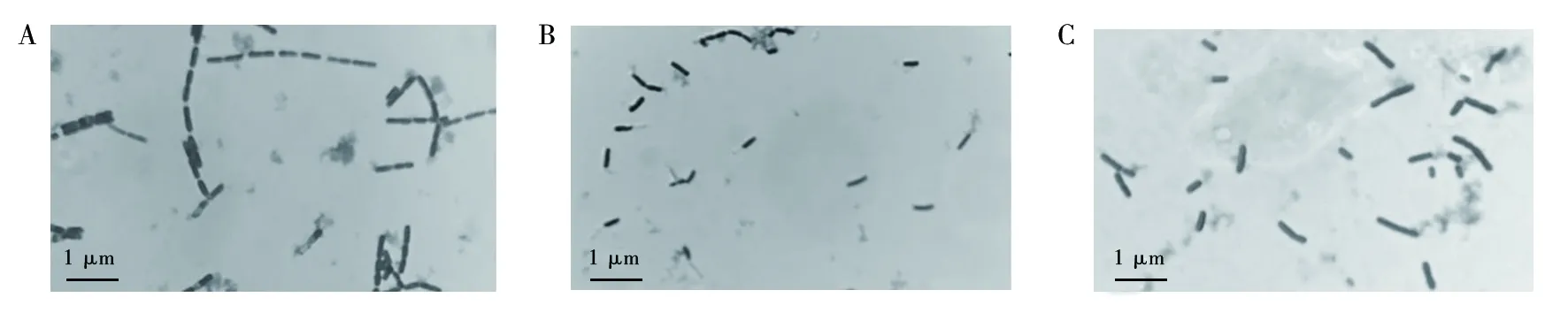
图6 37 ℃(A)、42 ℃(B)、27 ℃(C)时培养菌革兰染色结果Fig.6 Gram staining results of cultured bacteria at 37 ℃(A),42 ℃(B) and 27 ℃(C)
通过对不同温度和pH条件下菌株的革兰染色发现,菌株在不同条件下形态以及染色上有较大差异。Lee等[13]研究了青霉素结合蛋白(PBP)1A的非均相定位动力学,发现此蛋白可在多水平的调控作用下,通过改变酶活性的方式来控制肽聚糖的形成与延伸。而肽聚糖在提供机械支撑、保持细胞形态、抗渗透抵抗方面有着重要作用[14]。革兰染色所观察到细菌个体的形态染色变化可能由于不同的温度、pH培养条件影响了菌体肽聚糖的形成、延伸以及松紧度从而造成细胞壁的形态异常。肽聚糖的稳定结构被破坏时,革兰染色第一步中的结晶紫燃料无法与肽聚糖相对紧密结合[15],染色完成后易出现假阴性现象,菌体死亡则染色极浅。实验结果表明,pH主要影响细菌的连接以及细胞壁的松紧程度,对少部分细菌的肽聚糖形成和延伸造成破坏。温度则对于细菌连接以及肽聚糖的延伸和形成影响较大。温度对于细菌存活的影响要比pH显著,在后续降解实验中应优先探究温度对菌株血液降解的影响。
2.6 蛋白酶活力测定
由酪氨酸标准曲线(图7)得到的K值为98.97。获得菌株NWMCC0047粗酶液的蛋白酶活力为19.00 U/mL。
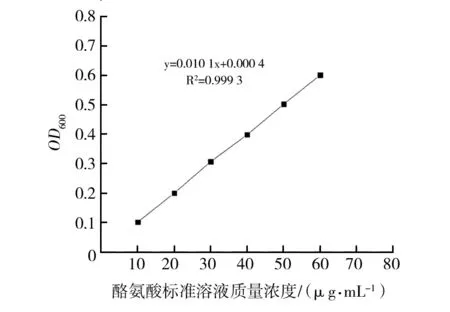
图7 酪氨酸标准曲线Fig.7 Standard curve of tyrosine
2.7 血液降解条件优化
菌株NWMCC0047以麦麸作为碳源时生长情况较好,血液降解率可达12.33%,优于其他碳源,表明麦麸是该菌株生长的最佳碳源(图8)。麦麸是小麦制粉加工中的主要副产物,由种皮、糊粉层、少量胚芽及胚乳组成,含有可溶和不可溶性非淀粉多糖、水分、灰分、蛋白质、脂肪、微量元素等营养成分,为菌株生长提供了较为全面的营养条件[16]。麦麸中的各种微量内源微生物也可能与菌株NWMCC0047产生协作共生作用,一定程度上提升了血液降解效率[17]。经过实验观察,添加麦麸组的菌液中血液由深红色变为深绿色并伴有浓烈的氨臭味,瓶中血液浓稠。周涛等[18]的研究表明,细菌附着在载体上并达到一定的密度时,就开始分泌胞外聚合物(EPS)并形成固着在载体表面的胞外聚合物基质团。在生物膜中,EPS能够为细菌提供一种天然的屏障,并在菌体代谢方面发挥着重要作用。推测麦麸的颗粒大小和溶解性质使其在培养细菌中充当了微载体的作用,有利于细菌附着与胞外聚合物的形成,进一步促进了菌株的生长和代谢,从而提升了血液降解效率。
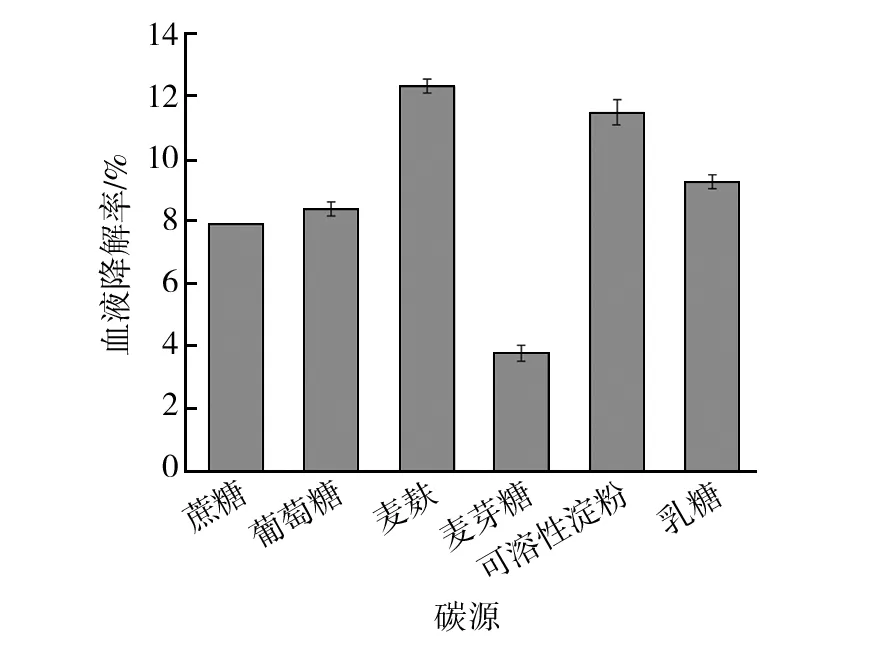
图8 碳源对菌株降解效率的影响Fig.8 Effect of carbon source on degradation efficiency of strains
菌株NWMCC0047经过降解条件的初步优化后,血液降解率可达21.97%,比未优化前(5.92%)提升约3.7倍。虽然不添加无机盐组降解效率略低于Na2HPO4组,但从后续工业化生产的经济效益考虑,不添加无机盐的综合效果最优(图9)。菌株生物膜的生长是一个动力学过程并且受外界环境的影响,主要包括膜内外渗透压的作用、基质扩散的条件限制、液相主体之间的剪切作用、膜内外温度以及pH值的影响等,而渗透压是引起水和营养物质在生物体中运动和运输的重要推动力,因此研究渗透压对细菌生物膜生长的影响具有重要意义[18]。根据实验结果推测,菌体生长所需渗透压与10%(体积分数)牦牛血培养基相近,加入5 g/L NaCl时,带入周涛研究所得公式[18],培养基中渗透压将大幅度提升,很可能超出了菌体的适宜生长条件。
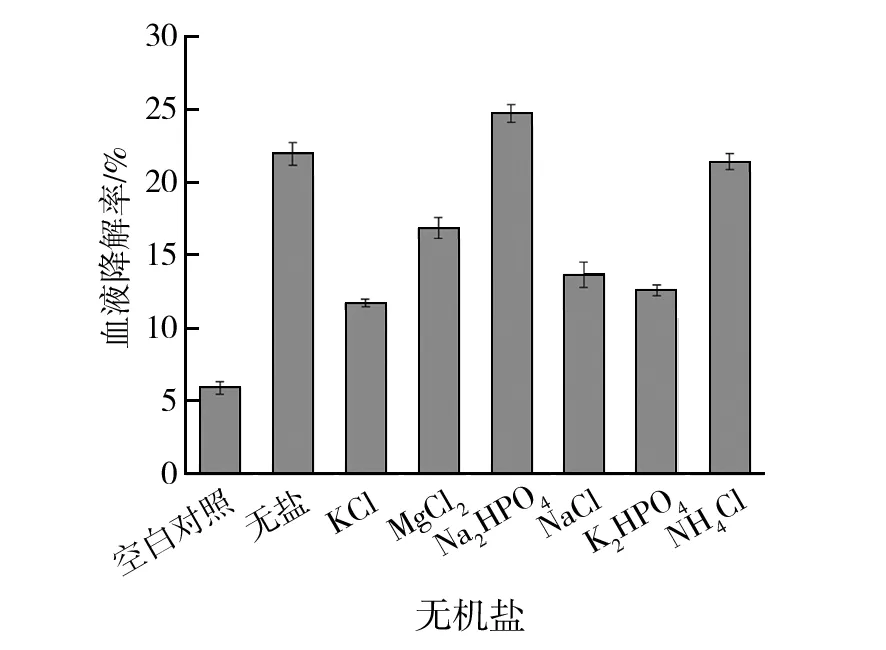
图9 无机盐对菌株降解效率的影响Fig.9 Effect of inorganic salt on degradation efficiency of strains
3 讨 论
近年来,以动物的血污、毛发及蹄脚等作为原料,采用微生物降解工艺生产氨基酸液体肥料具有广阔的应用前景[19],而其上游环节备用菌株的筛选是至关重要的一步。本研究完成了对一株具有降解血液能力的菌株的分离鉴定及其降解血液条件的初步探索,获得一株具有高效降解潜力的乙酰微小杆菌,为初步筛选备用菌株提供了简单可参考的实验方法。菌株NWMCC0047的初始血液降解率为5.92%,初步优化后,血液降解效率为21.97%,比未优化前有显著提升。实验中LB培养基为基础培养基得到的最适生长条件对血液培养基成分的探究有参考意义,可作为血液降解最适条件的备选条件。且根据实验中温度对细菌生长情况的研究,推测温度可能主要影响菌体细胞壁合成酶以及细胞壁上受体等功能蛋白质的活性和渗透压大小从而影响菌体生长,且其影响大于pH,故在后续试验中应先开展菌株最适温度条件的探究。而在血液降解实验中由于麦麸的营养价值和经济价值的统一以及无机盐对与菌体生长环境渗透压的影响,获得的最适碳源和无机盐的血液降解条件对于用微生物法血液降解研究有重要参考意义。
Yao等[20]从屠宰场取样分离出一种可降解血红蛋白的短小芽胞杆菌,优化后的蛋白酶活力为35.437 U/mL,当血粉添加量为2.1%时,可在36 h内降解85%的血红蛋白。张滨[5]从长沙市五里牌畜禽定点屠宰厂附近的土壤中分离出一株可有效降解血红蛋白的蜡样芽胞杆菌亚种,酶活力可达483.81 U/mL,当血红蛋白添加量为1.05%时,血红蛋白降解率为40.25%。菌株NWMCC0047比上述功能菌株蛋白酶活力偏低的原因很可能是由于发酵培养基的选择不当从而限制了其繁殖和蛋白酶的产生;也可能因蛋白酶未及时释放到胞外或培养基中所致,有待通过细胞破碎、优化培养基组分,对候选菌株进行基因改造及诱变育种,从而提高菌株繁殖能力和产酶能力[6]。菌株NWMCC0047的血液降解效率一方面可以通过对金属离子、培养温度、添加血液浓度、菌种添加量的探究来提升;另一方面可以通过紫外诱变筛选菌株、多种菌株混合、菌株和产蛋白酶或溶血素混合等方式进一步提升菌株降解血液的能力。
氨基酸肥料作为一种新型的生态肥料,其使用范围也将会越来越广[21]。刘娜等[22]已经完成了以废弃革屑为原料制备含氨基酸水溶肥料的工艺,并取得了较好的结果,但因其在制备过程中使用国家现已违禁添加的强酸而被禁止。而微生物法生产氨基酸水溶肥料的前景愈发广阔,氨基酸水解液可经过浓缩干燥处理制备成固体氨基酸粉末,直接加入肥料中制成氨基酸水溶肥[3]。李廷勋等[23]发明了一种利用地衣芽孢杆菌和大豆来源的蛋白酶降解家畜血液制成的一种液体氨基酸肥料。许丽娟等[25]利用动物蛋白废弃物水解而成的复合氨基酸以及微量元素锰、锌等为原料,制备复合氨基酸微量元素螯合肥。目前国内外在利用微生物法制备氨基酸肥料的工艺研究总体不够深入,相比之下我国的研究相对较多,可行性较高。但是由于工艺的复杂性和成本问题等诸多原因,尚未探究出一条完整且经济的工业化生产道路,采用微生物降解工艺生产氨基酸液体肥亟须进一步研究。
