冬凌草甲素逆转乳腺癌MCF-7细胞对氟维司群耐药的机制研究Δ
2022-10-10胡高波朱瑞金湛魏自太衢州职业技术学院医学院浙江衢州34000浙江中医药大学药学院杭州30053
胡高波,朱瑞,金湛,魏自太#(.衢州职业技术学院医学院,浙江 衢州 34000;.浙江中医药大学药学院,杭州 30053)
乳腺癌是女性最常见的恶性肿瘤之一,发病率和病死率高[1]。据WHO国际癌症研究机构数据显示,2020年乳腺癌全球新发226万例,占新发癌症病例的11.7%,成为全球第一大癌症。中国是乳腺癌大国,2020年新发乳腺癌约42万例,并导致近12万人死亡[2]。化疗仍是目前治疗乳腺癌的主要方式,其在缩小病灶、减少手术造成的伤残、提高乳腺癌患者生存率等方面具有较大优势[3],但耐药性是无法避免的现实问题[4]。氟维司群(fulvestrant,Ful)作为治疗乳腺癌的一种新型抗雌激素药物[5],其耐药性问题仍是急需突破的瓶颈[6-8]。
冬凌草甲素(oridonin,Ori)是从冬凌草植物中提取的二萜类化合物,具有良好的抗肿瘤活性,对白血病细胞、胃癌细胞的耐药性具有较好的逆转作用[9-11]。相关研究表明,通过调控磷脂酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)/蛋白激酶 B(protein kinase B,Akt)信号通路,可以达到逆转肿瘤耐药性的效果[12]。本团队前期通过研究证明Ori可能通过诱导乳腺癌MCF-7/Ful细胞产生DNA损伤,引起细胞凋亡、细胞周期阻滞及细胞自噬,从而逆转乳腺癌MCF-7细胞对Ful的耐药[13]。因此,本研究拟通过检测PI3K/Akt信号通路相关蛋白的表达,以及裸鼠肿瘤质量和体积的变化,进一步探讨Ori逆转乳腺癌MCF-7细胞对Ful耐药的机制。
1 材料
1.1 主要仪器
本研究所用主要仪器包括BB150型CO2培养箱(美国Thermo Fisher Scientific公司)、TDL-4型低速离心机(浙江纳德科学仪器有限公司)、Mini-PROTEAN型电泳仪(美国Bio-Rad公司)、ChemiScope 6200 Touch型化学发光成像系统(上海勤翔科学仪器有限公司)、FA1004N型电子天平(上海仪天科学仪器有限公司)等。
1.2 主要药品与试剂
本研究所用主要药品与试剂包括Ori对照品(上海源叶生物科技有限公司,纯度≥98%),Ful对照品(美国Sigma公司,纯度≥98%),DMEM培养液、胎牛血清(美国Hyclone公司),MTT(北京索莱宝科技有限公司,批号1021C018),BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司,批号P0032),兔源PI3K、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)、甘油醛-3-磷酸脱氢酶(GAPDH)抗体和辣根过氧化物酶标记的羊抗兔IgG二抗(美国CST公司),青霉素、链霉素(杭州吉诺生物医药技术有限公司)等。
1.3 细胞与动物
人乳腺癌MCF-7细胞株购自中国科学院上海细胞库。SPF级BALB/c裸鼠,4周龄,雄性,体质量20~25 g,购自上海斯莱克实验动物有限责任公司,动物生产合格证号为SCXK(沪)2017-0009,饲养于浙江中医药大学实验动物中心。本研究经衢州职业技术学院医学院动物伦理中心审批通过,伦理号:20191209-09。
2 方法
2.1 Ori体外逆转乳腺癌MCF-7细胞对Ful耐药机制的验证
2.1.1 耐药细胞诱导及培养 将不耐药的正常乳腺癌MCF-7细胞培养于含10%胎牛血清、200 U/mL青霉素、200 U/mL链霉素的DMEM培养液中,并于培养液中加入Ful,压力(Ful浓度为1 μmol/L)筛选12个月,诱导细胞耐药。然后调整Ful剂量为0.5 μmol/L,置于37℃、5%CO2培养箱中继续培养至对数生长期,即得对Ful耐药的乳腺癌MCF-7/Ful细胞,用于后续实验。药物剂量参考文献[13]和前期预实验结果设置。
2.1.2 MCF-7和MCF-7/Ful细胞相对细胞活力检测 采用MTT法进行检测。取对数生长期的正常MCF-7细胞及“2.1.1”项下MCF-7/Ful细胞,接种至96孔板中,每孔3 000个细胞。将细胞置于37℃、5%CO2培养箱中培养过夜,待细胞完全贴壁后,根据预实验结果,每孔加入不同浓度[0(对照)、0.1、1、10、20、50 μmol/L]的Ful,每个浓度设置4个复孔;另设空白培养基组,药物剂量参考文献[13]和前期预实验结果设置。药物作用48 h后,每孔加入5 mg/mL MTT溶液20 μL,继续培养4 h后,每孔再加入三联裂解液(盐酸+十二烷基硫酸钠+异丙醇)200 μL,于37℃恒温培养箱中放置18 h后,使用酶标仪在570 nm波长处测定各孔的光密度(OD),并计算相对细胞活力。相对细胞活力(%)=(实验组OD570-空白培养基组OD570)/(对照组OD570-空白培养基组OD570)×100%。实验重复3次。
2.1.3 MCF-7/Ful细胞抑制率及联合指数检测 采用MTT法进行检测。取“2.1.1”项下MCF-7/Ful细胞,接种至96孔板中,每孔3 000个细胞。待细胞贴壁后,用不同浓度的Ori[0(对照)、5、10 μmol/L]和Ful[0(对照)、4、8、12、16、20 μmol/L]单独及联合使用处理细胞48 h,每个浓度设置4个复孔。药物剂量依据前期预实验结果设置。每孔加入MTT溶液20 μL,培养4 h后,再加入三联裂解液(盐酸+十二烷基硫酸钠+异丙醇)200 μL,继续放置18 h后,使用酶标仪在570 nm波长处测定OD,并计算细胞抑制率。细胞抑制率(%)=(对照组OD570-实验组 OD570)/对照组 OD570×100%,实验重复 3 次。采用CompuSyn软件绘制不同联合效应下的抑制率-联合指数关系图,计算不同剂量组合下的联合指数。
2.1.4 MCF-7/Ful细胞中PI3K/Akt信号通路相关蛋白的检测 采用Western blot法进行检测。取“2.1.1”项下MCF-7/Ful细胞接种至6孔板中,每孔6×105个细胞。将细胞随机分为空白对照组、Ful组(5 μmol/L)、Ori组(8 μmol/L)、Ful(5 μmol/L)+Ori(8 μmol/L)组,每组设置4个复孔。待细胞贴壁后,按上述分组加入相应的药物或磷酸盐缓冲液。药物剂量依据前期预实验结果设置。作用24 h后加入RIPA裂解液,于冰上裂解30 min后离心(3 000 r/min,5 min),取上清液,凝胶电泳分离总蛋白。电压开始设置为80 V,当蛋白样品进入分离胶后,电压提高到120 V,参照预染Marker的位置,待目的条带进入凝胶最佳分离区时,停止电泳。在凝胶上面铺上经甲醇和转膜液浸湿的PVDF膜,在PVDF膜上再放3层浸过转膜液的滤纸,放上第2块海绵垫,放入转移槽中,槽中灌满转膜液,打开电源,稳流200 mA(120 min)。转膜结束后,取出PVDF膜并做好标记,用TBST洗膜10 min×3次。将PVDF膜放入孵育盒中,加入含5%脱脂奶粉的封闭液,摇床振荡1.5~2.0 h;封闭结束后,用TBST洗膜10 min×3次。加入p-PI3K、PI3K、p-Akt、Akt、GAPDH一抗(稀释度均为1∶1 000),4℃孵育过夜;洗膜后,加入辣根过氧化物酶标记的羊抗兔IgG二抗(稀释度为1∶2 000),室温孵育2 h,显影。采用Image J软件对蛋白条带进行灰度值分析,以PI3K、Akt蛋白与内参蛋白(GAPDH)条带灰度值的比值表示目标蛋白的表达水平,以p-PI3K/PI3K、p-Akt/Akt比值分别表示PI3K、Akt的磷酸化水平。
2.2 Ori体内逆转乳腺癌MCF-7细胞对Ful耐药机制的验证
采用裸鼠移植瘤模型进行体内实验验证。将裸鼠随机分为空白对照组、Ful组(80 μmol/g)、Ori组(50 μmol/g)、Ful(80 μmol/g)+Ori(50 μmol/g)组,每组8只,分笼饲养。药物剂量由前期预实验结果确定。取“2.1.1”项下MCF-7/Ful细胞,胰酶消化后,用生理盐水调整细胞密度为1×107个/mL,以每只裸鼠0.2 mL接种于裸鼠背部皮下,观察移植瘤的生长情况。待肿瘤生长至100 mm3左右时,按分组腹腔注射相应的药物或磷酸盐缓冲液,每4天1次,每次注射前用游标卡尺测量肿瘤的长径和短径,持续28 d。肿瘤体积=1/2长径×2倍短径。给药结束后采用CO2处死裸鼠,解剖裸鼠取出肿瘤,称量肿瘤质量,计算抑瘤率。抑瘤率(%)=[(空白对照组肿瘤质量-给药组肿瘤质量)/空白对照组肿瘤质量]×100%。
2.3 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1MCF-7和MCF-7/Ful细胞相对细胞活力的检测结果
MTT法检测结果显示,Ful能够不同程度地抑制MCF-7和MCF-7/Ful细胞增殖,且具有剂量依赖趋势。当Ful≥10 μmol/L时,MCF-7/Ful细胞的相对细胞活力显著高于MCF-7细胞(P<0.05),结果见图1。在Ful作用下,MCF-7/Ful细胞活力越大,代表其耐药性越强。
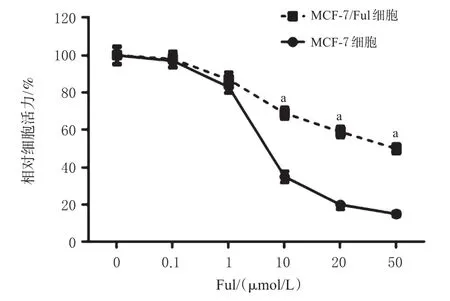
图1 Ful作用下MCF-7和MCF-7/Ful细胞的相对细胞活力折线图
3.2Ori对MCF-7/Ful细胞抑制率的影响及联合指数结果
MTT法检测结果显示,Ori能够对MCF-7/Ful细胞产生抑制,且具有剂量依赖趋势。当Ori和Ful联合使用时,与两者相应剂量单独使用时对比,MCF-7/Ful细胞的抑制率均显著升高(P<0.05或P<0.01),结果见表1。结果表明,Ori能够逆转乳腺癌MCF-7细胞对Ful的耐药,且与Ful联合使用后,逆转耐药效果更强。通过CompuSyn软件绘制得到抑制率-联合指数关系图(图2)。如图2所示,各剂量组联合指数均在横线下方,即联合指数均小于1,具有协同作用[14]。当Ori剂量为5 μmol/L、Ful剂量为8 μmol/L时,联合指数最小。
表1 乳腺癌MCF-7/Ful细胞抑制率(±s,n=4)

表1 乳腺癌MCF-7/Ful细胞抑制率(±s,n=4)
a:与相应剂量Ful单独使用比较,P<0.05;b:与相应剂量Ori单独使用比较,P<0.05;c:与相应剂量Ori单独使用比较,P<0.01
Ful 20 μmol/L 42.12±5.69 60.63±5.41ac 71.69±6.56ac Ori/(μmol/L)0 5 1 0 Ful 0 μmol/L 0 17.32±3.23 31.64±4.23 Ful 4 μmol/L 14.23±1.32 32.36±2.36ab 39.69±5.12ab Ful 8 μmol/L 28.31±2.36 55.32±5.63ac 59.69±5.98ab Ful 16 μmol/L 35.1±4.23 59.21±5.12ac 69.32±6.12ab
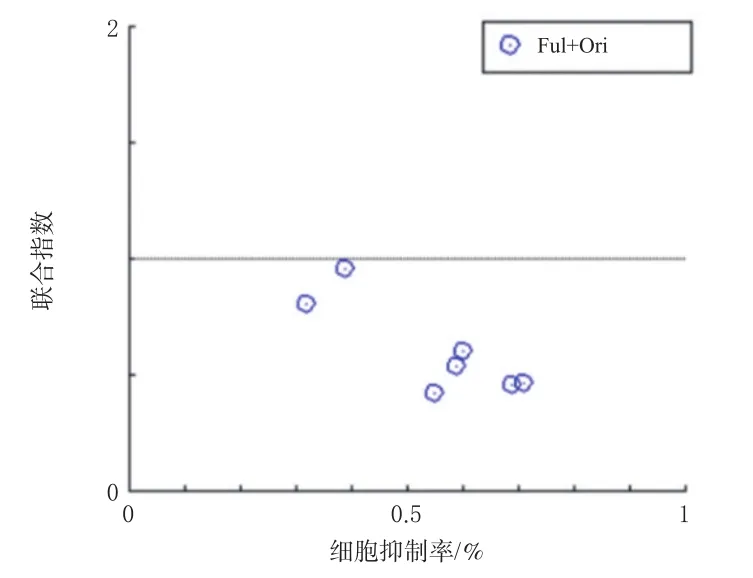
图2 Ful和Ori联合使用的抑制率-联合指数关系图
3.3 Ori对乳腺癌MCF-7/Ful细胞中PI3K/Akt信号通路的影响
与空白对照组比较,Ori组和Ful+Ori组细胞中p-PI3K/PI3K、p-Akt/Akt比值及Ful组细胞中p-PI3K/PI3K比值均显著降低(P<0.05或P<0.01);与Ful组比较,Ful+Ori组细胞中p-PI3K/PI3K、p-Akt/Akt比值均显著降低(P<0.05或P<0.01)。结果见图3。
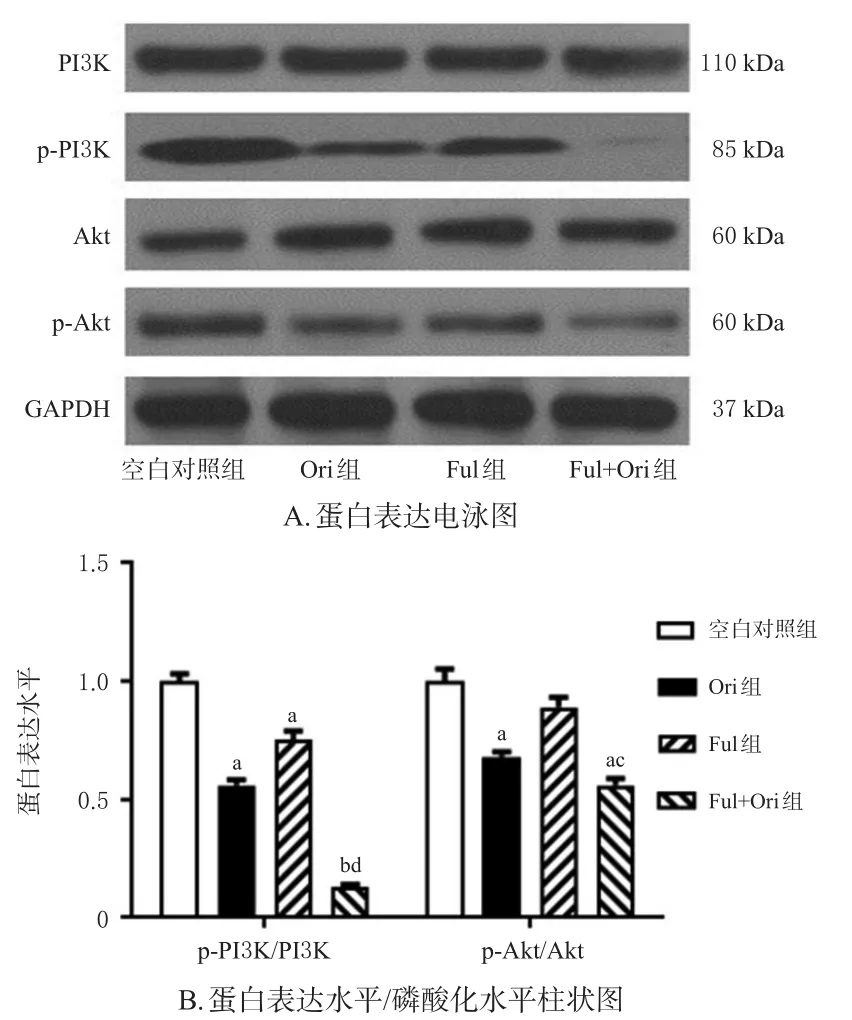
图3 乳腺癌MCF-7/Ful细胞中PI3K/Akt信号通路相关蛋白表达的检测结果
3.4 Ori和Ful的体内抑瘤效应验证结果
与空白对照组和Ful组比较,Ful+Ori组裸鼠的肿瘤生长速度明显降低,肿瘤体积从12 d开始具有显著差异(P<0.05或P<0.01),各组裸鼠的肿瘤体积变化曲线见图4。给药结束后,与空白对照组和Ful组比较,Ful+Ori组裸鼠肿瘤质量著减小(P<0.01);Ful+Ori组的抑瘤率为(63.90±4.11)%,较Ful组显著增加(P<0.01),各组裸鼠肿瘤质量与抑瘤率见表2。
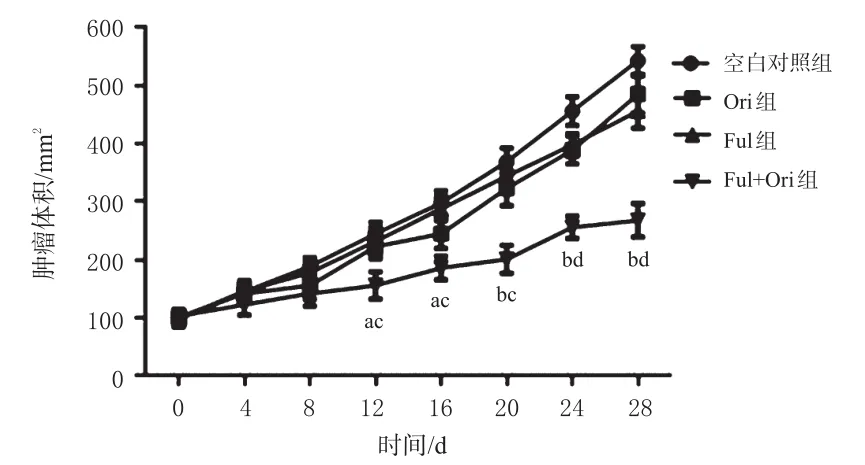
图4 各组裸鼠的肿瘤体积变化曲线
表2 各组裸鼠肿瘤质量及抑瘤率结果比较(±s,n=8)
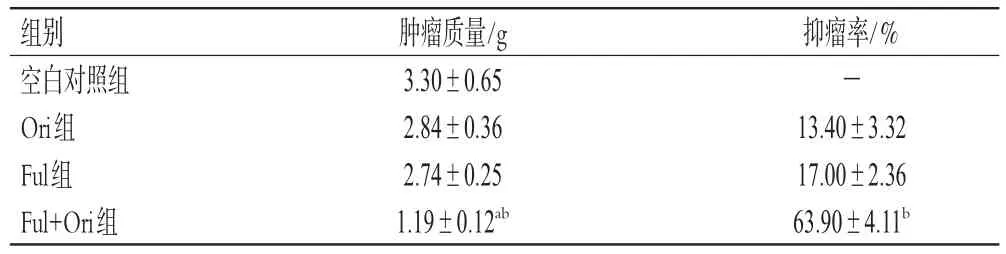
表2 各组裸鼠肿瘤质量及抑瘤率结果比较(±s,n=8)
a:与空白对照组比较,P<0.01;b:与Ful组比较,P<0.01;-:无数据
抑瘤率/%-13.40±3.32 17.00±2.36 63.90±4.11b组别空白对照组Ori组Ful组Ful+Ori组肿瘤质量/g 3.30±0.65 2.84±0.36 2.74±0.25 1.19±0.12ab
4 讨论
现阶段乳腺癌的治疗以化疗为主,但长期化疗会造成人体损伤,引发毒副作用和耐药。耐药性的产生是乳腺癌患者临床治疗失败的主要原因。Ful是近年来开发的一种抗雌激素药物,因其可靠的临床效果及独特的作用机制,受到临床好评,但Ful的耐药性仍是急需解决的问题[15-17]。
Ori对肿瘤具有一定的预防和治疗作用,能够抑制肝癌、卵巢癌及胃癌等多种肿瘤细胞的增殖,在逆转肿瘤耐药方面有一定效果[18-20]。本研究通过Ful诱导乳腺癌MCF-7细胞获得耐药性MCF-7/Ful细胞,同时不同浓度的Ori可以对乳腺癌MCF-7/Ful细胞产生明显的抑制作用,表明Ori能够逆转乳腺癌MCF-7细胞对Ful的耐药。通过CompuSyn软件分析发现,5 μmol/L的Ori和8 μmol/L的Ful联合作用时,相关联合指数最小,表明二者联用对乳腺癌MCF-7/Ful细胞抑制效果最好,逆转耐药效果也最佳。
PI3K/Akt信号通路的异常活化在大多数肿瘤中都有发生。研究表明,PI3K/Akt信号通路在介导肿瘤多药耐药导致化疗和放疗抵抗方面发挥着重要作用[21]。本研究结果显示,与Ful组比较,Ful+Ori组细胞中p-PI3K/PI3K比值、p-Akt/Akt比值显著降低,表明Ful和Ori联合使用后能够有效抑制PI3K和Akt的磷酸化,发挥逆转耐药的作用。
裸鼠因胸腺缺失,缺乏成熟的T淋巴细胞,能够使移植后的肿瘤细胞生长良好,并能保持肿瘤细胞原有的形态和病理特性,成为肿瘤研究中较为理想的动物实验工具[22]。为进一步验证Ori逆转耐药的体内效应,本研究采用乳腺癌MCF-7/Ful耐药细胞构建了裸鼠移植瘤模型。实验结果表明,Ori联合Ful能够明显减缓肿瘤生长速度,降低肿瘤质量,提高抑瘤率。
综上所述,Ori能够逆转乳腺癌MCF-7细胞对Ful的耐药,此作用可能是通过调控PI3K/Akt信号通路实现的,逆转耐药效果在裸鼠体内也得到验证,本研究可为乳腺癌的临床治疗提供实验依据。
