长叶纽子果根醇提物乙酸乙酯萃取部位的化学成分及体外抗炎活性研究Δ
2022-10-10周永强廖张蓉叶洪波殷鑫魏鑫周英贵州中医药大学药学院贵阳550025
周永强,廖张蓉,叶洪波,殷鑫,魏鑫,周英(贵州中医药大学药学院,贵阳 550025)
紫金牛属Ardisia植物多为小乔木,具有消炎、消肿等功效,主要用于治疗跌打损伤等病症,其所含化学成分的类型主要有皂苷类、香豆素类、苯酚类、三萜类等[1-2]。其中,长叶纽子果Ardisia virensKurz var.annamensisPitard.作为紫金科紫金牛属常见植物,其药用部位为干燥的根,主要分布于贵州、广西(上思)、云南等地[3]。在民间用药中,长叶纽子果根主要用于治疗风湿、跌打损伤以及各种炎症,然而其功效成分尚不清楚,有关其化学成分的研究鲜有报道。本课题组前期开展了长叶纽子果根70%乙醇提取物正丁醇萃取部位的化学成分研究,发现该萃取部位中主要成分有岩白菜素类及三萜皂苷类化合物[4]。为丰富长叶纽子果根的化学物质基础,本研究对其70%乙醇提取物的乙酸乙酯萃取部位进行分离、纯化,并对所得到的化合物进行初步体外抗炎活性评价,以期为深入开展长叶纽子果根化学成分及药理活性研究提供科学依据。
1 材料
1.1 主要仪器
本研究所用的主要仪器包括Bruker-400型超导核磁共振(NMR)光谱仪(德国Bruker公司),SEP-LC52 MWD型紫外检测器(赛谱锐思北京科技有限公司),LC-16D半制备型高效液相色谱(HPLC)仪、RID-20A型示差折光检测器(日本Shimadzu公司),AAPI 3200型质谱(MS)仪(美国Sciex公司),Multiskan GO型全波长酶标仪(美国Thermo Fisher Scientific公司)等。
1.2 主要药品与试剂
长叶纽子果药材于2019年8月采自云南省昌宁县,由贵州中医药大学中药资源教研室江维克教授鉴定为紫金牛属植物长叶纽子果A.virensKurz var.annamensisPitard.的根(标本号20190813)。地塞米松对照品(批号D4902,纯度98%)购自美国Sigma公司;C18反相柱填料ODS-A-HG购自日本YMC公司;MTT溶液及葡聚糖凝胶LH-20均购自北京索莱宝科技有限公司;柱层析硅胶购自青岛海洋化工厂分厂;Gibco培养基购自赛默飞世尔生物化学制品(北京)有限公司;甲醇为色谱纯,其余试剂均为分析纯,水为屈臣氏饮用水或去离子水。
1.3 细胞
小鼠单核巨噬细胞白血病细胞RAW264.7(货号CL-0190)购自武汉普诺赛生命科技有限公司。
2 方法与结果
2.1 长叶纽子果根醇提物乙酸乙酯萃取部位化学成分的提取分离
取干燥的长叶纽子果根15.0 kg,粉碎,过20目筛,以70%乙醇加热回流提取2次(150 L/次),每次2 h。回收乙醇,浓缩得浸膏3.08 kg。将浸膏加去离子水9 L分散后,依次用等体积石油醚、乙酸乙酯以及水饱和正丁醇萃取,浓缩,分别得到各萃取物浸膏155.8、546.4、813.7 g。取乙酸乙酯萃取物浸膏(244 g)进行硅胶(200~300目)柱色谱分离,以二氯甲烷-甲醇(70∶1、40∶1、15∶1、5∶1、1∶1、0∶1,V/V)进行梯度洗脱,结合薄层色谱(TLC)检测,合并极性相同的部分后得到9个组分(A1~A9),并对A1~A4这4个组分进行进一步分离纯化。其中,对A1组分进一步用ODS柱进行色谱分离,采用TLC分析,合并相同成分后共得到8个组分(Aa1-1~Aa1-8)。对Aa1-3组分进行硅胶柱色谱纯化,并采用石油醚-乙酸乙酯(20∶1、10∶1、8∶1、4∶1、2∶1、1∶1、0∶1,V/V)进行梯度洗脱,最终析出无色针状结晶,得到化合物2(3 mg)。采用ODS柱对A2组分进行色谱分离,采用TLC分析,合并相同成分后共得到10个组分(Aa2-1~Aa2-10)。组分Aa2-3经LC-16P半制备液相(47%甲醇-水)纯化后得到化合物3(3 mg);组分Aa2-7经LC-16P半制备液相(54%甲醇-水)纯化后得到化合物4(6 mg),经LC-16P半制备液相(85%甲醇-水)纯化后得到化合物1(8 mg)。采用ODS柱对A3组分进行色谱分离,采用TLC分析,合并相同成分后共得到11个组分(Aa3-1~Aa3-11)。组分Aa3-4经LC-16P半制备液相(67%甲醇-水)纯化后得到化合物9(8 mg);组分Aa3-6经聚苯乙烯基反相树脂填料(MCI)柱色谱分离后得到化合物10(5 mg);组分Aa3-7经硅胶柱纯化后得到化合物11(3 mg);组分Aa3-8先用ODS柱进行色谱分离,采用TLC分析,合并相同成分后共得到8个组分(Aa3-8-1~Aa3-8-8),然后再利用LC-16P半制备液相(85%甲醇)纯化Aa3-8-6后得到化合物7(4 mg);组分Aa3-8-3进一步利用硅胶柱进行分离,得到化合物5(8 mg)和化合物6(4 mg);将组分A4进一步用ODS柱进行色谱分离,得到10个组分(Aa4-1~Aa4-10),其中Aa4-7经LC-16P半制备液相(80%甲醇-水)纯化后得到化合物8(7 mg)。
2.2 长叶纽子果根醇提物乙酸乙酯萃取部位化学成分的结构鉴定
2.2.1 化合物1 化合物1的分子式为C30H48O4,为白色无定形粉末;电喷雾电离质谱(ESI-MS):m/z471.3[MH]-;1H-NMR(CD3OD,400 MHz)δH:9.41(1H,d,J=1.2 Hz,H-30),0.76(3H,s,H-25),0.89(3H,s,H-29),0.97(3H,s,H-24),0.98(3H,s,H-23),1.14(3H,s,H-26),1.28(3H,s,H-27),0.71(1H,dd,J=2.6、11.3 Hz,H-5)。13C-NMR(CD3OD,100 MHz)δC:16.0(C-24),16.7(C-25),18.9(C-27),20.1(C-26),23.3(C-29),28.6(C-23),207.3(C-30),38.0(C-1),28.0(C-2),79.7(C-3),40.3(C-4),56.6(C-5),18.2(C-6),33.2(C-7),44.8(C-8),54.0(C-9),43.4(C-10),19.8(C-11),31.0(C-12),88.2(C-13),45.3(C-14),34.0(C-15),77.8(C-16),49.1(C-17),51.4(C-18),24.3(C-19),38.1(C-20),37.0(C-21),32.8(C-22),78.5(C-28)。以上波谱数据与文献[5]报道的已知化合物基本一致,故鉴定化合物1为西克拉敏皂苷元A。
2.2.2 化合物2 化合物2的分子式为C29H48O,为无色针状结晶;ESI-MS:m/z411.3[M-H]-;1H-NMR(CDCl3,400 MHz)δH:5.14(1H,d,J=8.5 Hz,H-22),5.02(1H,dd,J=8.7、15.2 Hz,H-23),0.55(3H,s,H-18),0.79(3H,d,J=2.0 Hz,H-27),0.80(3H,s,H-19),0.82~0.87(3H,m,H-29),1.03(3H,d,J=6.7 Hz,H-21),0.95(3H,d,J=7.4 Hz,H-26),3.2~3.85(1H,m,H-3),5.15~5.17(1H,m,H-7)。13C-NMR(CDCl3,100 MHz)δC:117.6.3(C-7),129.6(C-23),139.7(C-8),138.3(C-22),12.2(C-29),12.4(C-18),13.2(C-19),19.1(C-27),21.2(C-26),21.7(C-21),37.3(C-1),31.7(C-2),71.2(C-3),38.2(C-4),40.4(C-5),29.8(C-6),49.6(C-9),34.4(C-10),21.7(C-11),39.6(C-12),43.4(C-13),55.3(C-14),23.2(C-15),28.7(C-16),56.1(C-17),40.1(C-20),51.4(C-24),32.0(C-25),25.6(C-28)。以上波谱数据与文献[6]报道的已知化合物基本一致,故鉴定化合物2为α-菠甾醇。
2.2.3 化合物3 化合物3的分子式为C13H22O4,无色无定形粉末;ESI-MS:m/z241.1[M - H]-;1H-NMR(CD3OD,400 MHz)δH:7.16(1H,d,J=15.8 Hz,H-7),6.18(1H,d,J=15.8 Hz,H-8),3.76(1H,m,H-3),0.96(3H,s,H-11),1.18(3H,s,H-13),1.19(3H,s,H-12),2.29(3H,s,H-10),1.57(1H,dd,J=1.8、12.8 Hz,H-2eq),1.26(1H,d,J=2.4 Hz,H-2ax),2.31(1H,dd,J=1.8、4.9 Hz,H-4eq),1.65(1H,dd,J=9.2、14.3 Hz,H-4ax)。13C-NMR(CD3OD,100 MHz)δC:133.8(C-8),145.5(C-7),200.4(C-9),20.0(C-13),25.1(C-11),28.1(C-10),29.8(C-12),64.4(C-3),36.1(C-1),47.7(C-2),41.3(C-4),68.8(C-5),70.9(C-6)。以上波谱数据与文献[7]报道的已知化合物基本一致,故鉴定化合物3为(3S,5R,6S,7E)-3,5,6-trihydroxy-7-megastigmen-9-one。
2.2.4 化合物4 化合物4的分子式为C10H18O2,为白色无定形粉末;ESI-MS:m/z169.1[M-H]-;1H-NMR(CD3OD,400 MHz)δH:0.85(3H,s,H-8),0.87(3H,s,H-9),1.08(3H,s,H-10)。13C-NMR(CD3OD,100 MHz)δC:13.3(C-10),20.2(C-9),21.8(C-8),76.0(C-2),75.8(C-5),36.7(C-3),39.2(C-6),51.5(C-1),53.8(C-4),48.8(C-7)。以上波谱数据与文献[8]报道的已知化合物基本一致,故鉴定化合物4为(+)-angelicoidenol。
2.2.5 化合物5 化合物5的分子式为C21H38O4,为黄色油状物;ESI-MS:m/z353.2[M-H]-;1H-NMR(CD3OD,400 MHz)δH:4.06(1H,dd,J=6.2、11.4 Hz,H-1a),4.15(1H,dd,J=4.4、11.4 Hz,H-1b),3.55(1H,dd,J=1.8、5.5 Hz,H-3a),3.80(1H,dd,J=4.2、5.8 Hz,H-3b),5.27~5.42(4H,m,H-9′,H-10′、H-12′和 H-13′),0.89~0.93(3H,m,H-18′),1.30~1.37(8H,m,H-5′、H-6′、H-16′和H-17′),1.62(2H,t,J=7.4 Hz,H-3′),2.03~2.10(4H,m,H-8′和 H-14′),2.35(2H,t,J=7.5 Hz,H-2′),2.78(2H,t,J=6.2 Hz,H-11′)。13C-NMR(CD3OD,100 MHz)δC:130.9(C-9′),129.1(C-10′),129.0(C-12′),130.8(C-13′),175.4(C-1′),23.7(C-17′),26.1(C-16′),26.6(C-11′),28.7(C-8′和 C-14′),30.2(C-3′),30.2(C-4′),66.4(C-3),64.0(C-1),71.2(C-2),14.6(C-18′),30.3(C-5′),30.5(C-6′),30.8(C-15′),32.7(C-7′),34.8(C-2′)。以上波谱数据与文献[9]报道的已知化合物基本一致,故鉴定化合物5为十八碳癸二烯酸-2,3-二羟丙基酯。
2.2.6 化合物6 化合物6的分子式为C18H30O2,为无色油状物;ESI-MS:m/z277.2[M-H]-;1H-NMR(CD3OD,400 MHz)δH:5.26~5.42(6H,m,H-9、H-10、H-12、H-13、H-15和H-16),0.98(3H,t,J=7.6 Hz,H-18),1.27~1.41(8H,m,4×CH2),1.60(2H,t,J=7.5 Hz,H-3),2.08(4H,qd,J=1.4、7.5 Hz,H-8 和 H-17),2.28(2H,t,J=7.5 Hz,H-2),2.78~2.86(4H,m,H-11和 H-14)。13C-NMR(CD3OD,100 MHz)δC:132.8(C-9),131.2(C-10),129.3(C-12),129.3(C-13),128.8(C-15),128.3(C-16),177.8(C-1),14.8(C-18),21.6(C-17),26.5(C-14),26.5(C-8),26.6(C-11),28.3(C-3),30.3(C-7),30.4(C-6),30.4(C-5),30.8(C-4),35.1(C-2)。以上波谱数据与文献[10]报道的已知化合物基本一致,故鉴定化合物6为α-亚麻酸。
2.2.7 化合物7 化合物7的分子式为C21H40O4,为白色蜡质固体;ESI-MS:m/z355.2[M-H]-;1H-NMR(CD3OD,400 MHz)δH:5.05~5.34(2H,m,H-9′和 H-10′),0.87(3H,t,J=7.1 Hz,H-18′),1.11~1.29(20H,m,H-4′~H-7′和 H-12′~H-17′),1.52(2H,m,H-3′),1.95~2.08(4H,m,H-8′和 H-11′),4.05(2H,dd,J=4.4、11.4 Hz,H-1),2.25(2H,t,J=7.5 Hz,H-2′),3.96(1H,dd,J=6.2、11.4 Hz,H-2),3.44(1H,d,J=1.7 Hz,H-3a),3.46(1H,d,J=1.3 Hz,H-3b)。13C-NMR(CD3OD,100 MHz)δC:130.9(C-9′),130.9(C-10′),175.59(C-1′),14.4(C-18′),23.7(C-17′),26.0(C-3′),28.1(C-11′),30.2(C-4′),30.5(C-12′),30.6(C-5′),30.6(C-13′),30.8(C-6′),30.8(C-7′),28.1(C-8′),30.8(C-14′),30.8(C-15′),33.1(C-16′),34.9(C-2′),64.1(C-3),66.5(C-1),71.2(C-2)。以上波谱数据与文献[11]报道的已知化合物基本一致,故鉴定化合物7为glycerol monooleate。
2.2.8 化合物8 化合物8的分子式为C28H38O4,为白色粉末;ESI-MS:m/z437.1[M-H]-;1H-NMR(CD3OD,400 MHz)δH:6.07(2H,q,J=2.2 Hz,H-2 和 H-2′),6.12(4H,t,J=2.1 Hz,H-4、H-6 和 H-4′、H-6′),5.24~5.44(4H,m,H-4″、H-5″和H-7″、H-8″),1.23~1.41(10H,m,H-2″、H-10″、H-11″、H-12″和H-13″),1.48~1.63(4H,m,H-14″和H-15″),1.94~2.16(4H,m,H-3″和H-9″),2.43(4H,q,J=7.2 Hz,H-1″和H-16″),2.77(2H,t,J=5.7 Hz,H-6″)。13C-NMR(CD3OD,100 MHz)δC:101.0(C-2),101.0(C-2′),107.0(C-4,C-6),107.0(C-4′,C-6′),146.3(C-5),146.3(C-5′),159.3(C-1,C-3),159.3(C-1′,C-3′),129.1(C-4″),130.8(C-5″),129.0(C-8″),131.0(C-7″),26.6(C-6″),28.0(C-9″),28.2(C-3″),30.3(C-10″),30.3(C-11″),30.5(C-2″),30.6(C-12″),30.7(C-13″),32.0(C-14″),30.2(C-15″),36.7(C-1″),36.7(C-16″)。经SciFinder在线数据库(http://scifinder.cas.org/)检索查询,最终确定化合物8为新天然产物5,5′-(4,7-hexadecadlene-1,16-diyl)bisresorcinol。
2.2.9 化合物9 化合物9的分子式为C13H18O3,为黄色固体;ESI-MS:m/z221.1[M-H]-;1H-NMR(CD3OD,400 MHz)δH:6.46(1H,t,J=2.2 Hz,H-4),6.86(2H,d,J=2.2 Hz,H-3和H-5),0.85~0.96(3H,m,H-7′),1.23~1.43(6H,m,H-4′、H-5′和 H-6′),1.66(2H,dd,J=4.2、8.2,11.1 Hz,H-3′),2.89(2H,t,J=7.3 Hz,H-2′)。13C-NMR(CD3OD,100 MHz)δC:107.4(C-4),108.8(C-2和 C-6),140.4(C-1),160.0(C-3 和 C-5),203.3(C-1′),23.6(C-6′),23.8(C-5′),25.7(C-3′),30.1(C-4′),39.6(C-2′),14.4(C-7′)。以上波谱数据与文献[12]报道的已知化合物基本一致,故鉴定化合物9为1-(3,5-dihydroxyphenyl)heptan-1-one。
2.2.10 化合物10 化合物10的分子式为C13H20O2,为紫 色粉末;ESI-MS:m/z207.1[M-H]-;1H-NMR(CD3OD,400 MHz)δH:6.08(1H,t,J=2.2 Hz,H-2),6.12(2H,d,J=2.2 Hz,H-4 和 H-6),0.83~0.97(3H,m,H-13),1.22~1.40(10H,m,H-8、H-9、H-10、H-11 和H-12),2.43(2H,dd,J=6.7、8.6 Hz,H-7)。13C-NMR(CD3OD,100 MHz)δC:101.1(C-2),146.4(C-5),108.1(C-4和 C-6),159.4(C-1和 C-3),14.5(C-13),23.8(C-12),30.4(C-9 和 C-10),32.5(C-8),33.1(C-11),37.1(C-7)。以上波谱数据与文献[13]报道的已知化合物基本一致,故鉴定化合物10为5-heptylresorcinol。
2.2.11 化合物11 化合物11的分子式为C15H24O2,为白色粉末;ESI-MS:m/z235.1[M-H]-;1H-NMR(CDCl3,400 MHz)δH:6.07(1H,t,J=2.2 Hz,H-2),6.12(2H,d,J=2.2 Hz,H-4 和 H-6),0.88(3H,t,J=6.7 Hz,H-9′),1.25~1.37(12H,m,H-3′、H-4′、H-5′、H-6′、H-7′和H-8′),1.53~1.60(2H,m,H-2′),2.43(2H,dd,J=6.8、8.5 Hz,H-1′)。13C-NMR(CDCl3,100 MHz)δC:100.9(C-2),107.9(C-4 和 C-6),146.3(C-5),159.3(C-1 和C-3),14.4(C-9′),23.7(C-8′),30.3(C-3′),30.4(C-4′),30.5(C-5′),30.6(C-6′),32.4(C-2′),33.1(C-7′),37.0(C-1′)。以上波谱数据与文献[14]报道的已知化合物基本一致,故鉴定化合物11为5-n-nonylresorcinol。
2.3 化合物 11~1111的体外抗炎活性评价
2.3.1 溶液的制备 (1)样品溶液:精密称取化合物1~11各2.0 mg,溶于10%二甲基亚砜(DMSO)中,配制成质量浓度均为1 mg/mL的母液。根据预实验结果,用DMEM培养基将各化合物的母液稀释成质量浓度分别为80、40、20、10、5 μg/mL的样品溶液,备用。(2)阳性对照品溶液:精密称取地塞米松对照品2.0 mg,根据预实验结果,用10%DMSO溶解并配制成质量浓度为40 μg/mL的溶液,备用。
2.3.2 细胞活力的检测 采用MTT法进行检测。将RAW264.7细胞用完全培养基制成细胞密度为1×105个/mL的细胞悬液,然后按4 000个/孔的细胞密度接种于96孔板中。常规培养12 h后,将细胞分为空白对照组(空白培养基)、脂多糖组(1µg/mL脂多糖[15])、阳性对照组(1µg/mL脂多糖+40 μg/mL地塞米松)和不同质量浓度的化合物1~11组(1 μg/mL脂多糖+80、40、20、10、5 μg/mL的化合物1~11),每组设置4个复孔;另设不加细胞只加培养基的调零孔。各组细胞加入药物/空白培养基后,继续培养24 h,然后加入10µL MTT溶液(5 mg/mL)继续培养4 h,采用全波长酶标仪在450 nm波长处检测各孔的光密度(OD)值,并计算细胞存活率:细胞存活率(%)=(OD实验组-OD调零孔)/(OD空白对照组-OD调零孔)×100%。实验重复3次。采用GraphPad Prism 8软件对数据进行统计分析。数据以±s表示,采用单因素方差分析和Dunnett检验进行组间比较;检验水准α=0.05。结果见表1(表1中仅展示活性较好的化合物的检测结果)。
表1 化合物2、8~10对脂多糖诱导RAW264.7细胞活性的影响(±s,n=4,%%)
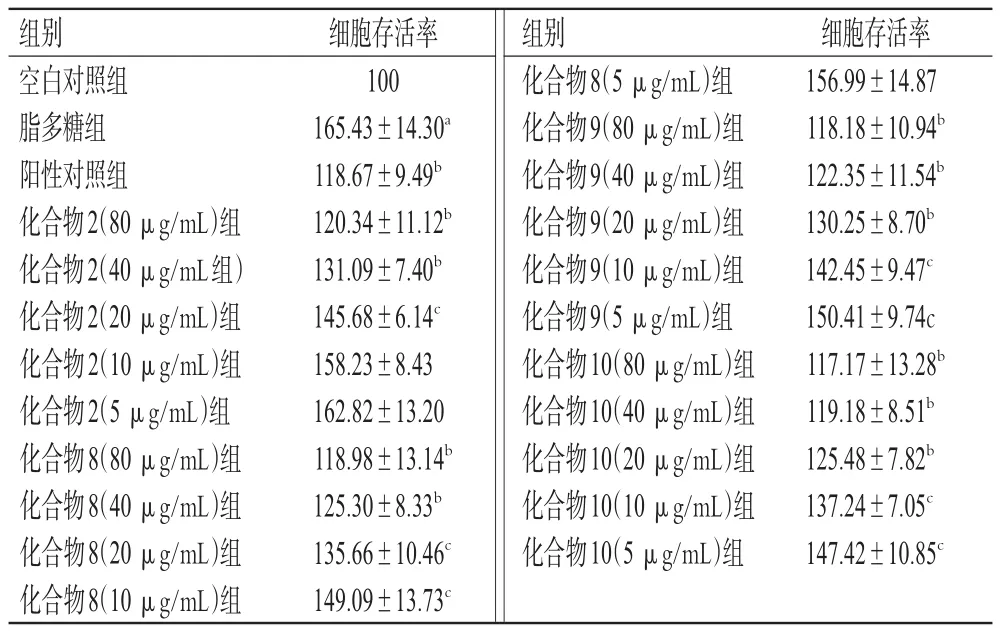
表1 化合物2、8~10对脂多糖诱导RAW264.7细胞活性的影响(±s,n=4,%%)
a:与空白对照组比较,P<0.01;b:与脂多糖组比较,P<0.01;c:与脂多糖组比较,P<0.05
组别空白对照组脂多糖组阳性对照组化合物2(80 μg/mL)组化合物2(40 μg/mL组)化合物2(20 μg/mL)组化合物2(10 μg/mL)组化合物2(5 μg/mL)组化合物8(80 μg/mL)组化合物8(40 μg/mL)组化合物8(20 μg/mL)组化合物8(10 μg/mL)组细胞存活率100 165.43±14.30a 118.67±9.49b 120.34±11.12b 131.09±7.40b 145.68±6.14c 158.23±8.43 162.82±13.20 118.98±13.14b 125.30±8.33b 135.66±10.46c 149.09±13.73c组别化合物 8(5 μg/mL)组化合物 9(80 μg/mL)组化合物 9(40 μg/mL)组化合物 9(20 μg/mL)组化合物 9(10 μg/mL)组化合物 9(5 μg/mL)组化合物 10(80 μg/mL)组化合物 10(40 μg/mL)组化合物 10(20 μg/mL)组化合物 10(10 μg/mL)组化合物 10(5 μg/mL)组细胞存活率156.99±14.87 118.18±10.94b 122.35±11.54b 130.25±8.70b 142.45±9.47c 150.41±9.74c 117.17±13.28b 119.18±8.51b 125.48±7.82b 137.24±7.05c 147.42±10.85c
由表1可知,与空白对照组比较,脂多糖组细胞的存活率显著升高(P<0.01);与脂多糖组比较,除化合物2的10、5 μg/mL组和化合物8的5 μg/mL组细胞的存活率下降不显著外(P>0.05),化合物2、8、9、10其余剂量组细胞存活率均显著下降(P<0.05或P<0.01)。
3 讨论
紫金牛属植物种类繁多且多具有药用价值,是民间常用药。目前,该属植物化学成分研究比较多的为朱砂根,从中发现种类最多的成分为朱砂根皂苷类化合物[16]。已有研究对纽子果的化学成分进行了研究,从中发现了苯酚类化合物[12]。然而有关纽子果的变种长叶纽子果的化学成分及药理活性研究却鲜有报道。
研究表明,紫金牛属药用植物中所含的化学成分具有多种药理活性:岩白菜素可抑制白细胞介素1β、肿瘤坏死因子α等炎症因子的产生,具有一定的止痛、抗炎活性[17];醌类成分可通过抑制血管生成而发挥抗关节炎作用[18]。本研究从长叶纽子果根70%乙醇提取物乙酸乙酯萃取部位中共分离、鉴定出了11个化合物,包括4个酚类化合物(化合物8~11)、1个三萜类化合物(化合物2)、1个单萜醇类化合物(化合物4)、1个甾体类化合物(化合物1)、2个脂肪酸酯类化合物(化合物5、7)、1个脂肪酸类化合物(化合物6)和1个其他类化合物(化合物3)。且化合物1~11均首次从该植物中分离得到,其中化合物8为新天然产物。据已有研究报道,酚类化合物具有抗菌、抗氧化活性[12,19],三萜类化合物具有抗肿瘤活性[6],甾体类具有抗炎活性[7]。本研究以脂多糖诱导建立RAW264.7炎症细胞模型,对分离、鉴定出的11个化合物进行了体外抗炎活性评价。结果发现,化合物2、8~10具有较好的抗炎活性。
综上,本研究从长叶纽子果根70%乙醇提取物乙酸乙酯萃取部位中共分离、鉴定出11个化合物,且主要以酚类化合物为主。其中,化合物8为新天然产物;化合物2、8~10均有一定抗炎活性。
