胃近端癌与远端癌中CEA与Ki-67的表达及临床意义
2022-10-10刘惠滨蔡国强林智鑫
刘惠滨,蔡国强,林智鑫
胃癌是目前临床上病例数较多的恶性肿瘤之一。根据日本胃癌学会制定的《日本胃癌处理规约》(第3版)[1]对胃癌的划分,分为近端胃癌和远端胃癌,近端胃癌指的是在患者胃部的上1/3位置的肿瘤,远端胃癌是指在患者胃大弯下1/3位置的肿瘤。胃癌是世界上最多发的恶性肿瘤之一,是多因素长期相互作用的结果,有一些高危的因素,像患有中重度的萎缩性胃炎或者慢性的胃溃疡,胃息肉等,同时合并像幽门螺旋杆菌感染,则容易导致胃癌的发生概率增高。根据最新的肿瘤流行病学调查研究[2]显示,胃癌的发病率在我国恶性肿瘤的发病中排2位,死亡率居第3位[3]。根据统计的全球胃癌数据[4],近几年胃癌的发病率和死亡率均有所下降,但是胃上部癌的发病率呈逐年上升的趋势,近端胃癌具有和远端胃癌不同的临床病理特点和预后。临床上对于胃癌近端的研究较少,以至于对于胃癌患者的底部检查准确率也较低,导致一直缺少有效治疗方案,临床上较多的胃癌患者发生部位都在远端,随着近年来胃癌近端的患者数量的增加,对于胃癌近端的发病机制以及特征都逐渐获得重视。目前肿瘤标志被广泛应用于癌症患者的检查与确诊中,早检查、早治疗是胃癌患者提高生存率的方法之一,有效保护患者的生命安全。因此,本研究旨在分析近端胃癌和远端胃癌中CEA和Ki-67表达的差异,为胃癌的基因治疗、精准治疗提供临床思路。
1 材料和方法
1.1 一般资料 本研究收集莆田学院附属医院2018年6月—2019年6月手术成功的连续的进展期胃癌病例。我院病理科对胃癌术后标本进行常规病理检查,同时对胃癌组织进行CEA、Ki-67的检测。检测方法采用免疫组化的方法,由病理科进行,结果判定由2位病理科医师采用双盲法独立观察,若两者判断结果差异较大,则由第3位年资更高的病理科医师最终判定其结果。
1.2 方法 CEA染色结果判定:以细胞膜或胞质内出现黄色至棕褐色颗粒为阳性着色,采用半定量积分法判定[5]。按阳性着色程度评分:0分为无着色,与背景色一致;1分为浅黄色,略高于背景色;2分为棕黄色,明显高于背景色;3分为棕褐色。按阳性细胞所占比例评分:0分为阴性;1分为<10%;2分为11%~50%;3分为51%~75%;4分为>75%。根据两者乘积判定阳性结果:0~2分为阴性(-),3~4分为弱阳性(+),5~8分为中度阳性(+ +),9~12分为强阳性(+ + +),+~+ + +为阳性表达。见图1。
Ki-67在胃癌组织中的阳性表达部位是胞核,棕黄色颗粒状,呈灶状或者弥漫分布[6]。Ki-67的阳性结果可根据Ki-67的标记指数(Ki-67LI)分四级:0%~10%为Ⅰ级;11%~20%为Ⅱ级;21%~50%为Ⅲ级;大于50%为Ⅳ级。Ki-67LI=Ki-67阳性细胞数/100个细胞。在胃癌的相关研究中,Ki-67LI的截断值到目前尚无明确标准,之前的一些研究[7]提出的截断值从1%~53%不等,本研究为了方便统计,阳性指数为<50%归类为低表达,将阳性指数≥50%归类为高表达。见图2。
1.3 统计学方法 采用统计学软件SPSS 23.0对数据进行处理。CEA和Ki-67在近端和远端胃癌中的表达情况及与胃癌临床病理生理特点的关系采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 CEA和Ki-67在近端及远端胃癌组织中的表达 CEA在近端和远端胃癌中的阳性表达率分别为90.3%和94.3%,差异无统计学意义(P>0.05);Ki-67在近端和远端胃癌中的高表达率分别为83.3%和85.7%,差异无统计学意义(P>0.05)。见表1。

表1 CEA和Ki-67在近端及远端胃癌组织中的表达
2.2 CEA在近、远端胃癌阳性表达率的影响因素分析 CEA在近、远端胃癌的阳性表达率与胃癌患者性别、年龄、肿瘤大小、淋巴结是否转移以及病理分期无关,差异无统计学意义(P>0.05)。见表2。
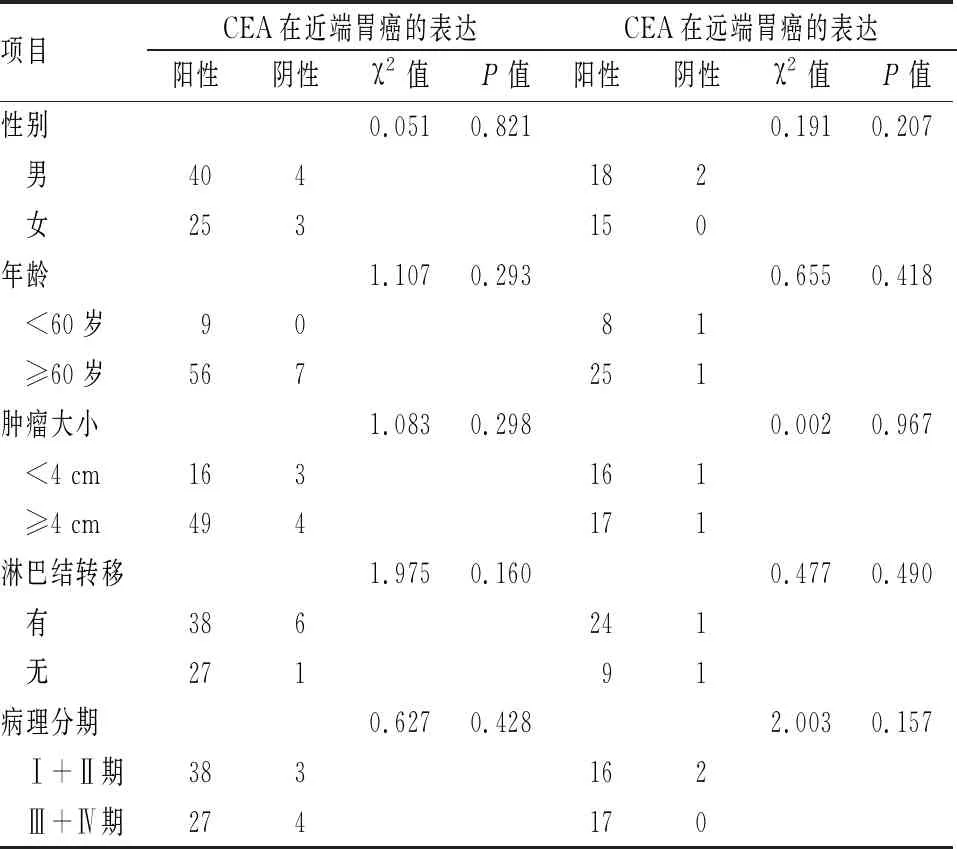
表2 CEA在近、远端胃癌阳性表达率影响因素
2.3 Ki-67在近、远端胃癌高表达率的影响因素分析 Ki-67在近、远端胃癌的高表达率与胃癌患者性别、年龄、肿瘤大小、淋巴结是否转移以及病理分期无关,差异无统计学意义(P>0.05)。见表3。

表3 Ki-67在近、远端胃癌高表达率影响因素
3 讨论
近年来,胃癌的发病率呈下降趋势,但是大部分都是远端胃癌。随着近端胃癌的备受重视,发现近端胃癌的发病率却呈上升趋势,主要原因是近端胃癌肿瘤细胞分化程度较低,早期检查时非常难以发现,并且近端胃癌的死亡率也高于远端胃癌患者。我国对于癌症患者的检测一般采用胃镜,但是大众对于胃镜的接受度较低,日本目前是全世界胃癌早期诊断率较高的国家之一,我国的胃癌早期诊断率却较低。因此,一种方便快捷,操作简单,经济实惠的早期检测手段对于我国的胃癌患者非常重要。
CEA是大肠癌组织产生的一种肿瘤胚胎性抗原,可引起患者的免疫反应,广泛存在于内胚叶起源的消化系统癌,也存在于正常胚胎的消化管组织中,在正常人血清中也可有微量存在,其对消化系统肿瘤的检测具有较高的特异性[8-9]。癌胚抗原是一个广谱性肿瘤标志物,它能向人们反映出多种肿瘤的存在,对大肠癌、乳腺癌和肺癌的疗效判断、病情发展、监测和预后估计是一个较好的肿瘤标志物,但其特异性不强,灵敏度不高,对肿瘤早期诊断作用不明显[10]。有研究[11]报道,胃癌组织中CEA检测的阳性率有68.3%和92.8%,本研究结果显示CEA在近端胃癌和远端胃癌中的阳性表达率分别为90.3%和94.3%,与相关研究一致。但是本研究发现,CEA在近、远端胃癌的阳性表达率差异无统计学意义,且CEA在近、远端胃癌中的表达均与患者的性别、年龄、肿瘤大小、淋巴结是否转移及病理分期无关。该结果表明CEA在胃癌中的表达与胃癌的发生部位无关且不受患者临床病理生理特点的影响。
Ki-67是一种与细胞增殖相关的抗原,与核糖体RNA转录有关,可以作为一个细胞增殖的标记物[12]。Ki-67的变化方式主要和抗原的表达有关,一般处于除G0期外的细胞增殖周期的各个时期(G1,S,G2和M),在G1时期开始表达,在M时期表达开始增加,并且有研究[13]得出,胃部组织浸润越深,Ki-67表达率越高,但在细胞静止期G0期不表达。在病理报告中的指数高低与许多肿瘤分化程度、浸润、转移及预后密切相关。研究[14-15]表明Ki-67的表达与肿瘤的侵袭性关系密切,如胃癌、前列腺癌、乳腺癌、肝癌等。本研究结果发现近、远端胃癌中Ki-67的高表达率分别为83.3%和85.7%,差异无统计学意义,说明近、远端胃癌的侵袭性可能相同,这与相关学者研究[16-17]结果认为的近端胃癌具有更强侵袭性存在矛盾。但本研究未对不同分期的近、远端胃癌进行亚组分析,可能导致本研究得到阴性结果。此外,本研究结果提示,近端胃癌和远端胃癌中Ki-67的高表达率与胃癌患者的性别、年龄、肿瘤大小、淋巴结是否转移及病理分期无关,这与国内外的一些研究结果相似,Czyzewsja等[18]报道Ki67表达与年龄、部位无关;Oshima等[19]报道Ki67表达与年龄、分期、性别和预后等均无明显相关;黄国良[20]研究认为胃腺癌组织Ki-67高表达与淋巴结转移无相关性;李彩苹[21]认为Ki-67与胃癌的远处转移无明显相关性。
如前所述,相关研究已经证实近、远端胃癌存在病理生理方面的差异,但是目前尚未有胃癌相关基因层面研究分析其原因,目前的研究多体现胃癌组织和正常组织中一些基因表达的差异,如刘月萍等[22]通过免疫组织化学法检测,发现P53在胃良性病变中表达较弱,在癌前病变和胃癌中表达逐渐增强,提示P53过度表达与胃癌及癌前病变的发生发展有关;李楠等[23]研究发现SEPTIN9在胃癌组织中高表达,并且在低分化胃癌组织中的高表达率高于高分化胃癌组织,差异具有统计学意义。也有一些学者研究已经发现了近、远端胃癌在一些基因表达方面的差异,如Tanner等[24]研究发现近端胃癌中HER2的阳性率高于远端胃癌中HER2的阳性率,且HER2阳性患者表现为更差的生存预后(P=0.089);Kim等[25]研究显示smad4在近端胃癌中表达缺失率高于非近端癌,差异具有统计学意义,且smad4的表达缺失与胃癌的不良预后密切相关。
综上所述,尽管本研究得到为阴性的结果,但能给近、远端胃癌的基因研究提供一个思路,为近、远端胃癌的基因精准治疗提供实验基础。
